文章背景:
Reference: Evaluating spectral cytometry for immune profiling in viral disease
Cytometry PART A杂志(定量单细胞分析杂志),收录了采用定量单细胞测量、分离、操作和建模技术的创新科学研究的原创研究报告和评论,以及通过单细胞技术获得的分子和细胞功能机制的原创文章。
一、 实验背景
在传统的荧光细胞术中,通过使用宽带通滤光器,在目标检测器中测量面板中存在的每个荧光团。相比之下,光谱细胞术使用大量带有窄带通滤波器的检测器来测量光谱中荧光团的信号,从而为每个荧光团解析更详细的荧光特征。
光谱方法在增加面板设计的灵活性和改进荧光信号的测量方面显示出前景。然而,很少有人报告传统和光谱系统之间的数据比较。因此,作者试图将现代传统细胞仪系统与现代光谱系统进行比较,并从流式细胞仪用户的角度评估所得数据集的质量。
结论:光谱细胞术方法与传统细胞术上的数据几乎一致,然而大量的检测器和光谱分离方法的集成提供了许多潜在的优势。

△点击放大图片
二、 光谱流式与常规流式的原理比较
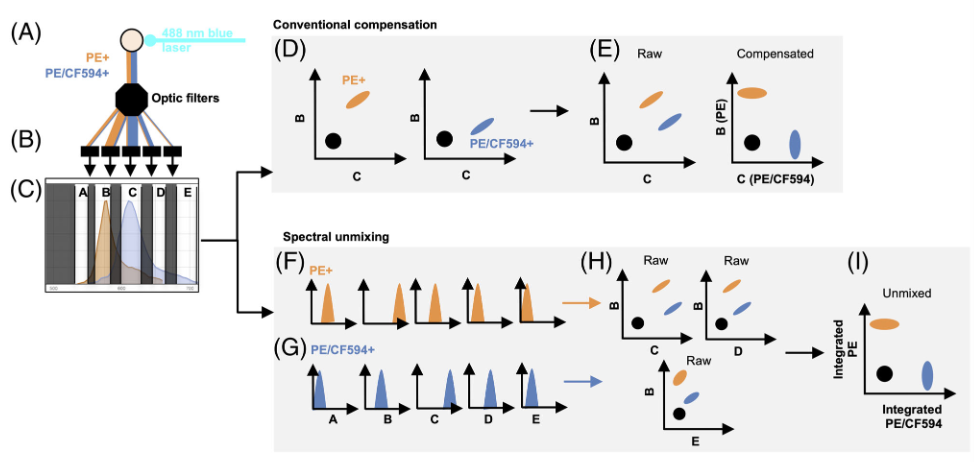
图1. 488nm蓝色激光激发两个荧光团,PE和PE/CF594
△点击放大图片
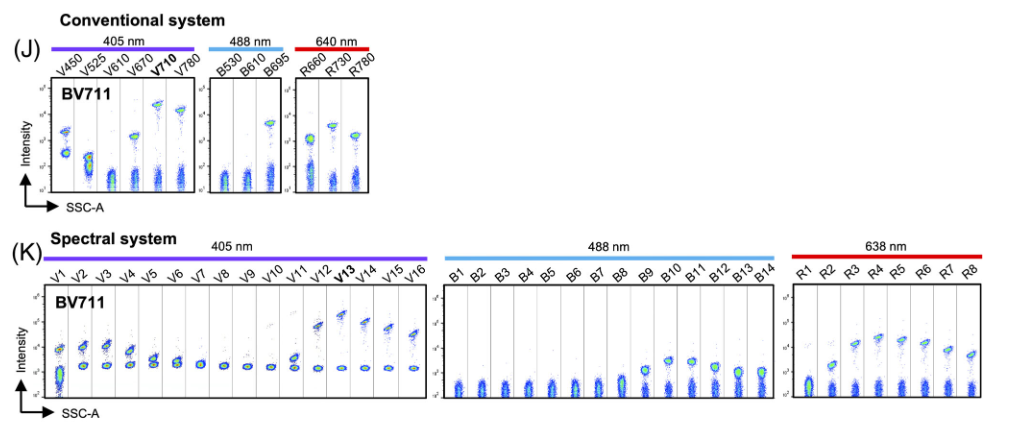
图2. BV711染色的补偿珠在采集后常规流式和光谱流式结果
△点击放大图片
1) 光谱流式具有大量窄带通特性的探测器,尽可能多地测量荧光团的整个发射光谱,而不是在具有宽带通特性的单个探测器中测量峰值发射。
2) 光谱流式可以确定单个样本中细胞自发荧光的特征,从而可以将自发荧光从受影响的通道中分离出来,并将自发荧光的测量作为一个附加特征。
三、 常规流式和光谱流式的染色比较
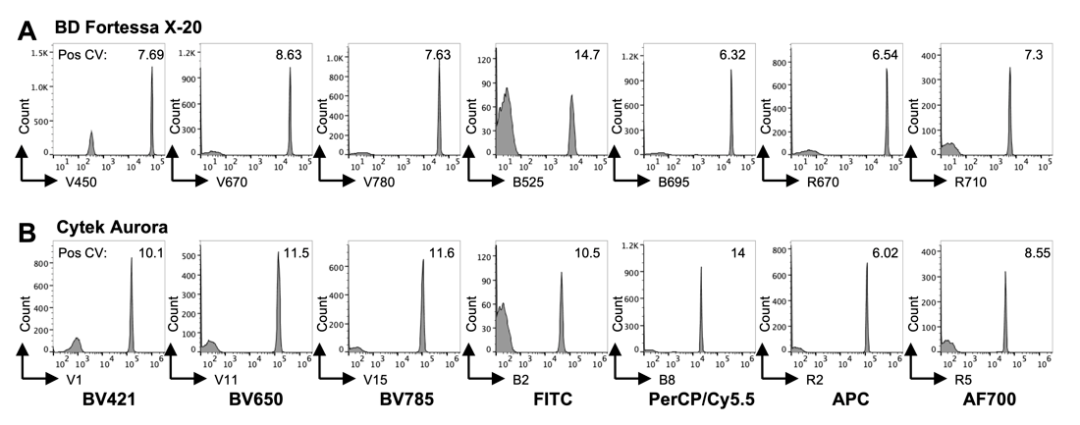
图3.常规流式和光谱流式之间的荧光信号CV比较
△点击放大图片
1) 结果显示两种检测方式荧光信号CV相似,表明信号质量相似。
四、 常规流式和光谱流式的信号扩散和分辨率比较
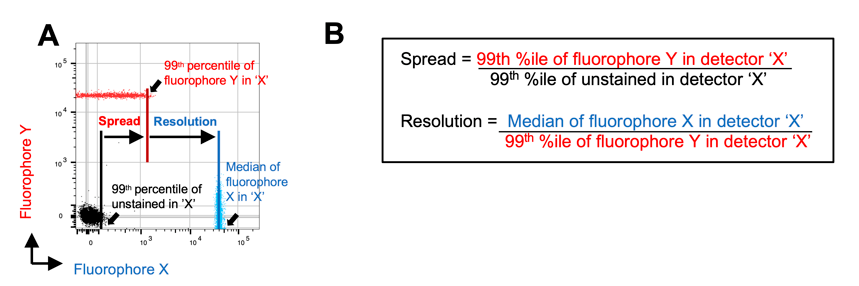
图4.信号扩散和分辨率的计算方式
△点击放大图片
△点击放大图片
△点击放大图片
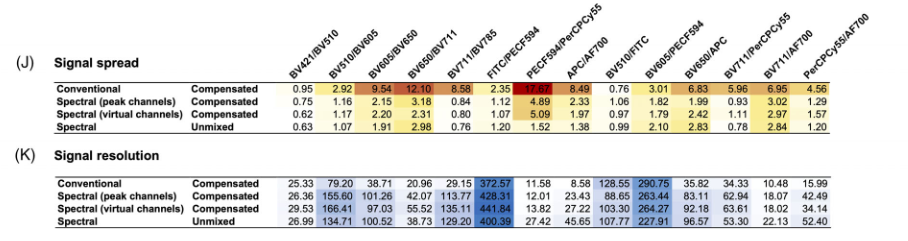
图5.常规流式和光谱流式的信号扩散和分辨率比较
△点击放大图片
1) 与光谱流式相比,常规流式在所有测量的荧光团上的扩散程度总体上更高。
2) 与光谱流式相比,常规流式的接收检测器中的信号强度(蓝色)更高,因此扩散程度的增加对来自扩散程度造成影响的信号的分辨率没有太大影响
3) 与常规流式相比,尽管光谱流式上的扩散程度减少了,但从红色信号到蓝色信号的分辨率没有变化
五、 光谱流式解析和补偿调节分离高度重叠的荧光团
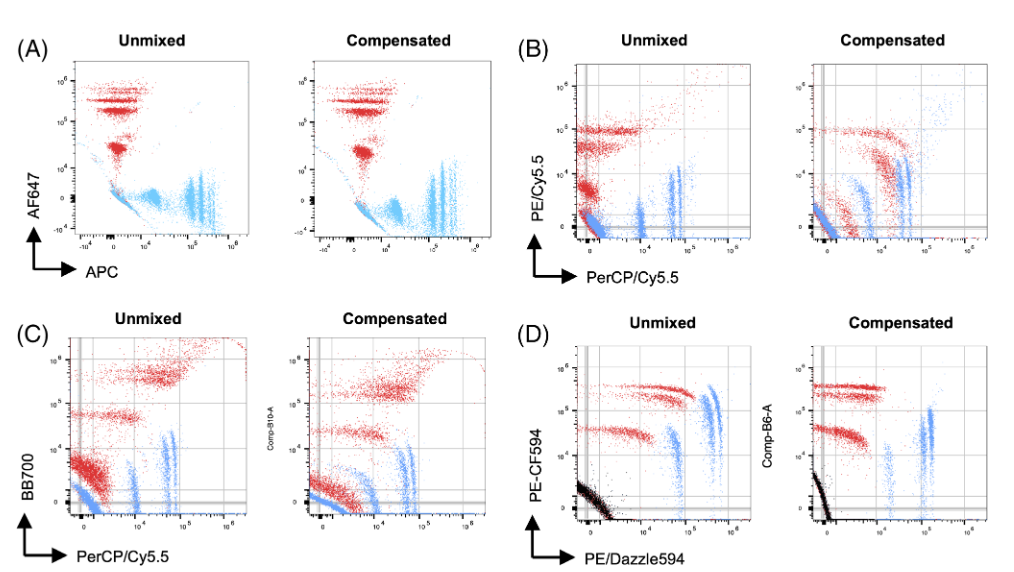
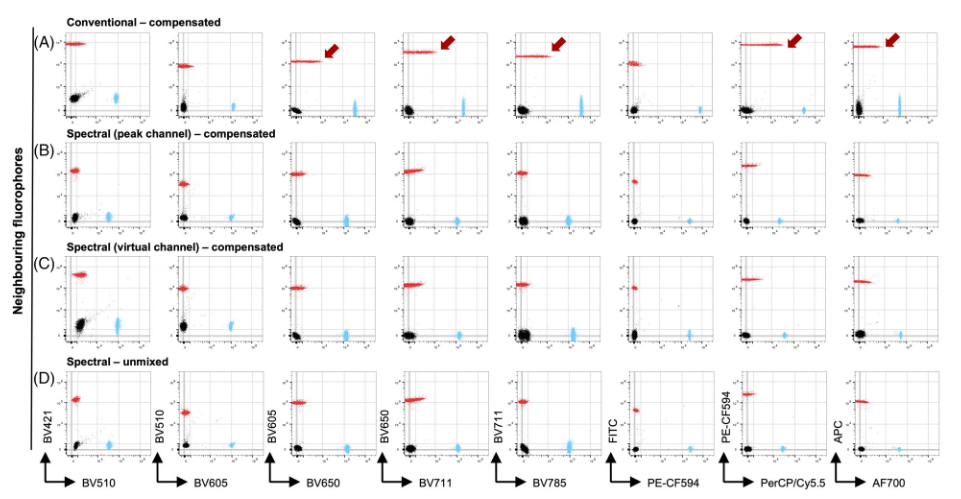
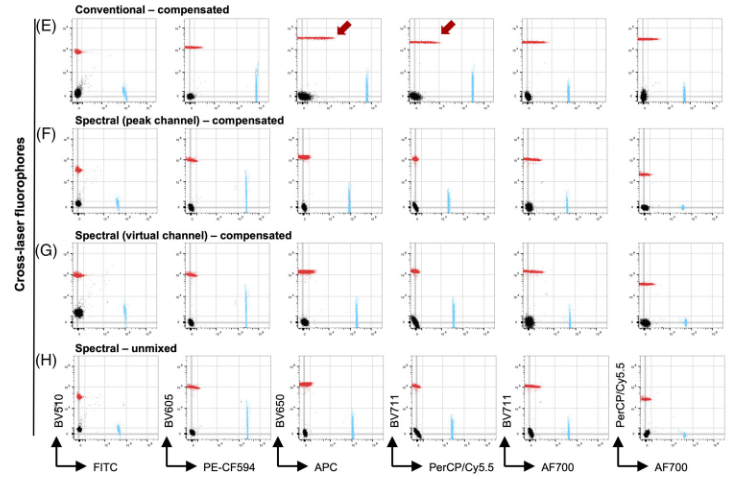
图6. 光谱流式上补偿和光谱解析的比较
△点击放大图片
1) 与(峰值通道)补偿相比,当进行数据解析时,两个相似荧光素信号彼此之间的分辨率明显更好(图6.B-C)
2) 尽管如此,作者还发现了一些补偿比解析产生更好的信号分辨率的例子(图6.D)
六、 常规与光谱流式中白细胞方案的比较
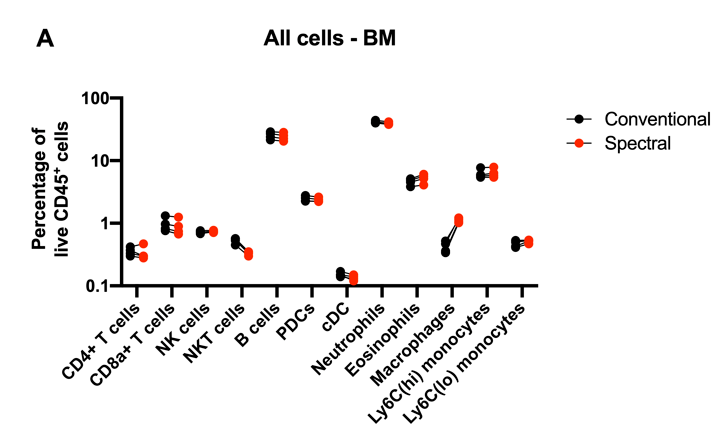
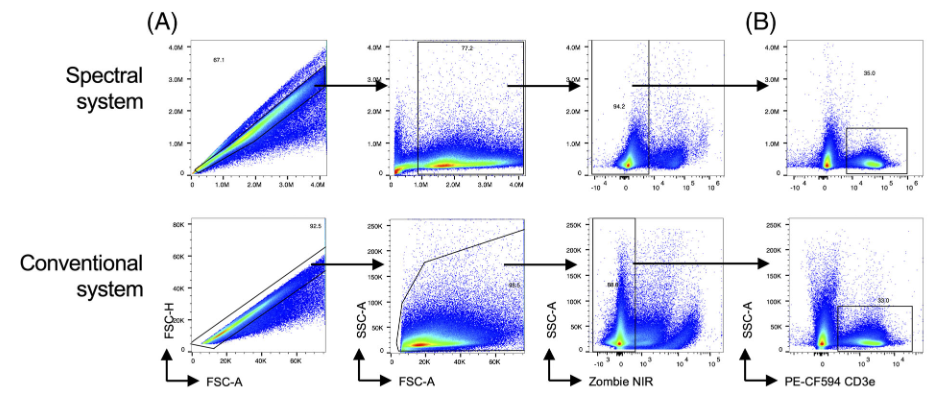
1)作者检测了来自模拟感染动物的骨髓细胞,并比较了在光谱和常规流式上产生的单个细胞→主细胞群→活细胞→白细胞的数据
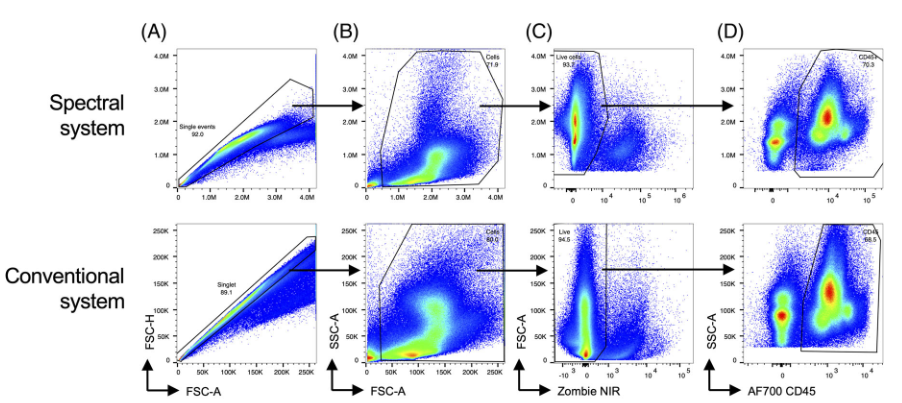
△点击放大图片
2)T细胞、NK细胞、NKT细胞、CD4+T细胞、CD8α+T细胞,浆细胞样树突状细胞(pDC)、B细胞、常规树突状细胞(cDC)
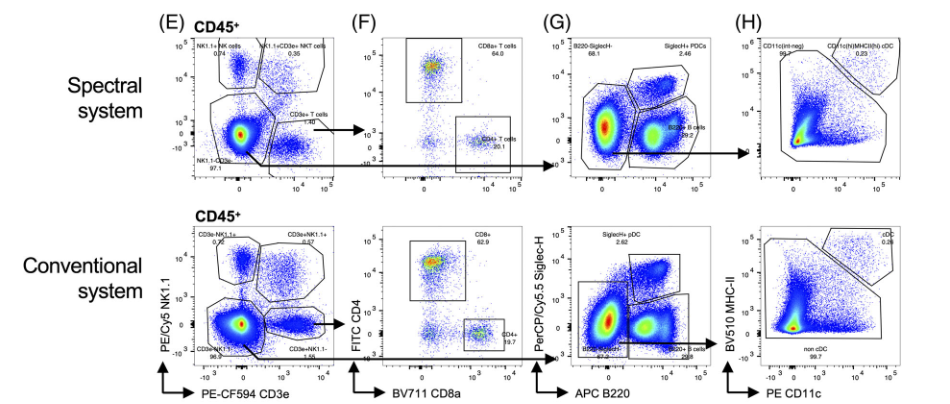
△点击放大图片
3)中性粒细胞、嗜酸性粒细胞、常驻巨噬细胞、Ly6Chi单核细胞和Ly6Clo单核细胞
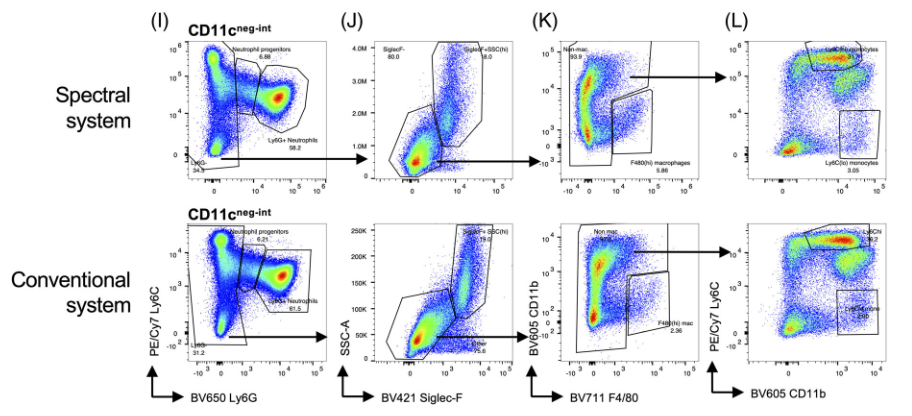
△点击放大图片
△点击放大图片
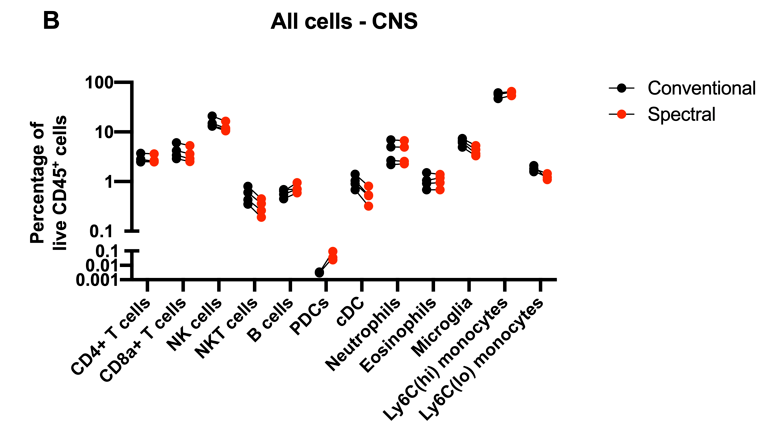
结论1:总的来说,这些细胞亚群的染色结果在很大程度上是具有可比性的
4)除了检查正常骨髓外,作者还试图在核内染色更复杂的测定中比较两种检测方式的分辨率。为此,作者设计了一个小鼠脾脏中调节性T细胞的七色方案。检测了单个细胞、细胞、活细胞(图A)、T细胞(图B)、CD4+和CD8α+T细胞(图C);在CD4+T细胞群体中,鉴定了FoxP3+CD25+调节性T细胞(图D,左侧),使用荧光减一(FMO)样品来确定群体的圈门位置(图D,中间和右侧)。
结论2:作者在这个案例中发现了两个显著的差异。AF700 CD4从BV711 CD8α扩散的分辨率在光谱系统上得到了提高,APC FoxP3从背景的分辨率也得到了提高。
△点击放大图片
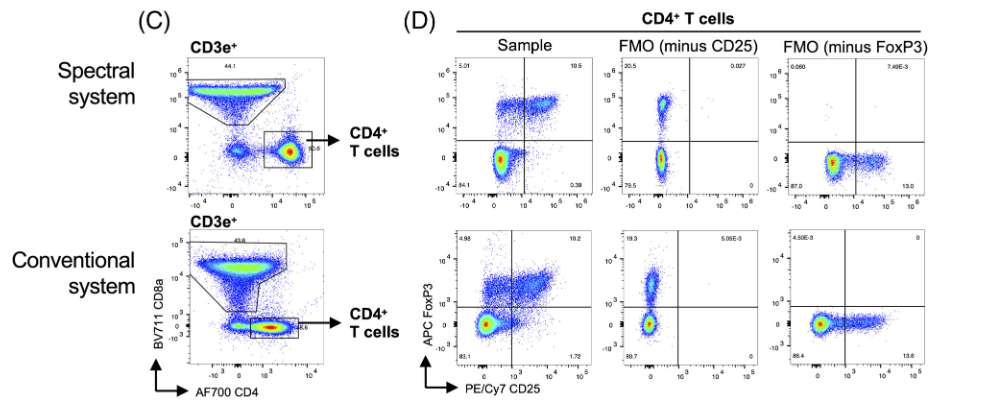
△点击放大图片
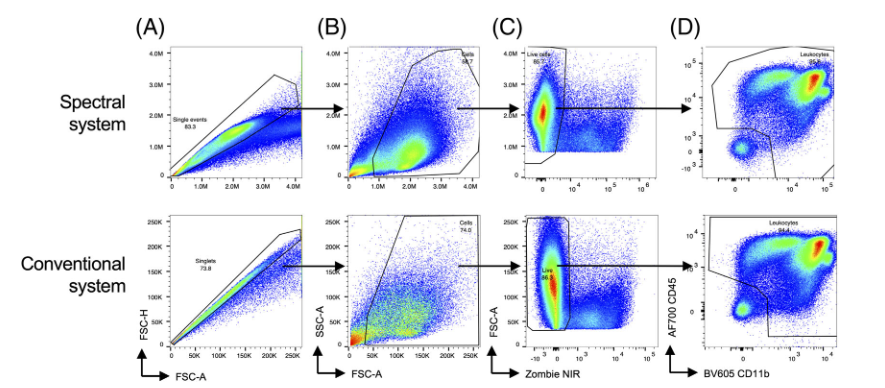
七、 常规与光谱流式中的大脑样本的比较
作者还试图比较更高的自发荧光样品。为此,作者用WNV(西尼罗河病毒)感染小鼠,并在感染后7天分离脑组织进行流式细胞术。
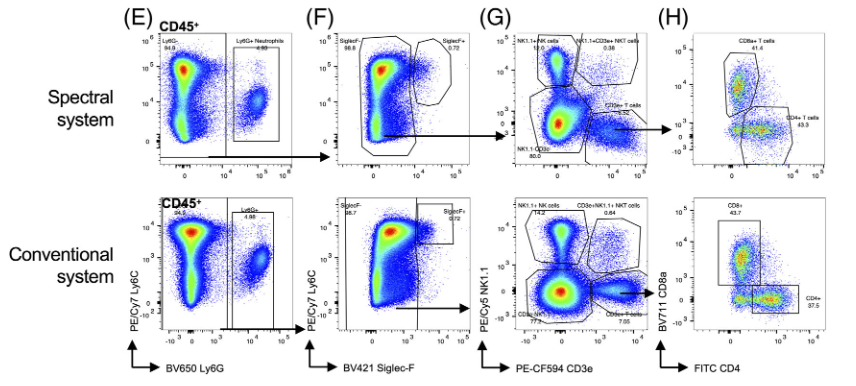
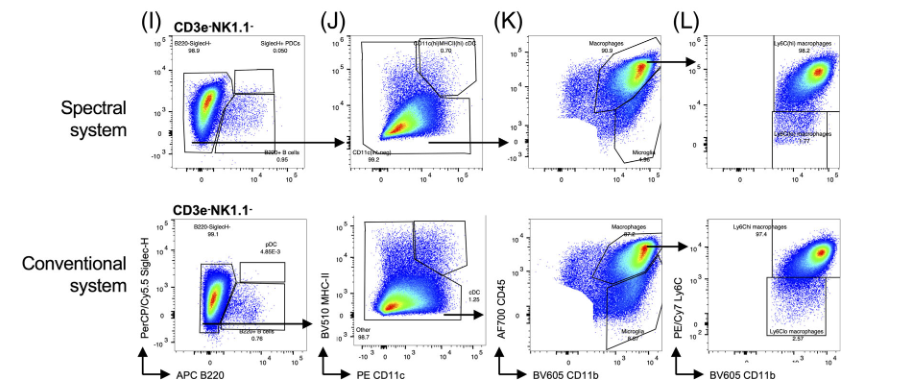
检测了单个细胞、细胞、活细胞、白细胞(图A–D)、中性粒细胞、嗜酸性粒细胞、NK细胞、NKT细胞、CD4+T细胞、CD8α+T细胞(图E–H)、pDCs、B细胞、cDC、小胶质细胞、Ly6Chi和Ly6Clo浸润的单核细胞(图I–L)。
结论:1. 发现两个流式检测方法之间的染色结果相似;2. 但在高自发荧光区域中测量的荧光团的分辨率在常规与光谱流式上获得的结果明显不同。
△点击放大图片
△点击放大图片
△点击放大图片
△点击放大图片
八、 样本自发荧光提取
光谱方法的另一个优点是在自发荧光的分离测量中。通过测量未染色细胞的整个荧光光谱,并将该荧光标记作为另一个荧光团处理,自荧光信号可以用作细胞鉴定的另一个标记,例如中性粒细胞或衰老细胞。或者,可以通过将信号与其他信号分离来减少自发荧光信号,这可能会提高某些通道的分辨率,特别是对于来自肝脏、大脑和皮肤等高度自发荧光器官的细胞。
1)将未染色大脑样本的荧光光谱与各种荧光团的光谱进行比较,可以清楚地看出,FITC和BV510的干扰最大(图A);在染色的样本中也很明显,由于自发荧光干扰,几乎不可能区分个体群体(图B);当应用自体荧光提取时,群体变得清晰(图C),增加了测量群体的分辨率。
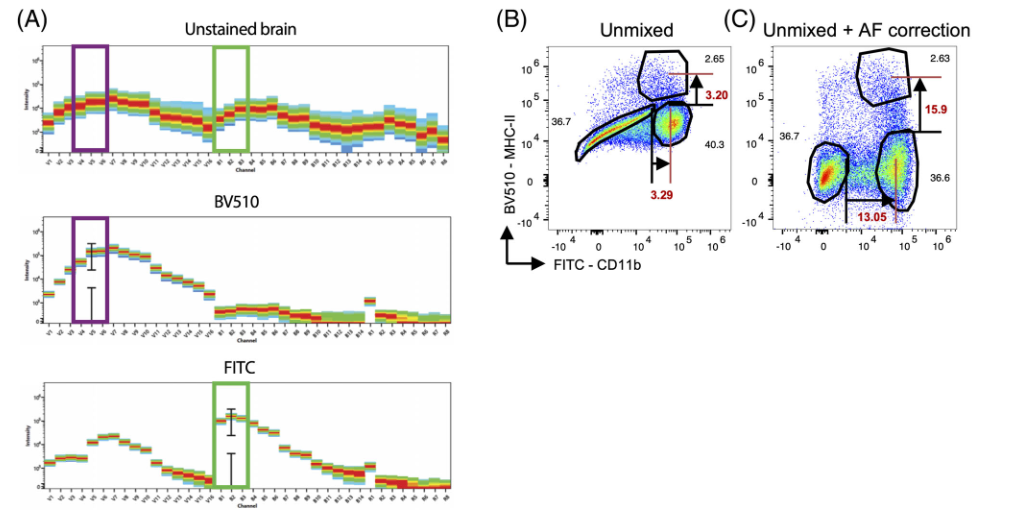
△点击放大图片
2)BV605也处于自发荧光影响信号的区域(图D),尽管干扰比FITC和BV510小得多(图E-F)
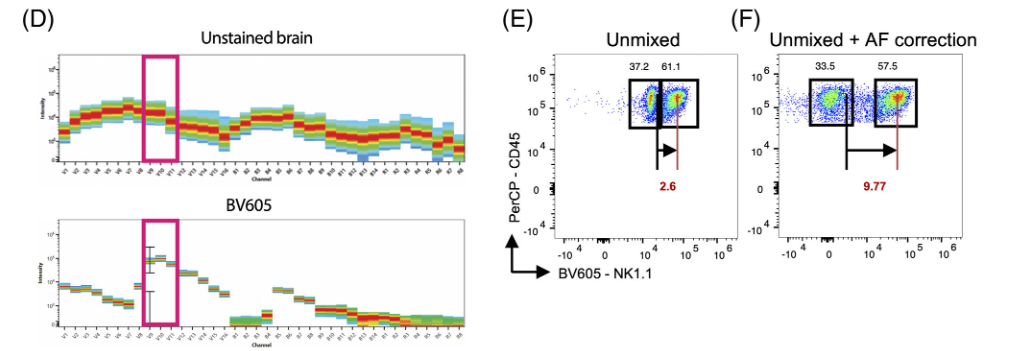
△点击放大图片
3)当检查780nm区域周围的光谱时(图G),自发荧光对这些样本中的信号几乎没有影响,因此减去自发荧光并不能显著提高分辨率(图H-I)
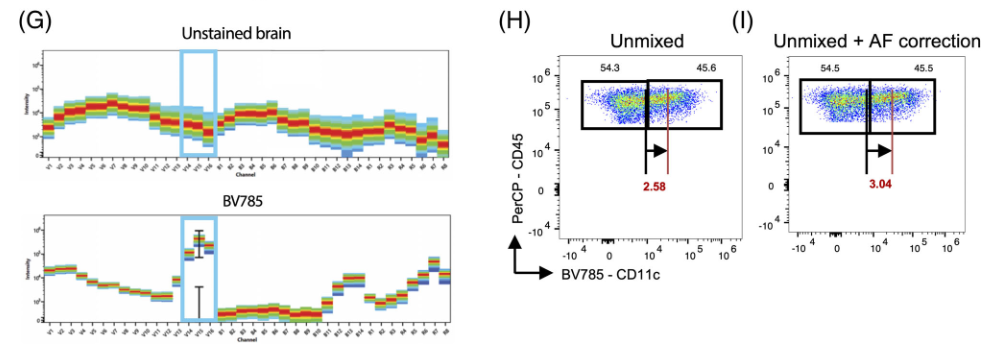
△点击放大图片
光谱流式通过对每个荧光团的荧光光谱进行详细测量,提供了与常规流式相比的许多潜在优势。总的来说,当对任何一个荧光素进行补偿或光谱分解时,这些两种检测方式都是可比较的。然而,这两种方法之间的一些差异还是显而易见的。