
△点击放大图片
在人SLE中,红细胞线粒体的保留触发骨髓依赖型I型干扰素

△点击放大图片
背景部分介绍:
系统性红斑狼疮(SLE)被认为是I型干扰素病的原型。因此,重组干扰素(IFN)诱导狼疮样综合征与自发性SLE难以区分。此外,在很大一部分患者的血液中存在IFN刺激基因(ISG)转录标记。此外,全基因组关联研究(GWASs)强调了编码核酸(NA)降解和传感分子以及I型IFN信号通路的基因对SLE易感性的贡献。
线粒体功能障碍与SLE发病机制有关。因此,SLE中性粒细胞挤压氧化线粒体DNA,一种强效的干扰素刺激。此外,琥珀酸驱动的线粒体活性氧(mtROS)的积累是SLE儿童中独特的CD4+ T细胞辅助亚群扩增的特征。
为了确定线粒体功能障碍是否影响SLE患者的其他细胞系,该文章研究了红细胞(RBC)的生命周期,因为线粒体清除是红细胞成熟的一个特征。利用小分子抑制剂和来自泛素-蛋白酶体系统(UPS)功能遗传缺陷患者的细胞(慢性非典型中性粒细胞皮肤病伴脂肪营养不良和高温综合征[CANDLE],作者证明了缺氧诱导因子(HIF)介导的代谢开关调节UPS的激活,这是在人类红细胞成熟过程中线粒体自噬的上游。
为了更好的理解本文,这里将红细胞的增生发育过程列出:
多能干细胞→单能干细胞→原始红细胞→早幼红细胞→中幼红细胞→晚幼红细胞→网织红细胞→成熟红细胞
其中,当处于网织红细胞阶段时,细胞含有少量的RNA,用煌焦油蓝染色染色成网状,因此称为网织红细胞。成熟的红细胞完全不含有线粒体DNA,但在SLE患者中,成熟的红细胞中却仍然存在线粒体,那么这种情况又会对系统性红斑狼疮产生什么影响呢?接下来我们详细拆解一下作者的研究结果。
主要结果部分
01表型:活跃期SLE患者的红细胞保留有线粒体
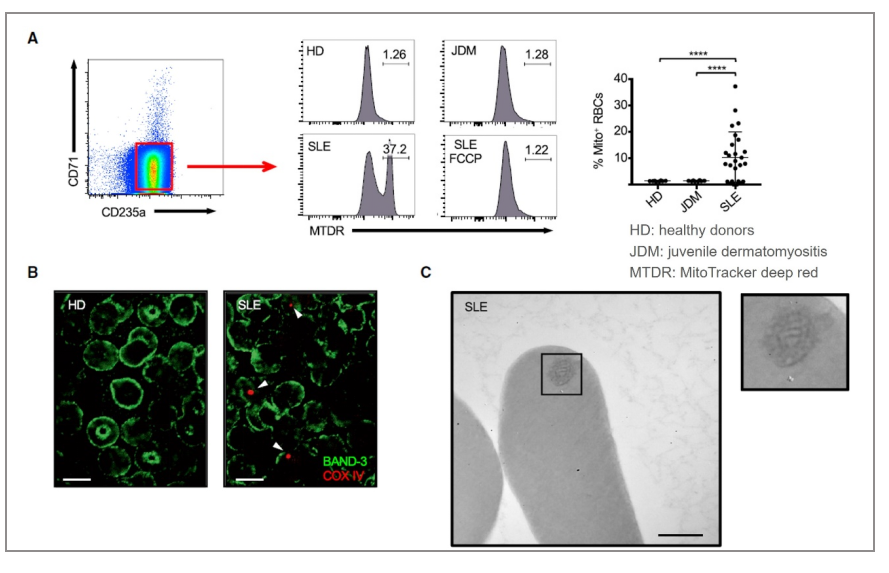
△点击放大图片
经检测发现SLE患者中Mito+RBC比例较高(A),另线粒体标记物细胞色素c氧化酶亚基4 (COXIV)的免疫组织化学(B)和透射电镜(TEM)分析(C)证实,部分成熟SLE红细胞中存在线粒体样细胞器。
02成熟红细胞特征:PBMC衍生的红细胞作为研究人类红细胞生成的模型
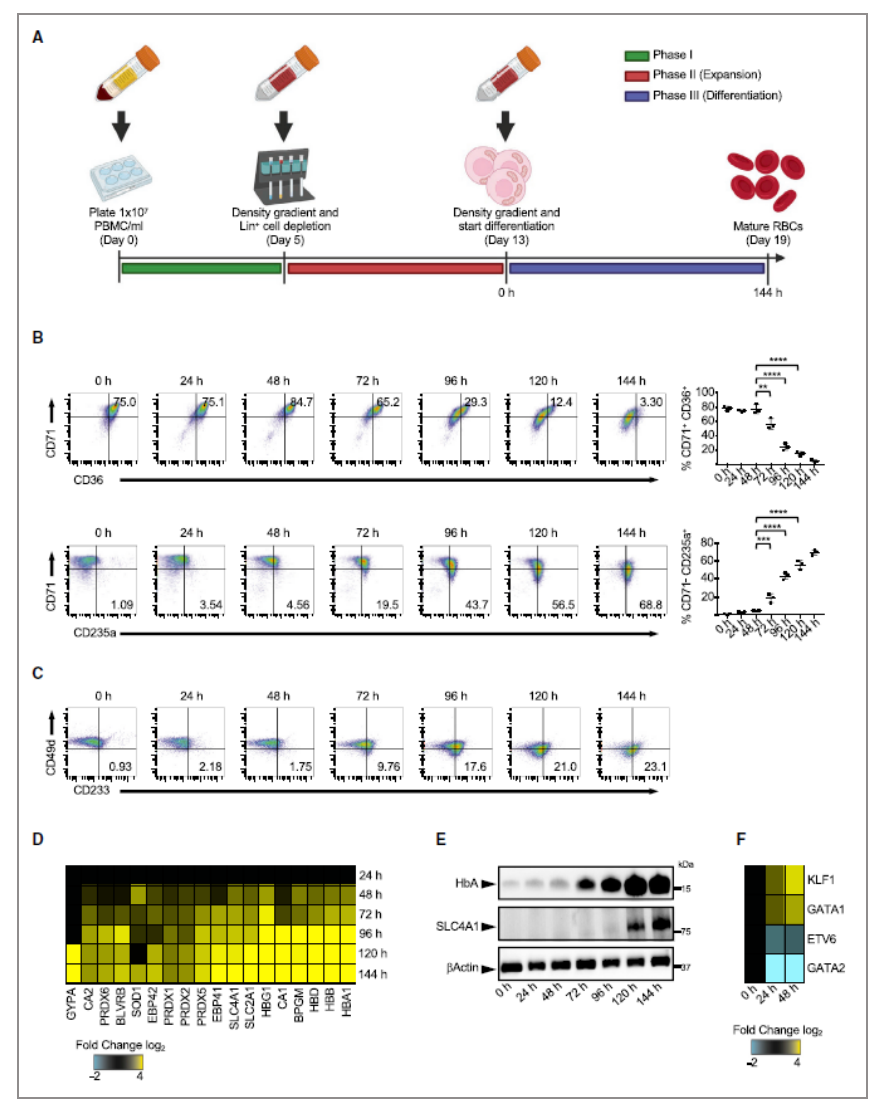
△点击放大图片
作者采用外周血单核细胞来进行红细胞成熟过程中特征的分析(A),发现在红细胞成熟过程中CD71, CD36, CD49d表达量有所下降,而CD235a, CD233的表达量提高(B, C);随着成熟过程的进行,发现红细胞特异性膜蛋白GYPA, EBP42, EBP41, SLC4A1, SLC2A1随时间表达量逐步增加,及相关酶CA2, PRDXs, BLVRB, SOD1, CA1, BPGM和不同的血红蛋白HB(D);与此同时红细胞相关转录因子GATA1, KLF1表达量增加的过程中,伴随HSPC相关转录因子ETV6, GATA2表达量的降低(E, F)。
03mtDNA降解机制:在人红细胞生成过程中,UPS的激活对线粒体自噬的进展至关重要
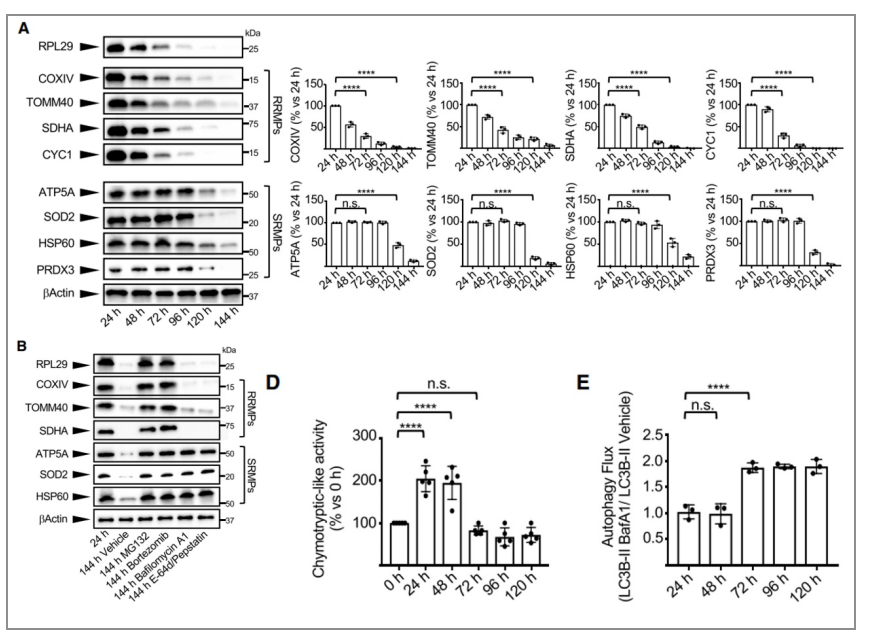
△点击放大图片
在小鼠网状细胞成熟的最后阶段,线粒体的移除与线粒体自噬有关,然而,它在人类终末红细胞分化中的作用尚未完全阐明。令人惊讶的是,经实验分析结果表明,线粒体蛋白根据其降解率分为两大类:一组蛋白质在分化过程中被快速移除(快速移除线粒体蛋白RRMPs),另一组要到稍后的时间点(缓慢去除线粒体蛋白SRMPs)(A),这表明线粒体自噬可能不是人类红细胞生成过程中调节线粒体降解的唯一机制。
越来越多的证据表明,在线粒体残体通过线粒体自噬去除之前,选定的线粒体蛋白质被UPS迅速降解。实验发现RRMPs对UPS抑制剂(MG132或硼替佐米)敏感,但对自噬抑制剂(巴菲霉素A1或E-64d/Pepstatin)不敏感,相反,自噬阻断显著降低了SRMPs的消除(B),这说明RRMPs可能通过UPS降解而SRMPs通过自噬降解。另外UPS活性在红细胞原分化的早期阶段达到最大值,而自噬通量仅在较晚的时间点增加,说明UPS降解在自噬降解之前(D, E)这一逻辑关系。
04代谢转变:在人红细胞生成过程中,HIF-2α介导的代谢重编程是UPS激活的上游
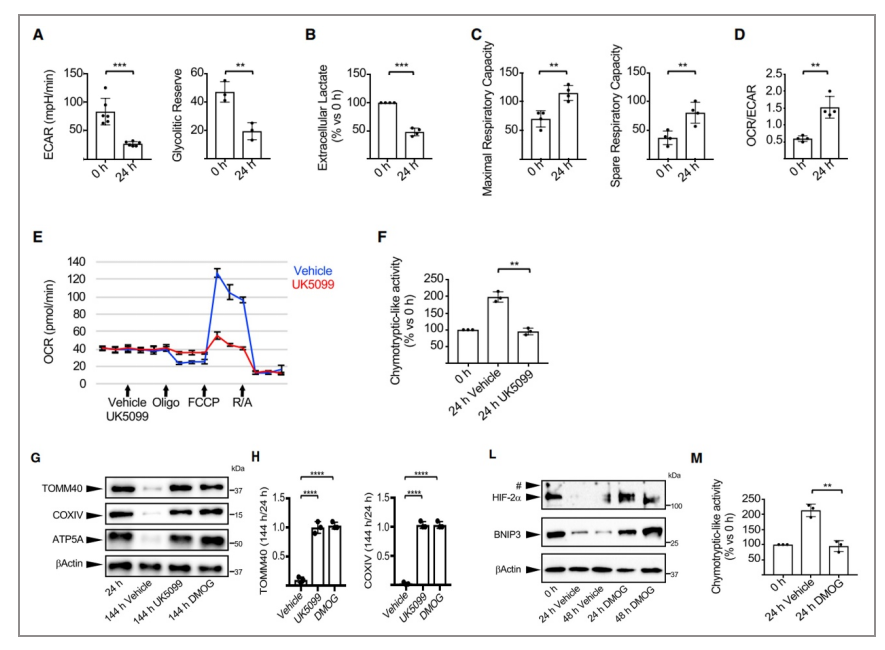
△点击放大图片
下一步,作者检测了细胞酸化率、糖降解储备和胞外乳酸,发现在原红细胞分化后均降低在(A, B),原红细胞分化后,代谢向OXPHOS转变(C, D)。为了验证代谢转变与UPS活性之间的关系,使用抑制剂UK5099(丙酮酸载体抑制剂)处理,发现代谢转变发生了抑制(E, F),且显著降低了UPS激活和线粒体去除(G, H)。
接下来,作者又对HIF-2α及其转录靶基因BNIP3等进行了检测,发现在原红细胞分化过程中均下调(L),使用DMOG(一种缺氧模拟药)阻止HIF-2α降解,减弱了糖酵解至OXPHOS的转变,同时也显示UPS活性和线粒体去除的降低(G, H, M)。
05机制:在SLE红细胞中,HIF-2α介导的代谢转变和UPS激活受损
△点击放大图片
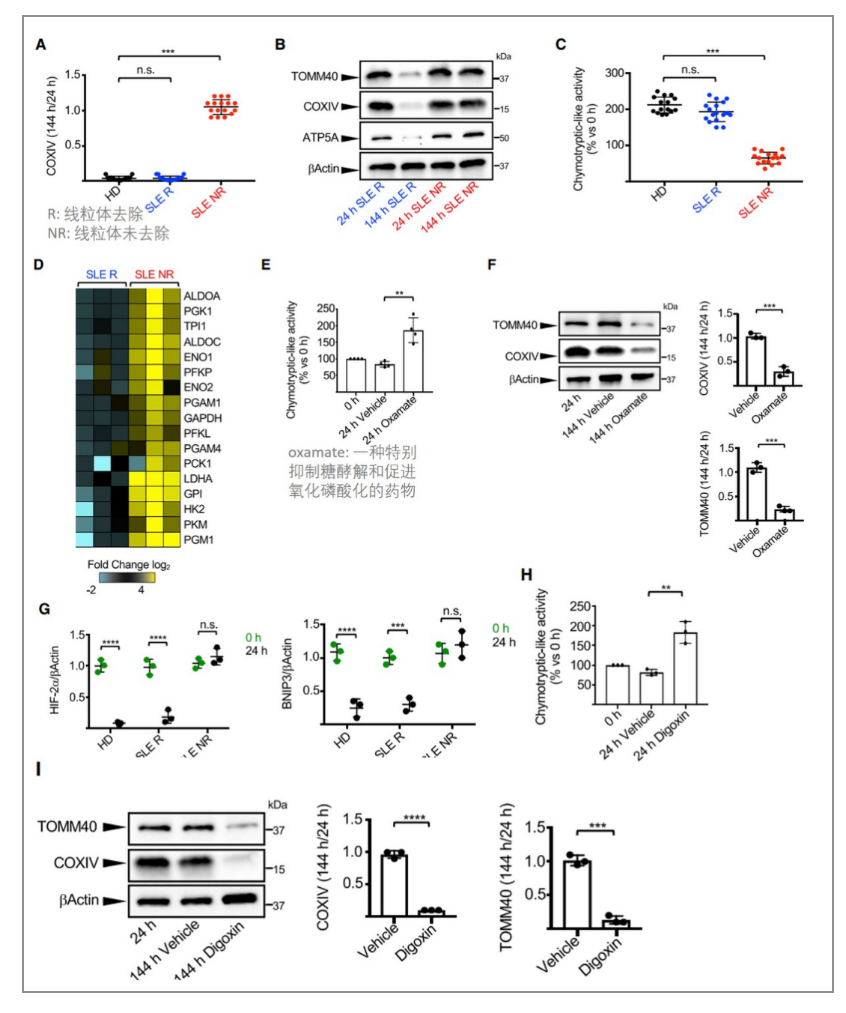
接下来,作者便检测了SLE患者中的红细胞是否也发生了这些转变的缺陷。研究发现SLE红细胞仍然存在线粒体及UPS活性较低(A-C);与线粒体去除原红细胞相比,线粒体未去除原红细胞显示分化后24小时糖酵解到OXPHOS的转换减少(D);使用糖酵解抑制剂oxamate处理,恢复了线粒体未去除原红细胞中UPS活性和线粒体去除(E, F);在HIF抑制剂地高辛的存在下,线粒体未去除原红细胞的UPS激活和线粒体去除得以恢复(H, I)。
06机制:Mito+红细胞和调理抗红细胞抗体驱动I型IFN的产生,并与SLE IFN信号相关
△点击放大图片
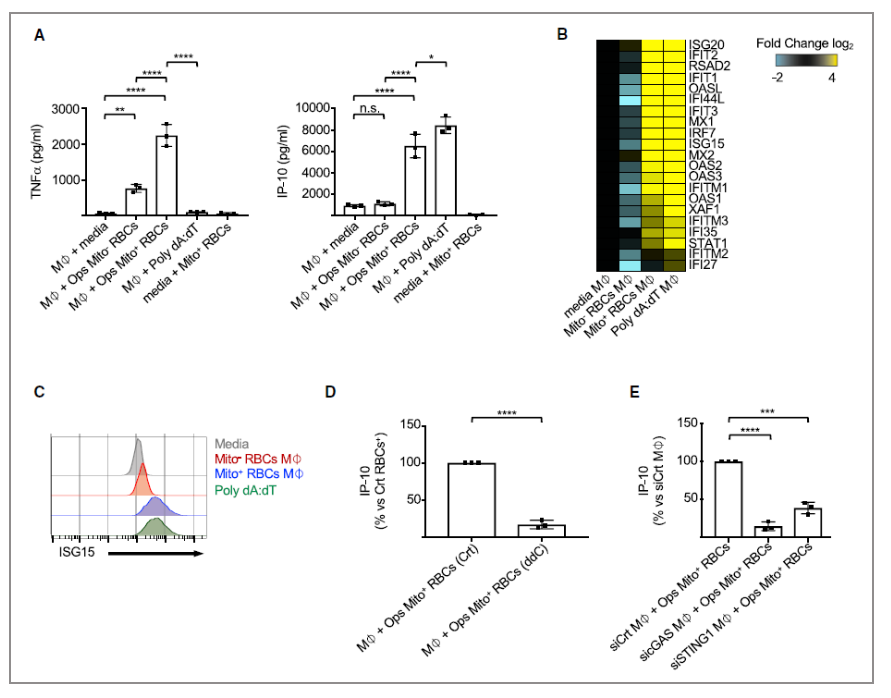
最后,对SLE患者进行检测发现,红细胞中线粒体的存在会促进TNF、IFN信号下游的趋化因子IP-10及干扰素刺激基因ISG20、ISG15等的表达(A-C);当加入ddC(可抑制线粒体DNA复制)及干扰sicGAS(cGAS为促IFN产生信号通路蛋白)后,IP-10的表达量降低。这说明,在SLE患者中红细胞内线粒体的存在可促进IFN的产生,促进SLE的发生。
部分产品推荐:
| 货号 | 产品名称 |
| 3190 | Anti-PKM1/2 antibody |
| 2867 | Anti-HK2 antibody |
| 3582 | Anti-LDHA antibody |
| 15102 | Anti-cGAS antibody |
| 13674 | Anti-STING1 antibody |
| 4302 | Anti-IRF3 antibody |
| 2178 | Anti-PGC1a antibody |
| 4844 | Anti-COX IV antibody |
| 18023 | Anti-ATP5A antibody |
| 9091 | LAMP1 (D2D11) XP® Rabbit mAb |
| 2775 | Anti-LC3B antibody |
| 4272 | Anti-Cytochrome C antibody |
| 4870 | Anti-HSP60 (D307) antibody |
| 15792 | Hypoxia Pathway Antibody Sampler Kit |
| 3769 | Anti-BNIP3 antibody |
| 18023 | Anti-ATP5A antibody |
| 5839 | Anti-SDHA antibody |
| 14769 | IFIT1 (D2X9Z) Rabbit mAb |
| sc-374405 | Anti-PSMB1 antibody |
| 13392 | Anti-PSMC5 antibody |
| 48768 | p62/KEAP1/NRF2 Pathway Antibody Sampler Kit |
| 33959 | Branched Ubiquitin Antibody Sampler Kit |
| 4967 | β-Actin Antibody |




