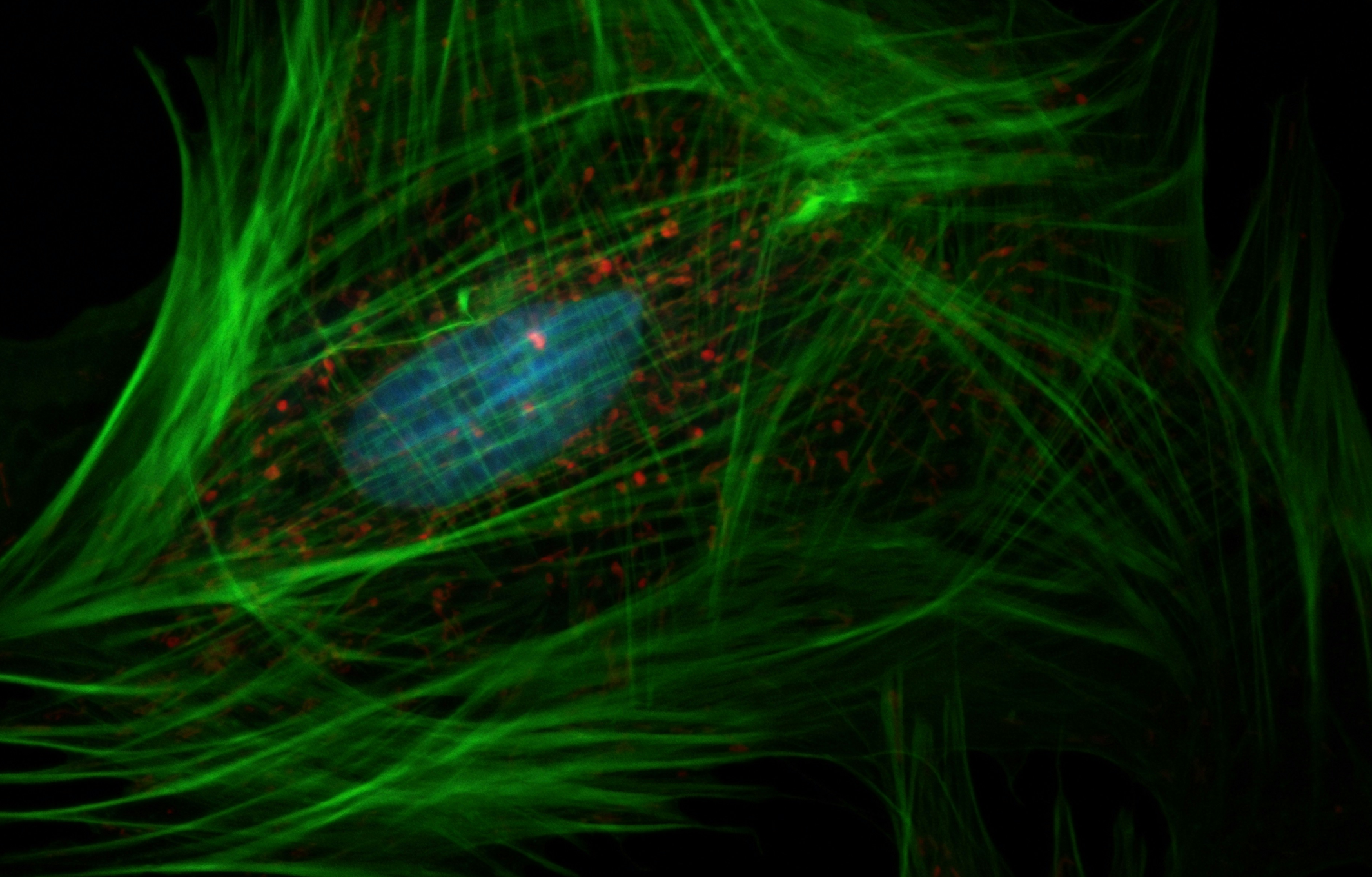
一、RA类风湿关节炎实验思路框架
△点击放大图片
二、类风湿关节炎热点方法学及文献分享
1、单细胞测序Single-cell RNA-sequencing in RA research 免疫细胞图谱
案例1:RA关节滑膜组织中的炎症细胞图谱(IF 23.53)

△点击放大图片
本研究收集了51例来自类风湿性关节炎和骨关节炎OA患者的关节置换术及超声引导活检的滑膜组织样本,然后对这些样本进行流式、scRNA-seq和RNA-seq检测,以及组织学检测。通过对各项检测数据的整合分析,精确定义了特定细胞亚群在RA和OA中的作用。
技术路线
(1) IHC病理检测

△点击放大图片
(2) 流式分析检测

△点击放大图片
① 通过流式细胞仪测量的滑膜白细胞浸润与组织学炎症评分之间存在显着的相关性。
② 在26个滑膜组织中进行的流式细胞术和组织学的结果一致。
③ OA和白细胞贫乏的RA样品的特征是成纤维细胞和内皮细胞的丰度很高。
④ f 图:使用T-SNE工具说明 富含白细胞的RA组织的特征是CD4 T、CD8 T和B细胞的丰度很高。
(3)scRNA-seq及细胞亚型确定

△点击放大图片
研究在5,265个细胞中分出18个cell clusters。
(4)滑膜组织成纤维细胞亚群的深入分析

△点击放大图片
成纤维细胞的四个亚型深入分析:
①发现SC-F1和SC-F2的marker基因主要富集在白细胞富集的RA中,且以SC-F2基因的富集最显著(图a-b)
②对SC-F2基因进行GO分析,这些基因主要参与抗原提呈MHCII型通路和干扰素介导的信号通路(图c)。
③结合质谱流式分析,发现这类细胞处于活跃的细胞因子产生状态(h)。
(5)滑膜组织单核细胞的异质性分析

△点击放大图片
四个不同的单核细胞亚群:
①通过对四种亚型的marker基因分析,发现SC-M1亚型的marker基因主要在白细胞富集的RA中上调。
②这些亚型中高丰度的IL1B+单核细胞和IFN激活的单细胞,和低丰度的NUPR1+单核细胞,表明细胞因子激活驱动活动性RA滑膜中独特单核细胞群的扩增。
③结合GSEA分析,发现IL1B+单核细胞(SC-M1)脂多糖反应相关基因的表达水平相对较高。
单细胞分析揭示炎症途径

△点击放大图片
为了确定白细胞富集RA中的炎症途径,文章分析了在白细胞富集的RA中上调的基因,找到这些基因富集的炎性通路。
发现富含白细胞的RA样本的成纤维细胞和单核细胞中显著高表达炎症反应基因(PTGS2,PTGER3和ICAM1),干扰素应答基因(IFIT2,RSAD2,STAT1和XAF1),以及趋化因子或细胞因子基因(CCL2和CXCL9),与干扰素激活的协同趋化反应一致。
2、细胞因子检测Cytokine detection in RA research

△点击放大图片
RA相关炎症因子定量检测-CBA

△点击放大图片
3、免疫细胞平衡检测Immune cell detection in RA research
RA免疫力变化综述

△点击放大图片
类风湿性关节炎滑膜炎的细胞组成包括:
1. 先天免疫细胞(单核细胞、树突状细胞、肥大细胞和先天淋巴细胞)
2. 适应性免疫细胞(Th1和Th17细胞、B细胞、浆母细胞和浆细胞)
案例:类风湿性关节炎中外周T辅助细胞亚群与B细胞

△点击放大图片
►样本:RA患者
►类型:Synovial & blood
►方法学:常规流式+质谱流式
►细胞亚群:T细胞、B细胞
检测RA滑膜组织和滑膜液中PD-1hiCD4+T细胞:
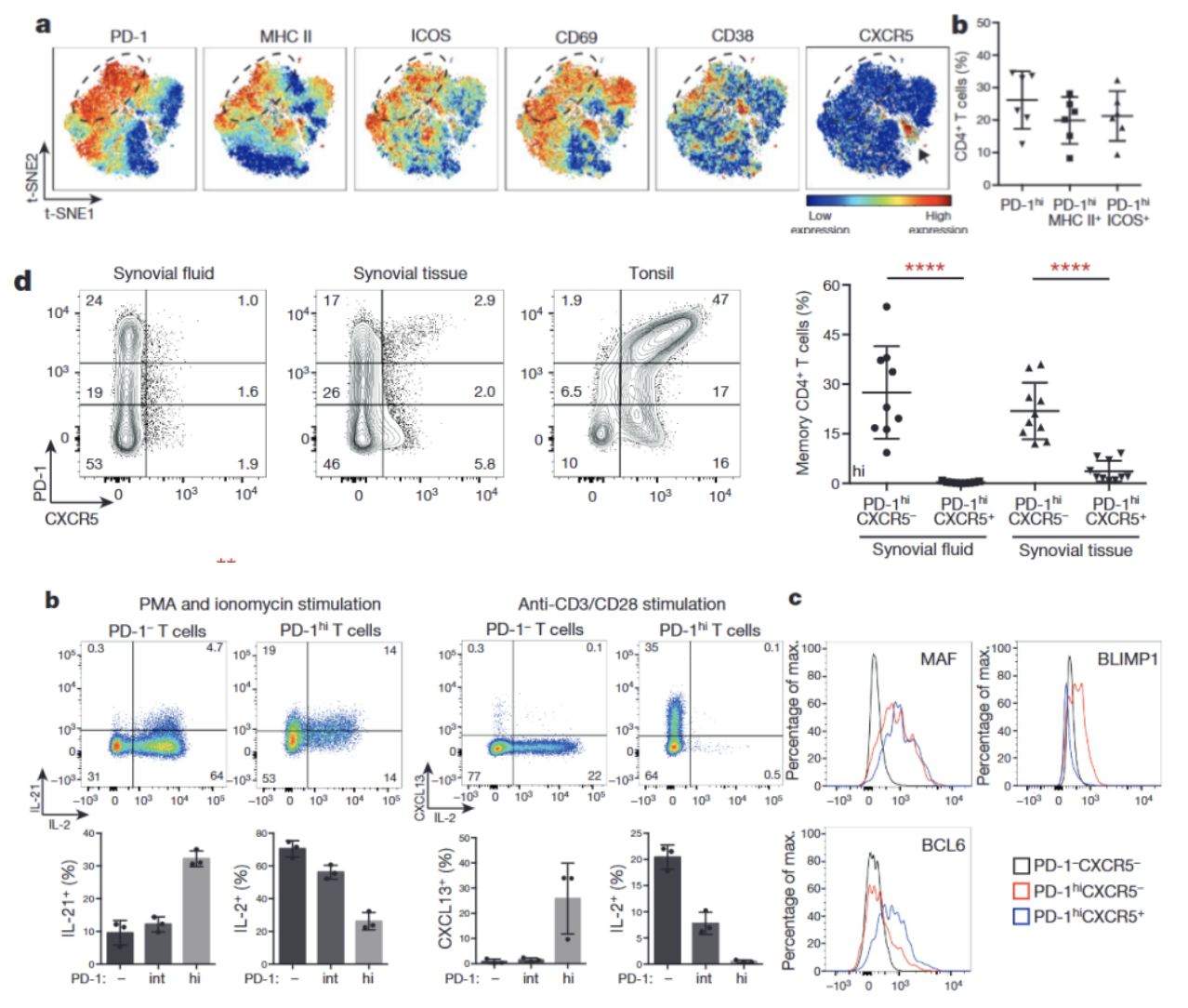
△点击放大图片
(1) 血清阳性RA患者关节和血液中PD-1hiCXCR5-CD4+T细胞显著增加,定义为TPH细胞;
(2) 滑膜PD-1hiCXCR5-CD4+TFH细胞表达B细胞辅助相关因子;
(3) TFH细胞通过分泌IL-21和SLAMF5相互作用诱导浆细胞分化。
4、机制研究Signal pathway in RA research 信号通路
RA引起的胞内信号通路改变

△点击放大图片
案例:早期RA淋巴细胞的多参数磷酸化流式分析
RA的早期通常有非特异性症状,延误了诊断和治疗,因此作者检测了RA早期外周血单核细胞(PBMC)的细胞活化,以开发一种新的诊断RA的方法。
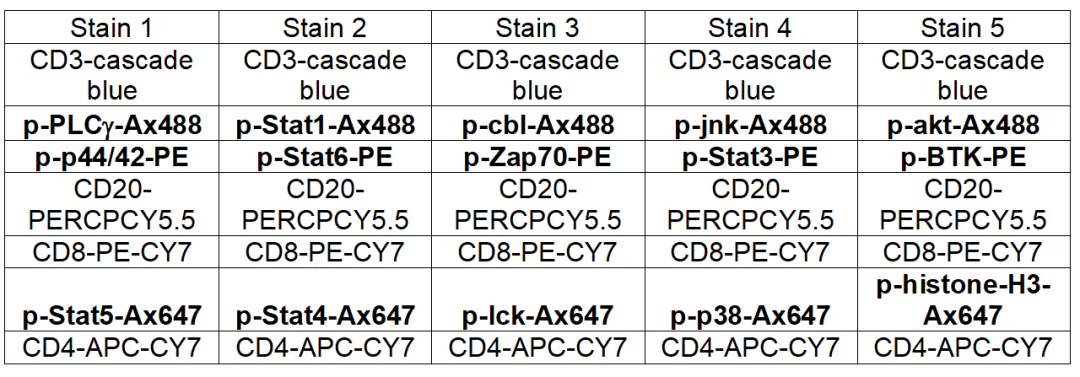
△点击放大图片
►样本:ERA、RA、OA、healthy
►方法学:流式磷酸化
►细胞亚群:T/B细胞磷酸化
RA引起的胞内信号通路改变——流式磷酸化 Phosflow
5:空间多组学
案例:DSP空间多组学技术助力类风湿关节炎治疗响应差异的分子机制解析

△点击放大图片
研究人员利用GeoMx® DSP空间转录组技术精细解析了类风湿关节炎(Rheumatoid Arthritis,RA),尤其是难治性类风湿关节炎(Refractory RA)患者滑膜样本中不同区域的基因表达谱差异。揭示了不同组织空间区域的表达特征与RA发病机制以及治疗响应的密切关系。空间多组学信息为RA个体化治疗方案的选择提供了重要的参考信息。
对利妥昔单抗和托珠单抗有反应和无反应的分子特征:

△点击放大图片
Morphology Marker选择:
CD68-AF532:Lining and superficial sublining,
CD20-DL594:Deep sublining
CD3-AF647:Lymphoid aggregates.
Syto13:DNA
研究人员通过对滑膜活检样本的DSP空间全转录组分析,解析了与疾病发病机制和治疗响应相关的组织空间区域的特异性基因表达特征。

△点击放大图片
a,显示DSP方法的方案,包括ROI的选择:CD68+ lining and superficial sublining, CD20– CD3–
deep sublining and CD3+CD20+ lymphoid aggregates。
b,MA图显示x轴上的平均表达量,y轴上的折叠变化,这是对所有ROI中有反应者和难治性患者的比较。应答者中显著上调的基因为蓝色,难治性基因中上调的基因为灰色。
c,在难治性或应答者(中个体基因差异表达的例子。散点图显示单个roi,显示中位数、第一和第三个四分位数的箱线图。12例患者(4例利妥昔单抗反应者,4例托齐单抗反应者,4例难治者)。
d,在难治性或应答者中个体基因差异表达的例子。
GeoMx Digital Spatial Profiler(DSP)
DSP是NanoString Technologies推出的新一代空间多靶标分析系统,结合了组织影像分析和测序定量技术,实现人和小鼠组织切片上18,000多种编码基因和140多种蛋白的定量分析。

△点击放大图片
Reference:
1. Rheumatoid arthritis[J/OL]. Lancet (London, England), 388(10055): 2023-2038[2023-08-17]. https://doi.org/10.1016/S01406736(16)30173-8.
2.DOI: 10.3389/fimmu.2021.686155
3. DOI: 10.1038/s41590-019-0378-1
4.Kondo N, Kuroda T, Kobayashi D. Cytokine Networks in the Pathogenesis of Rheumatoid Arthritis. Int J Mol Sci. 2021;22(20):10922. doi:10.3390/ijms222010922
5.Rheumatoid arthritis[J/OL]. Lancet (London, England), 388(10055): 2023-2038[2023-08-17]. https://doi.org/10.1016/S0140-6736(16)30173-8.
6.DOI: 10.1038/nature20810
7.Wei C, Jenks S, Sanz I. Polychromatic flow cytometry in evaluating rheumatic disease patients. Arthritis Res Ther. 2015;17(1):46. doi:10.1186/s13075-015-0561-1
8. Rheumatoid arthritis[J/OL]. Lancet (London, England), 388(10055): 2023-2038[2023-08-17]. https://doi.org/10.1016/S0140-6736(16)30173-8.
9.DOI: 10.1371/journal.pone.0006703
10.Rituximab versus tocilizumab in rheumatoid arthritis: synovial biopsy-based biomarker analysis of the phase 4 R4RA randomized trial.