听说今年学校毕业论文查重更严了!
天天熬夜改文章!
但是,研究方向就这么多问题,实验用的仪器就这些,实验方法就这几种,结论都差不多!化学试剂都标红,我不写乙醇我写二锅头吗?
大家深呼吸,不要慌,小编接下来给大家分析一篇由哈佛医学院、中国西安交通大学第一附属医院以及日本东京医科齿科大学等研究机构联合完成的,来自Nature cell bilogy的 题为 “Acetylation-dependentregulation of PD-L1 nuclear translocation dictates the efficacy of anti-PD-1 immunotherapy ”,关于PD-L1的乙酰化用来抗PD-1免疫治疗的高分文章[1]。这篇文章用新颖的构思设计实验,希望能扩宽大家的写作思路,说不定能扩宽大家的写作思路。

△点击放大图片
程序性细胞死亡蛋白1(PD-1)及其配体PD-L1以及细胞毒性T淋巴细胞相关蛋白的免疫治疗对多种癌症显示出了显著的临床治疗效果。然而免疫检查点通路的机制还不清楚。
在这里,科学家们报告了PD-L1在Lys263处被p300乙酰化,HDAC2对PD-L1的去乙酰化通过与参与内吞和核转运的多个蛋白相互作用来触发核易位。此外,核PD-L1与DNA结合,并调节多种免疫应答相关基因的表达,来调节抗肿瘤的免疫反应。研究结果表明,对乙酰化依赖性调控的PD-L1核定位,可以通过靶向PD-L1易位来提高PD-1/PD-L1阻断疗法的效果。
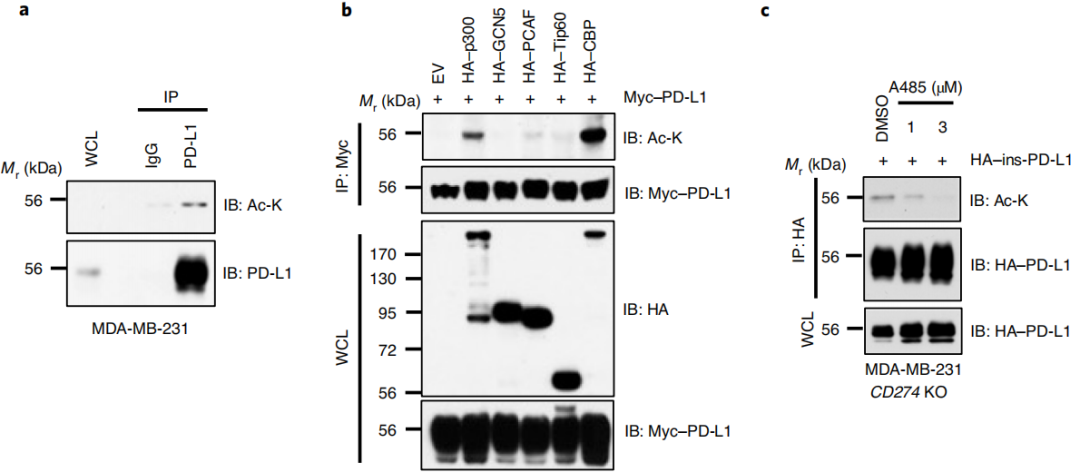
PD-L1在Lys263处被p300酶乙酰化
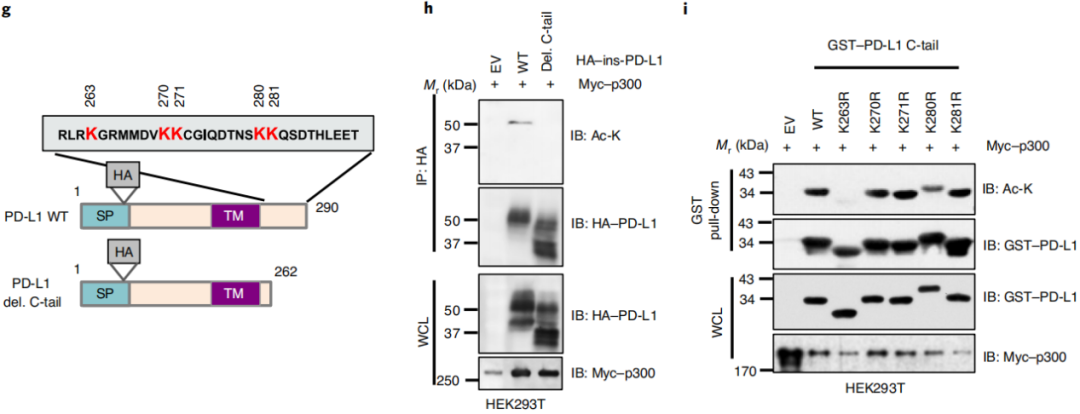
图1a-f这几组实验表明p300是PD-L1的乙酰转移酶。图1g-i这几组数据表明PD-L1上的乙酰化位点位于胞质尾端 (C-tail)上的Lys263。
△点击放大图片
△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| 6387/25 | 485 |
| sc-45924-V | GFP shRNA(A. vic) Lentivira1 Partic1es |
| abs9161 | 谱型蛋白酶抑制剂混合物(100×储液) |
| abs9162 | 谱型磷酒酸嗨抑制剂混合物(100×储液) |
| 9441S | Acety1ated-Lysine Antibody |
| 13684s | PD-L1 (E1L3NR)XPRRabbit mAb |
| 2625S | GST (91G1)Rabbit mAb |
| 2278s | Myc-Tag (71D10)Rabbit mAb |
| 2276s | Myc-Tag (9B11) Mouse mAb |
| 2367s | HA-Tag (6E2) Mouse mAb |
| abs137960-50ug | Mouse anti-GFP Tag Monoc1ona1 Antibody |
| 312-035-044 | Peroxidase-AffiniPure Rabbit Anti-Rat IgG +IgM(H+L) |
| 111-035-045 | Peroxidase-AffiniPure Goat Anti-Rabbit IgG(H+L)(min X Hu Sr Prot) |
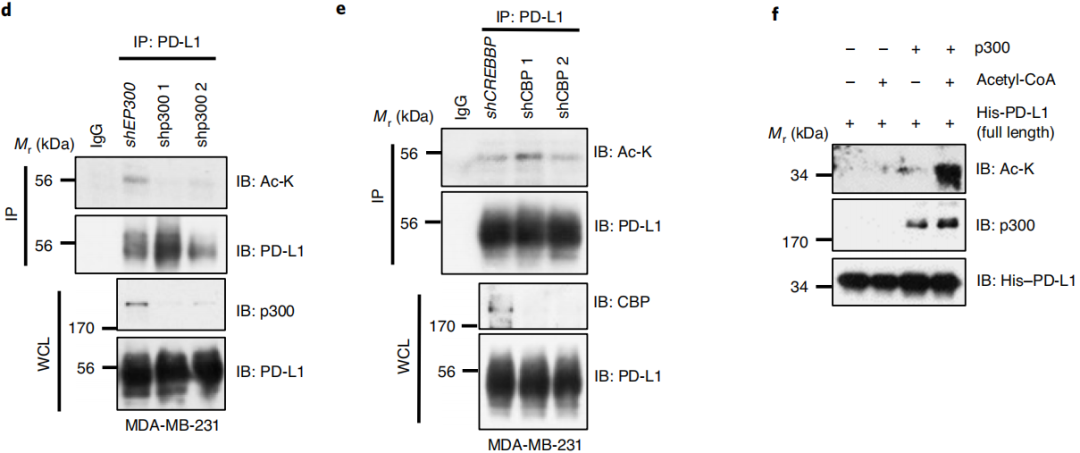
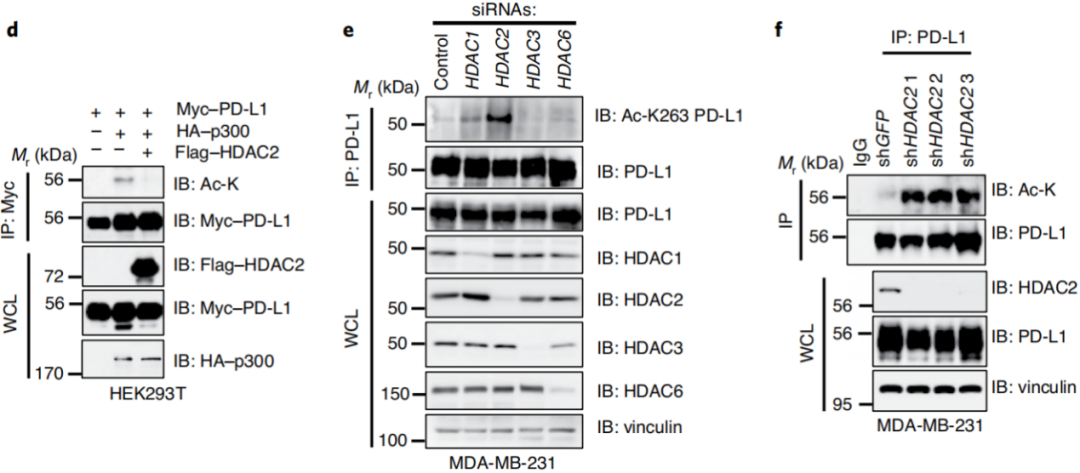
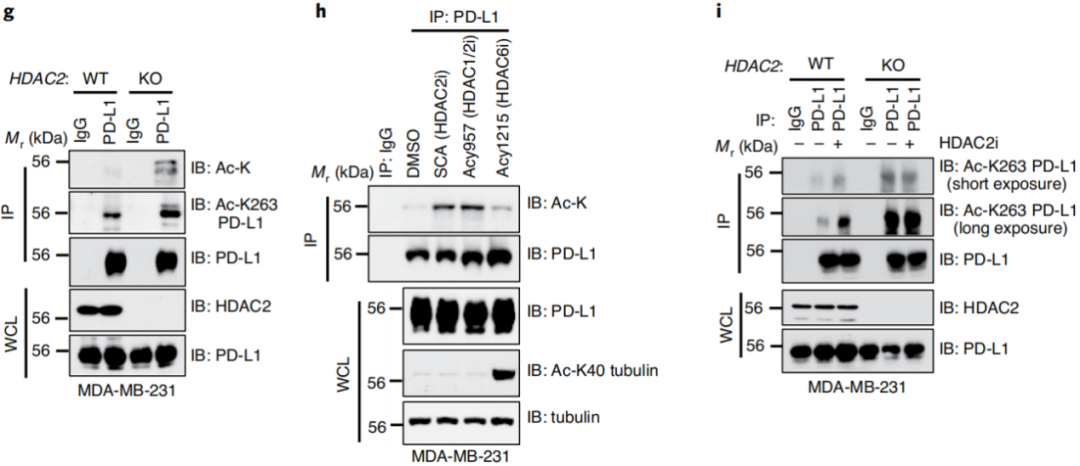
HDAC2酶对PD-L1进行去乙酰化的。乙酰转移酶和去乙酰转移酶都可以对细胞进行调控[2],p300是PD-L1的乙酰转移酶,那么PD-L1的去乙酰化转移酶呢?
通过层层严谨的实验方法图2a-i,发现 PD-L1主要由HDAC2酶进行去乙酰化的。

△点击放大图片
△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| abs817874-5mg | MG-132 |
| abs820198-5mg | Tunicamycin |
| 14126-1g | Cyc1oheximide |
| 69552S | Santacruzamate A (CAY10683) |
| abs47044887-1mg | HDAC6 Irhibitor |
| L-003493-00-0005 | ON-TARGETp1us Human HDAC1 siRNA -SMARTpoo1 |
| L-003495-02-0005 | ON-TARGETp1us HumanHDAC2 siRNA-SMARTpoo1 |
| L-003496-00-0005 | ON-TARGETp1us Human HDAC3 siRNA- SMARTpoo1 |
| M-003499-0o-0005 | siGENOME Human HDAC6 (10013) siRNA- SMARTpoo1 |
| ATNO2 | Anti-tubulin po1yAb pan specific (sheep) |
| abs137958-5Oug | F1ag-Tag Mouse Monoc1onal Antibody |
| yta-2 | Myc-Trap,coup1ed to agarose,sample |
| 3956S | HA-Tag (C29F4) Rabbit mAb(SepharoseBead Conjugate)#3956 |
PD-L1的核易位通过Lys263的乙酰化来调节
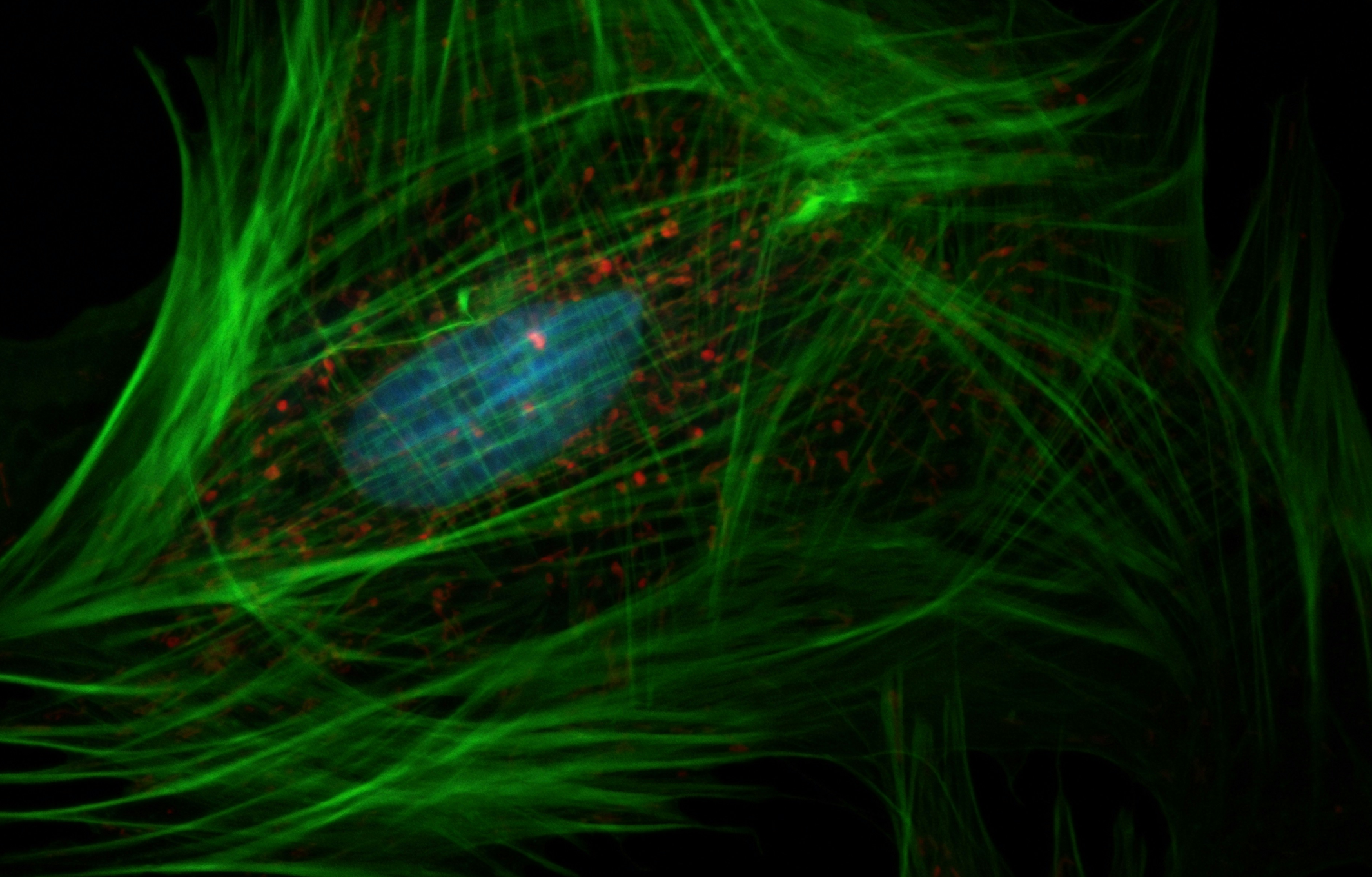
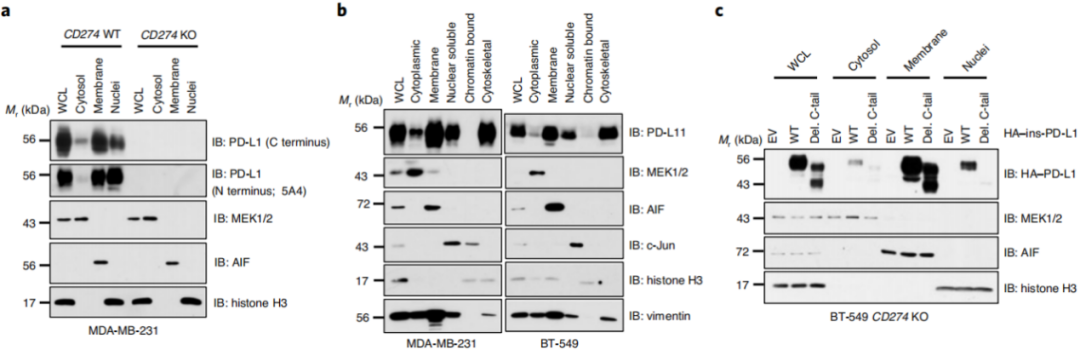
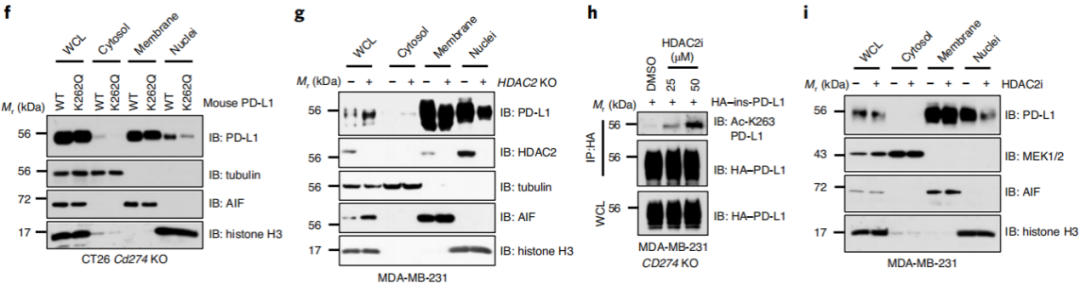
进一步,除了PD-L1在细胞膜上的定位,图3a-b科学家们发现人类和小鼠癌细胞的细胞核和细胞骨架中也检测到PD-L1。
研究者发现,C-tail端的存在(图3c-d)和HDAC2药理学抑制(图3e-f)都减少了PD-L1在细胞核的分布,这表明PD-L1上Lys263的乙酰化可能阻止了它向细胞核的易位。
有趣的是,科学家们发现癌细胞的肺转移瘤与它的皮下原发性肿瘤具有更多的PD-L1核表达图3j-k,但是PD-L1主要在膜上表达。这表明核PD-L1的蓄积可能会促进肿瘤细胞在转移过程中逃避免疫监测。
△点击放大图片

△点击放大图片
△点击放大图片

△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| 57156S | HDAC2 (D6S5P)Rabbit mAb |
| 5318S | AIF(D39D2)XP Rabbit mAb |
| 4499s | Histone H3 (D1H2)XPRabbit mAb |
| 8727S | MEK1/2 (D1A5)Rabbit mAb |
| 9165S | c-Jun (60A8)Rabbit mAb |
| 57156S | HDAC2 (D6S5P) Rabbit mAb |
| abs957 | 即用型高效免疫组化二抗试剂盒 |
| abs9214 | 苏不素染液 |
| ADI-950-114-0100 | POLYVIEW(mouse on mouse-HRP) IHC kit |
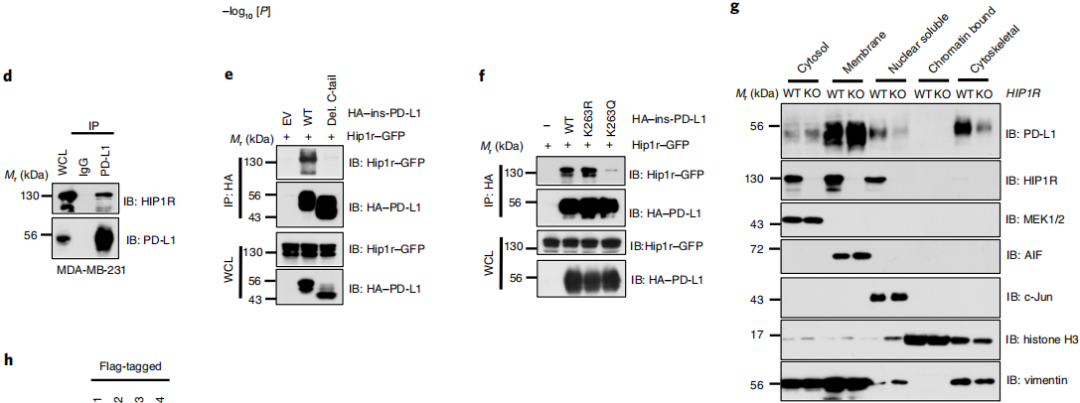
PD-L1与HIP1R的相互作用参与网格蛋白依赖的内吞作用
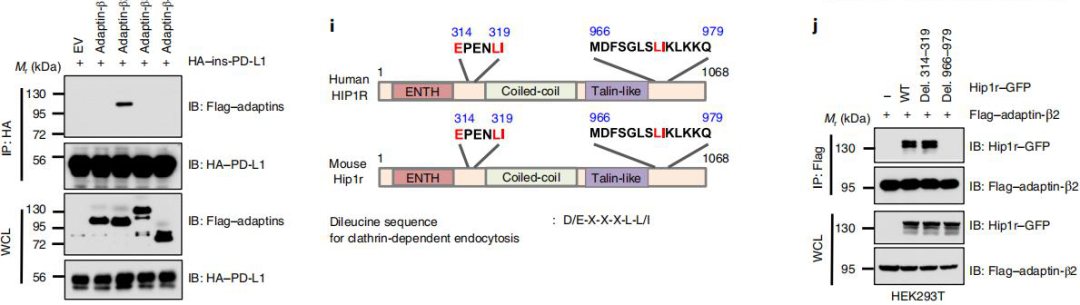
作者研究了PD-L1如何从质膜转移到细胞核的分子机制,通过MS分析研究了PD-L1核运输的分子机制,发现网格蛋白,介导内吞作用的货物蛋白,亨廷顿相互作用蛋白1相关蛋白(HIP1R)都与PD-L1的核定位有关(图4a,b)。PD-L1通过其C-tail与HIP1R进行相互作用, Lys 263乙酰化阻止了HIP1R与PD-L1的结合。这些结果表明了HIP1R作为桥接蛋白连接未乙酰化的PD-L1,再通过货物蛋白与网格蛋白进行内吞作用。

△点击放大图片
△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| AF5626 | hHIC5/TGFB111 Aff Pu (100 ug) |
| 70440-5mg | Fi1ipin III |
| 23885-5mg | Pitstop2 |
| abs100940-50u1 | Rabbit anti-HIP1R(N-termPo1yclonal Antibody |
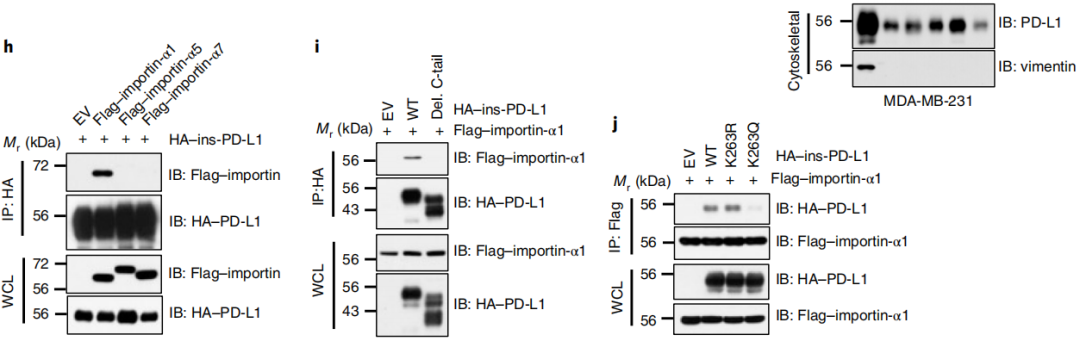
波形蛋白和importin-α1蛋白的相互作用促进了PD-L1的核易位
△点击放大图片
△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| 2721-250 | ivermectin |
| 5741S | Vimentin (D21H3)XP Rabbit mAb |
| 3195S | E-Cadherin (24E10)Rabbit mAb |
| 4543S | Keratin 17 (D73C7)Rabbit mAb |
| abs106182-50u1 | Rabbit anti-KRT19 (C-term) Polyc1onal Antibody |
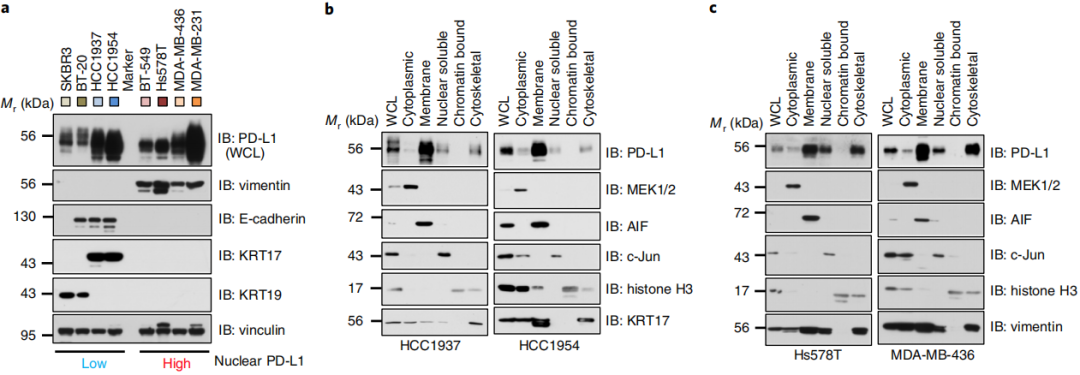
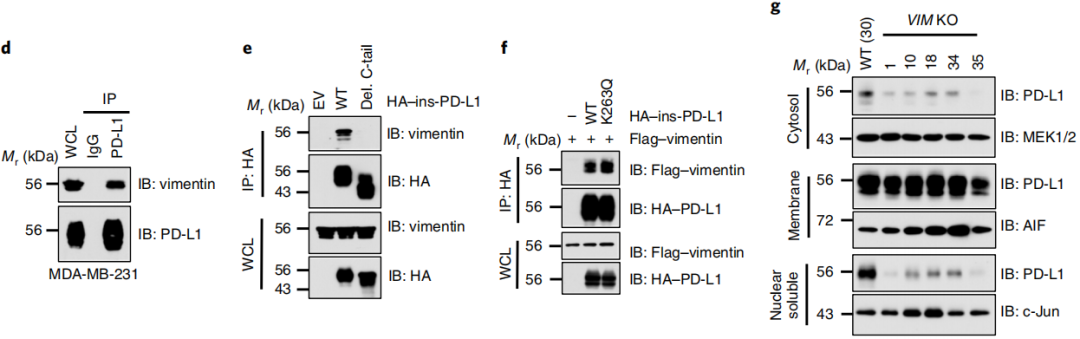
MS分析表明了PD-L1与几种细胞骨架蛋白的相互作用,包括波形蛋白和角蛋白,我们进一步推测PD-L1与细胞骨架结合可能对它的核易位很重要。实验发现PD-L1通过PD-L1的C-tail与波形蛋白相互作用。同时波形蛋白的低表达降低了细胞骨架和核溶性部分PD-L1的表达(图5a-c)。这表明PD-L1的核易位可能依赖于细胞骨架。
MS分析也表明各种importin蛋白是PD-L1相互作用的蛋白,接下来作者寻找importin蛋白的核易位机制。从图5h-i我们还观察到,PD-L1通过C-tail与importin-α1相互作用,去乙酰化的PD-L1未能与importin-α1相互作用,这表明Lys 263去乙酰化可能对决定了importin蛋白与PD-L1的相互作用。因此,作者提出了一个猜想,质膜上HDAC2对PD-L1的去乙酰化使PD-L1能够与HIP1R和货物蛋白相互作用进行内吞,然后通过细胞骨架转运,最终通过importin-α1转运到细胞核。
核PD-L1调节基因表达

△点击放大图片
△点击放大图片
△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| 74104 | RNeasy mini kit(50) |
| abs60038-100T | SYBR One-Step qRT-PCR Kit |
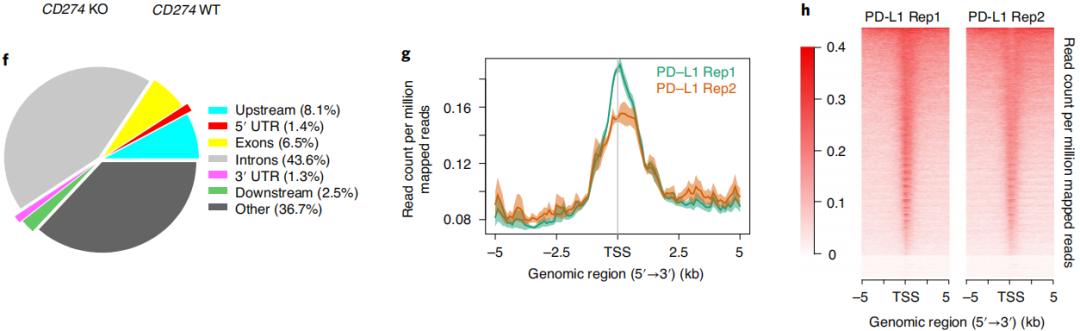
之前的研究我们发现PD-L1从质膜转移到细胞核的分子和相互作用蛋白机制,接下来作者需要寻找核PD-L1在基因层面上是如何调控免疫应答及其调控路径。C-tail和HDAC缺失都抑制了PD-L1与DNA的结合,这表明PD-L1可能通过与DNA结合来调节基因的转录。
通过图6a-c RNA测序和逆转录定量PCR分析,PD-L1的消耗降低了癌细胞免疫应答相关基因的表达(图6d-e),这些基因涉及I型干扰素(IFN)信号通路、IFNγ介导信号、NF-κB信号和MHCI类分子。而重新引入PD-L1可以部分挽救下调的IFNγ和NF-κB信号基因的表达。表明在癌细胞中,Lys263乙酰化抑制PD-L1核定位来影响基因转录。
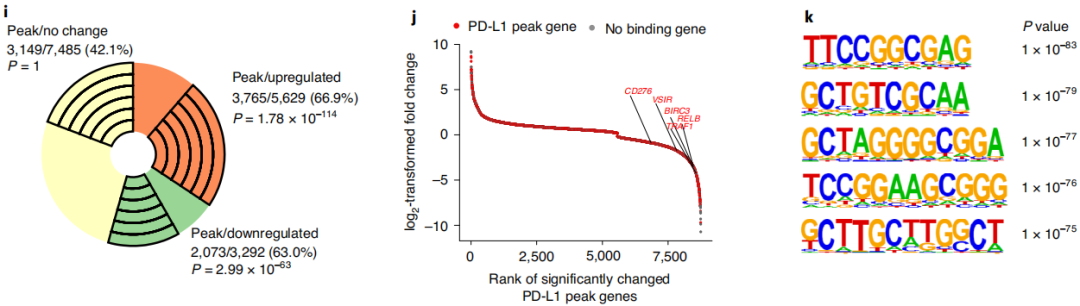
通过图6f-j超高通量DNA测序分析,在癌细胞中观察到PD-L1峰值基因和差异表达基因之间的重叠超过60%。NF-κB信号相关基因具有PD-L1结合峰。这一结果表明,核PD-L1可能会特异性触发参与免疫反应通路的基因表达来影响抗肿瘤免疫反应。进一步将PD-L1特异性结合基序和各种转录因子的典型DNA结合序列进行比较,从图6k科学家发现它与一些参与免疫反应相关的转录因子呈正相关。表明PD-L1可能与DNA上的转录因子相互作用,来影响参与抗肿瘤免疫的转录。因此,这些研究结果表明:首先,质膜上高度表达的PD-L1与T细胞上的PD-1结合以抑制T细胞的激活;第二,细胞核中的PD-L1增强了多种免疫反应通路的激活,建立了PD-L1表达增加的正反馈回路,以促进免疫监测的逃避。同时核PD-L1可能会增加肿瘤微环境的炎症反应,促进新抗原递呈。
阻止PD-L1核易位,增强了PD-1阻断疗法

△点击放大图片

△点击放大图片
△点击放大图片
相关部分产品
| 货号 | 产品名称 |
| L-015836-01-0005 | ON-TARGETp1us Human CD274 siRNA- SMARTpoo1 |
| TLP5912 | Trans-Lentiviral shRNA Packaging System |
| -2002 | DharmaFECT 1 Transfection Reagent |
| 82723T | PD-L2 (D7U8CT)XPRabbit mAb |
| 64953s | VISTA (D1L2G)XP Rabbit mAb |
| 14058s | B7-H3 (D9M2L)XP Rabbit mAb |
| 14572S | B7-H4 (D1M8I)XP Rabbit mAb |
| 54330s | Ga1ectin-9 (D9R4A)XPRabbit mAb |
| BEO300-5MG | InVivolAb anti-mouse CD45.2 |
| BEO261-5MG | InVivolab anti-mouse CD3 E |
| BEO061-1MG | InVivoMab anti-mouse CDga |
| BEO049-5MG | InVivoMab anti-mouse IL-10 |
| BEO043-5MG | InVivoMab anti-mouse IL-2 |
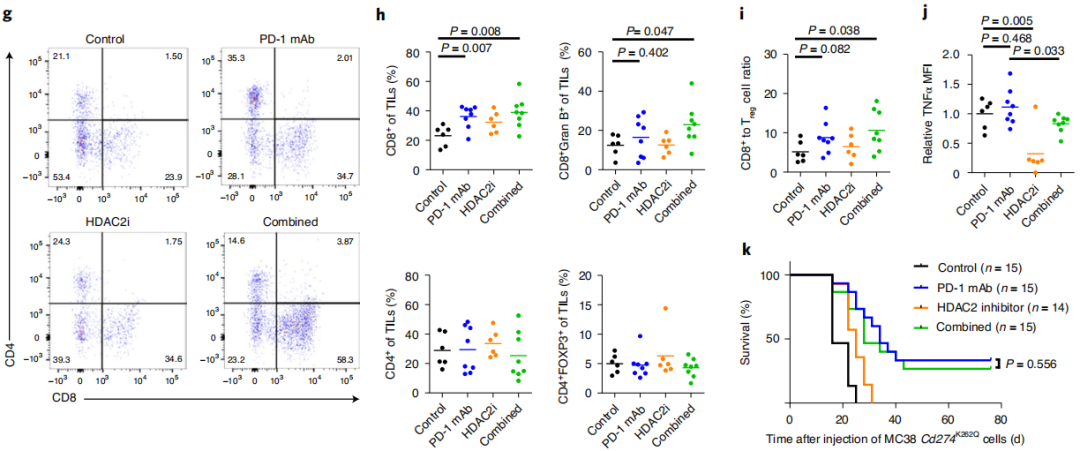
由于PD-L2、vista和B7-H3这些免疫检查点基因也参与了免疫监测的逃避,表明核PD-L1可能会上调肿瘤细胞中的这些免疫检查点基因,促进肿瘤的免疫逃逸。基于以上发现HDAC2触发PD-L1的核易位以改变基因转录,科学家假设HDAC2的药理学抑制将减少核PD-L1,同时可能参与PD-1/PD-L1阻断疗法治疗癌症。因此,作者使用抗PD-1抗体,HDAC2抑制剂治疗小鼠肿瘤模型。上图7e,f,与抗PD-1治疗组相比,HDAC2抑制剂和抗PD-1抗体的联合治疗显著减缓了肿瘤的生长,提高了生存率。而作者评估了肿瘤中的肿瘤浸润性淋巴细胞(TILs),从图7g-j发现用HDAC2抑制剂组的肿瘤中CD8+的细胞毒性 T细胞浸润增加,TNFα水平降低,这是由于用HDAC2抑制剂阻断PD-L1的核易位,降低这些免疫检查点基因的转录,从而增强由PD-1抗体触发的抗肿瘤免疫反应。
总结:科学家证明了PD-L1的一部分从质膜转位到细胞核以调节促炎症和免疫反应相关基因的表达,这表明PD-L1的转录调控可能促进局部肿瘤微环境中的免疫炎症,促进肿瘤对PD-1/PD-L1阻断疗法的逃逸。
同时,核PD-L1也触发了其他免疫检查点分子的表达,这些分子不受PD-1/PD-L1阻断,导致免疫治疗耐药性。用HDAC2抑制剂阻断PD-L1的核易位可能会降低这些免疫检查点基因的转录,反过来增强对PD-1的治疗性抗体引发的抗肿瘤免疫反应。该研究将HDAC2抑制与PD-1/PD-L1阻断疗法相结合,针对癌症的免疫治疗提供了一种分子机制和基本原理。
文章已经阅读完了,大家有没有觉得很神奇。文章创新性的探索了依赖于乙酰化的PD-L1核定位调节机制。大家一定想知道被翻译后修饰的蛋白还能不能发现其他新的机制。
哺乳动物的蛋白质组包含了数百万种独特的蛋白质形式。约25,000个基因的基因组,将潜在的蛋白种类增加到100000的转录组,以及丰富的蛋白质翻译后修饰(PTM),这些共同决定了蛋白的多样性和复杂性。尤其是PTM, 几乎所有蛋白质都会被多个PTM修饰,因此相对于转录组和基因组,经过翻译后修饰的蛋白质都呈指数倍的增加了蛋白质组的复杂性,同时也赋予了蛋白质功能多样性的无限潜力。
蛋白修饰常见的形式有乙酰化,甲基化,磷酸化,泛素化,SUMO化等,翻译后修饰大大增加了蛋白质组的复杂性,从而影响许多蛋白质的功能,包括酶活性、稳定性、DNA结合、蛋白质-蛋白的相互作用和肽-受体识别等[3]。CST提供的PTMscan技术可以通过自主开发且经过验证的PTM抗体和基序特异性来富集含PTM的肽段。使用PTMScan技术可识别并量化成百上千个PTM位点,然后将这些位点精选到最相关的可行性靶标上,最后通过LC-MS/MS对这些肽段进行分析。
目前,各种翻译后修饰的相关高分文章层出不穷,如小优之前写到的“两篇文章带您了解组蛋白修饰!”中提到的两篇高分文章,以及“分分钟get泛素化研究前沿”中的两篇文章。讲到这里大家一定很头疼,不用担心,CST提供各种翻译后修饰的PTMScan的试剂盒和详细的操作步骤说明书以帮助大家更好的探索翻译后修饰的新位点!同时Cytoskeleton针对新手有一系列完整全面的Signal-Seeker™试剂盒,包括泛素化,乙酰化,SUMO等试剂盒,这些产品提供特殊的亲和磁珠,可从组织物分离和富集修饰的蛋白质,并通过WB分析富集的蛋白质群。