1973年,美国Rockeller大学Steinmen和Cohn首先从小鼠脾细胞的分离中发现了表面具有很多树枝状的突起的细胞,将其命名为:树突状细胞(dendritic cell,DC)。DC细胞作为免疫前线的指挥官,是目前所知的机体内功能最强的抗原提呈细胞,一个DC细胞能够激活100-3000个T细胞,是巨噬细胞和B细胞的100-1000倍[1]。DC细胞通过处理肿瘤抗原并将其呈递给T细胞,将先天性免疫与适应性免疫联系起来,从而启动抗肿瘤免疫,因此DC细胞是机体免疫应答的始动者,在免疫应答的诱导中具有独特的地位。
接下来小优会从DC细胞来源-诱导分化与培养-鉴定-热门研究四个方面带大家通关DC细胞的培养!之前小优也给大家介绍了《免疫卫士-T细胞培养攻略》,小伙伴们按需查看呦。
PART 1
DC细胞来源
DC细胞是起源于骨髓并居住在外周和淋巴组织中的淋巴样或髓系细胞。大多数DC由共同DC祖细胞(CDP)生成,CDP在FLT3L诱导下最终生成为cDC和pDC;一部分也会来源于造血干细胞的单核细胞,在GM-CSF和IL-4的诱导下产生外周血单核细胞来源DC[2]。
所以体外培养的DC细胞来源可以是骨髓、外周血的单核细胞诱导生成;或骨髓、外周血来源的CD34+HSC骨髓多能造血干细胞诱导生成;或从血液、组织等样本中直接分离。其中,外周血中CD14+单核细胞获取较为便捷,诱导生成Mo-DC细胞是最经典的方法,不过Mo-DC无法再循环至淋巴结,并且与淋巴组织驻留树突状细胞 (LT-DC) 存在差异[3];CD34+HSC细胞不太容易获取,但可以诱导生成pDC、cDC1和cDC2;而直接从样本中分离获得的DC细胞最接近体内真实情况,不过产量一般比较低。另外一种新颖的DC细胞来源是,诱导多能干细胞iPSC/胚胎干细胞ESC也可诱导成DC细胞:iPSC分化成CD34+的造血干细胞后,通过添加GM-CSF、IL4、TNF-α、OK432的培养体系,可以分化成树突状细胞(iDC),iDC可以直接在iPSC上基因编辑导入特定抗原基因,从而大大缩短DC孵育抗原并递呈给T细胞的时间[4]。当然,也可以直接购买商品化的DC细胞(比如lonza),方便快捷,品质有保障。
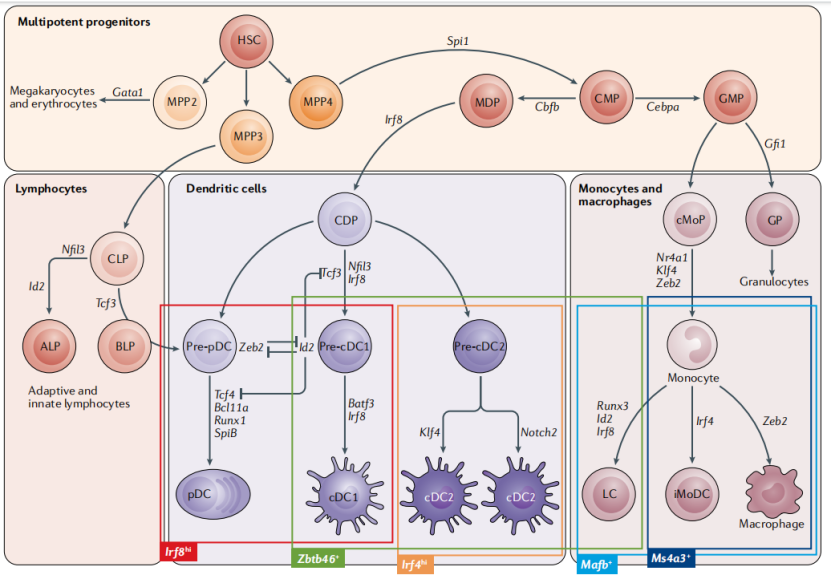
图1 小鼠树突状细胞发育图谱[2]
△点击放大图片
部分相关产品:
| 货号 | 产品名称 |
| 130-100-629 | Monocyte Isolation Kit (BM) |
| 130-046-702 | CD34 MicroBead Kit |
| 130-050-201 | CD14 MicroBeads |
| 130-096-537 | Pan Monocyte Isolation Kit |
| 130-090-879 | StraightFrom® Whole Blood CD14 MicroBeads, human |
| 130-091-379 | Blood Dendritic Cell Isolation Kit II, human |
| 130-097-240 | Diamond Plasmacytoid Dendritic Cell Isolation Kit II, human |
| 130-094-487 | Myeloid Dendritic Cell Isolation Kit, human |
| CC-2701 | NHDC - Human Dendritic Cells |
PART 2
DC诱导分化与培养
由于DC细胞的样本来源以及诱导方法也比较庞杂,在这里我们举三个例子:
01人骨髓CD34+细胞诱导生成DC[5]
①饲养层细胞OP9的培养和接种
OP9细胞在75cm2培养瓶中培养至密度为4×103-1×104细胞/cm2, OP9培养基(αMEM,20% FBS,青霉素-链霉素),37°C,5% CO2;
收获OP9细胞,将2-3 ml胰蛋白酶-EDTA溶液加入培养瓶中,37℃消化5-15分钟,在倒置显微镜下观察细胞层,直到细胞变圆开始脱落。加入 6-8 ml OP9完全培养基,终止消化,轻轻吹打细胞;
将细胞悬液转移到15 ml 离心管中,125×g离心10分钟,弃上清液,将OP9细胞沉淀重悬在新鲜预热培养基中,细胞密度为2.5 × 104个细胞/ml。
按照每孔200μl(5000个细胞)分装到96孔U底组织培养处理板中,在 37°C、5% CO2中培养。
②DC分化
吸出预接种OP9细胞的培养基,并用200 μl CD34+细胞悬浮液(3000个细胞)替换,继续培养;
第6天,每个孔中取出100 μl培养基,并用100 μl预热的DC分化培养基(αMEM, 10% FBS, 1% penicillin-streptomycin, 100ng/ml Flt3L, 20ng/ml SCF, 20mg/ml GM-CSF)替换;
在第12-21 天收获细胞,并且可在第12天和第18天半量换液。
人骨髓CD34+细胞诱导生成更多DC细胞亚型,大家可以参考图2。

图2 人骨髓CD34+细胞诱导生成更多DC细胞亚型汇总[5]
△点击放大图片
部分相关产品:
| 货号 | 产品名称 |
| abs9506-500ml | α-MEM培养基(含核苷,含脱氧核苷,含L-谷氨酰胺,含丙酮酸钠,不含HEPES) |
| SH30406.05 | New Zealand Characterized Foetal Bovine Serum |
| SV30208.02 | Australian FBS, 500ML |
| abs972-500ml | 胎牛血清(优级) |
| abs981-500ml | 胎牛血清(特级) |
| SV30010 | Penicillin-Streptomycin Solution 10,000 Units /mL Penicillin, 10,000 µg/mL Streptomycin in 0.85% NaCl |
| abs9244 | 青霉素-链霉素溶液(100×,双抗) |
| abs47048304-100mL | 胰蛋白酶-EDTA消化液(0.05%,含酚红) |
| abs47048305-100mL | 胰蛋白酶-EDTA消化液(0.05%,不含酚红) |
| 2467-FL-025 | rfeFlt-3 Ligand/FL (25 ug) |
| abs05148-10ug | Recombinant Human FLT-3L Protein |
| abs04178-1mg | Recombinant Human SCF Protein |
| 455-MC-010 | Recombinant Mouse SCF Protein |
| UA040101-1mg | GM-CSF, Human |
| 415-ML-010 | rmGM-CSF (10 ug) |
02单核细胞诱导生成MoDC[6]
①用培养基RPMI 1640(含10%FBS)调整富集的单核细胞浓度至5×106 cells/mL,铺于24孔板上,同时加入重组人IL-4(500 U/ml)和GM-CSF(500 U/ml),于37℃,5%CO2培养箱中培养;
②48h后,半量换液,同时补充重组人IL-4(500 U/ml)和GM-CSF(500 U/ml),继续刺激2天;
③第5天,可收获未成熟的树突细胞,即单核细胞来源树突状细胞(monocyte-Derived dendritic cells, MoDCs),用于下游实验(如成熟DC的激活);
④成熟DC激活:LPS(0.5 μg/ml)或 TNF-alpha(10ng/ml)、IL-6(10ng/ml)、IL-1β(10ng/ml)、PGE2(1μmol/l)刺激24-48h。
部分相关产品:
| 货号 | 产品名称 |
| SH30809.01 | RPMI 1640 Medium, with 25 mM HEPES, with L-Glutamine |
| abs9468-500ml | RPMI 1640 培养基,ATCC 改良(含L-谷氨酰胺,含丙酮酸钠,含HEPES) |
| UA040127-50μg | IL-4, Mouse |
| abs42020800-10mg | 脂多糖(O111:B4) |
| 1814-ET-025 | reTNF-a (25 ug) |
| UA040052-50μg | IL-6, Human |
| 201-LB-025 | rhIL-1b (25 ug) |
| abs819421-5mg | Prostaglandin E2 |
03IPSC/ESC诱导DC细胞[7]
①IPS细胞(或ES细胞)向造血祖细胞的分化
当IPS或ES细胞达到70-80%密度时,使用Collagenase IV在37°C、5% CO2条件下消化40-60分钟,直至细胞团边缘卷起,终止消化;
细胞团形成:将IPS或ES细胞团通过细胞筛网过滤,调整细胞团大小,形成含有50-100个细胞的细胞团;
如果IPS或ES细胞团要培养在小鼠胚胎成纤维细胞(MEF)上,接种前需去除MEF;在37°C、5%CO2和5%O2条件下培养,每天更换培养基,以形成拟胚体EB;
从第1天开始,根据分化天数准备相应的诱导培养基(d1、d2、d4、d6);
在分化的第6至14天(IPS细胞)或第21至28天(ES细胞)期间,观察到造血祖细胞从EB中出现。

图3 D2-D6 EB分化阶段培养基
△点击放大图片
②IPS细胞(或ES细胞)衍生造血祖细胞分化为DC亚群
将辐射灭活过的OP9细胞以1.2 x 104cells/cm2密度接种在涂有0.1%明胶的培养皿上;
收集造血祖细胞,并通过40μm细胞筛网过滤以去除剩余的EB;调整细胞密度1x106-1.5x106cells/ml于DC分化基础培养基中;
将细胞分为两组,一组用于生成cDC1和cDC2(使用FSG4细胞因子组合),另一组用于生成cDC1和pDC(使用FSG细胞因子组合);
在FSG4组中添加100ng/mL FLT3L、20ng/mL SCF、20ng/mL GM-CSF和20ng/mL IL-4;
在FSG组中添加100ng/mL FLT3L、20ng/mL SCF和10ng/mL GM-CSF;
将造血祖细胞悬液接种到OP9基质细胞上,进行共培养;
每两天进行一次半量换液;
在分化的第4天至第7天,将逐渐出现DC形态。
部分相关产品:
| 货号 | 产品名称 |
| LS004188 | Collagenase, Type 5 |
| abs47048003-100mg | 胶原酶 Ⅳ型 |
| 5336-VE-010 | Recombinant Human VEGF 111 Protein |
| UA040055-1mg | IGF-I Protein, Human |
| abs00995-10ug | Recombinant Mouse TPO Protein |
| 203-IL-01M | Recombinant Human IL-3 Protein |
PART 3
DC细胞亚型鉴定
DC细胞亚群可以分为浆DC、1型髓样DC、2型髓样DC等,DC细胞不同亚型、标记物、细胞因子可以参考图4。DC细胞亚型鉴定最常用的方法是流式,关于流式鉴定的基本内容大家可以参考《免疫细胞培养通关技巧之分型鉴定》。
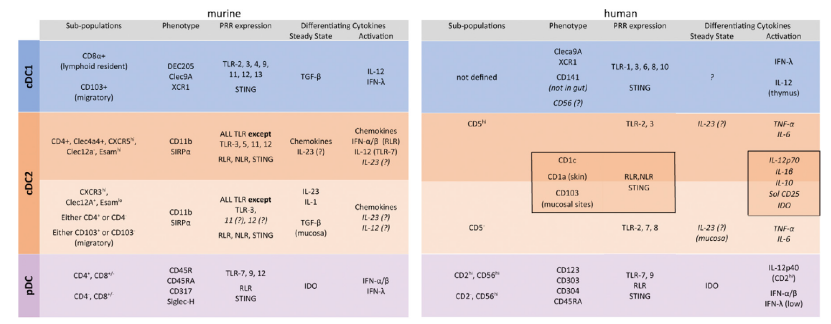
图4 小鼠和人DC亚群的表面标记物、模式识别受体(PRR)、细胞因子[8]
△点击放大图片
部分相关产品:
| 货号 | 产品名称 |
| 557495 | PE Rat Anti-Mouse CD103(M290) |
| CXCR3 | PE-Cy7 Mouse Anti-Human CD183(1C6/CXCR3) |
| 565424 | PerCP-Cy5.5 Mouse Anti-Human CD1c(F10/21A3) |
PART 4
DC细胞热门研究
DC细胞作为抗原呈递能力最强的免疫细胞,在抗肿瘤免疫中发挥着重要的作用,当DC细胞功能受损时,肿瘤细胞很有可能利用这一方面产生免疫逃逸,并且,肿瘤微环境也会释放很多抑制因子,进而阻止DC祖细胞的正常分化,从而抑制T细胞的抗肿瘤反应[9]。
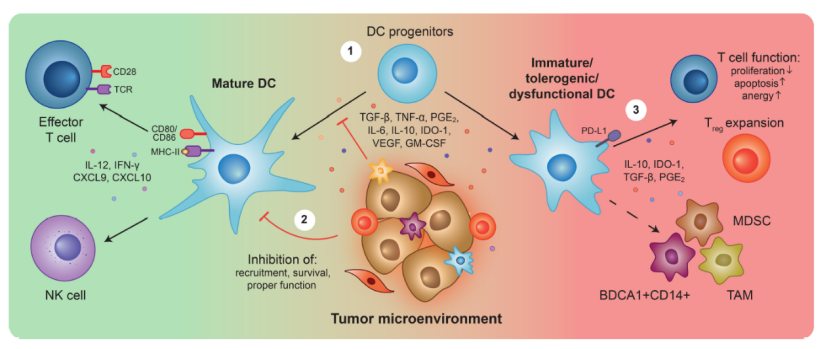
图5 DC细胞与肿瘤微环境[9]
△点击放大图片
DC细胞的热门研究很多:肿瘤浸润DC细胞、髓系抑制细胞、DC疫苗、DC-CIK细胞疗法、DC-T细胞疗法等,在这里,小优以流式分析小鼠结肠癌肿瘤浸润DC亚型为例(图6)[10]:CD11c+MHCII+双阳性髓系细胞→CD317+(pDC) → CD64+F4/80-(moDC) → CD103+CD11b−(cDC1)、 CD103-CD11b+(cDC2)。除了流式细胞术,想要研究肿瘤浸润DC细胞的利器还有很多:质谱流式、单细胞测序等等(图7)。
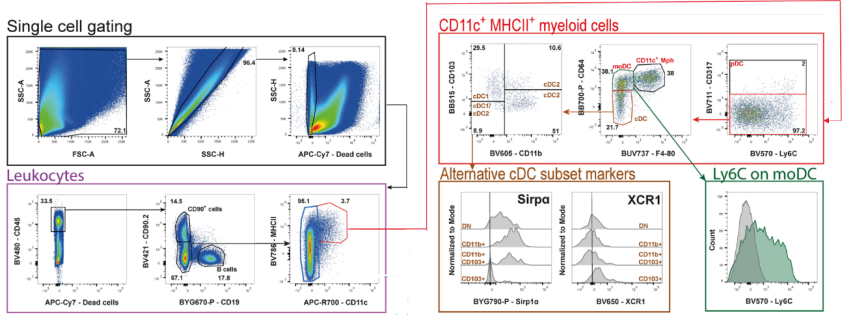
图6 DC流式分析小鼠结肠癌肿瘤浸润DC亚型圈门逻辑[10]
△点击放大图片
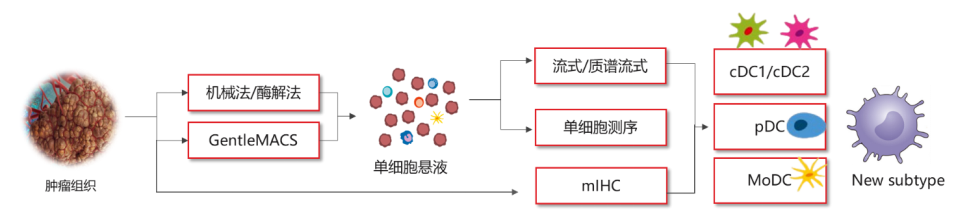
图7 肿瘤浸润DC细胞研究思路汇总
△点击放大图片
部分相关产品:
| 货号 | 产品名称 |
| MAB1777 | Human CD11c Antibody |
| 130-102-293 | CD317 (PDCA-1) Antibody, anti-mouse, PE |
| 90694S | CD64/FcgammaRI (E2O4L) Rabbit mAb |
| S0B2073-100μl | CD11b Recombinant Rabbit mAb (SDT-058-44) |
| abs50015-20T | 七色多重荧光免疫组化染色试剂盒(鼠兔通用二抗) |
| BK意向单号 | 六标七色多重荧光组化服务 |
以上内容来自细胞大师训练营第二站-DC细胞,想要了解更多内容,可以添加文末小助手获得完整课程。第三站-B细胞将于9月份开启,也会涵盖B细胞的基本介绍、样本制备及分选方案;大家最关心的B细胞激活、分化与扩增、功能鉴定与质量控制;热门的研究方向:BCR、Breg;多色流式在Breg中的应用等等,大家敬请期待~
参考文献:
1. Hart, D.N.J., Dendritic Cells: Unique Leukocyte Populations Which Control the Primary Immune Response. Blood, 1997. 90(9): p. 3245-3287.
2. Anderson, D.A., et al., Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology, 2020. 21(2): p. 101-115.
3. Balan, S., et al., Large-Scale Human Dendritic Cell Differentiation Revealing Notch-Dependent Lineage Bifurcation and Heterogeneity. Cell Reports, 2018. 24(7): p. 1902-1915.e6.
4. Xue, D., et al., Induced pluripotent stem cell-derived engineered T cells, natural killer cells, macrophages, and dendritic cells in immunotherapy. Trends in Biotechnology, 2023. 41(7): p. 907-922.
5. Lutz, M.B., et al., Guidelines for mouse and human DC generation. European Journal of Immunology, 2022. 53(11).
6. Ulrich, H., et al., A protocol for rapid monocyte isolation and generation of singular human monocyte-derived dendritic cells. Plos One, 2020. 15(4).
7. Sontag, S., et al., Differentiation of Human Induced Pluripotent Stem Cells (iPS Cells) and Embryonic Stem Cells (ES Cells) into Dendritic Cell (DC) Subsets. Bio-Protocol, 2017. 7(15).
8. Macri, C., et al., Dendritic cell subsets. Seminars in Cell & Developmental Biology, 2018. 84: p. 11-21.
9. Subtil, B., et al., The Therapeutic Potential of Tackling Tumor-Induced Dendritic Cell Dysfunction in Colorectal Cancer. Frontiers in Immunology, 2021. 12.
10. Eich, C., et al., Isolation and high-dimensional flow cytometric analysis of tumor-infiltrating leukocytes in a mouse model of colorectal cancer. Frontiers in Immunology, 2024. 15.