T细胞作为免疫系统的卫士,肩负着适应性免疫的重担,在细胞免疫和体液免疫都有着关键性的作用。不仅如此,基于T细胞的三大免疫疗法:CAR-T、TCRT、TILs也在“遍地开花”。截止目前,FDA共批准了6款CAR-T产品,中国也上市了5款CAR-T产品,全球共有11款CAR-T产品获批!2024年2月16日,全球首款TIL疗法- lifileucel(LN-144)获批上市,用于治疗晚期黑色素瘤,成为有望攻克实体瘤的又一把利剑。
类器官与T细胞的共培养也是一大研究“爆点”:T细胞与肿瘤类器官共培养,可为优化个性化实体瘤靶向细胞疗法提供支持[1],也可基于类器官免疫共培养技术的药物筛选平台,筛选出能改善肿瘤免疫原性的表观遗传调节药物[2]。
不可否认的是,这些巨大成就都依赖于T细胞的体外培养,那么T细胞的体外扩增培养又是如何实现的呢?小优接下来会从T细胞来源---培养---激活---扩增---分化---活力维持---功能检测---热门研究八个方面给大家介绍。
敲黑板:T细胞之外你还想了解哪些细胞?更多惊喜文末等着你~
1.T细胞来源
可来源于捐献者的血液或者其他实体组织样本,进而通过样本制备、细胞分选等操作获得高纯度高活性的T细胞。具体样本制备和细胞分选的内容,小伙伴们可以参考之前的文章:《免疫细胞培养通关技巧之样本制备》和《免疫细胞培养通关技巧之细胞分选》。用于癌症治疗的原代T细胞通常来自自体(患者)或同种异体(非患者)供体。自体样本是CAR-T疗法等过继细胞治疗的标准做法,有助于避免在输回患者体内时与非自身抗原发生自身免疫反应。在这些情况下,培养和扩增工程化T细胞至关重要,因为癌症患者的天然T细胞数量通常会减少。
文中部分相关产品:
| 产品名称 | 产品货号 |
| MACS Tissue Storage Solution, 100mL | 130-100-008 |
| FICOLL PAQUE PLUS 6X100 ML | 17144002 |
| MACS全自动温和组织处理器-GentleMACS Octo with Heater | 130-096-427 |
| Umbilical Cord Dissociation Kit, human | 130-105-737 |
| gentleMACS 25 C Tubes | 130-093-237 |
| Collagenase, Type 1 | LS004197 |
| MACS SmartStrainer, 30µM | 130-098-458 |
| Dead Cell Removal Kit | 130-090-101 |
| Debris Removal Solution | 130-109-398 |
2.T细胞培养
培养体系
可使用经典的培养体系,即基础培养基(实验室中培养T细胞最常用的培养基是RPMI-1640)+胎牛血清或者无血清培养基。需要注意的是,胎牛血清作为动物源制品,若培养的T细胞后续用于人类治疗时则需慎重,小优更倾向于推荐大家使用无血清的培养体系。
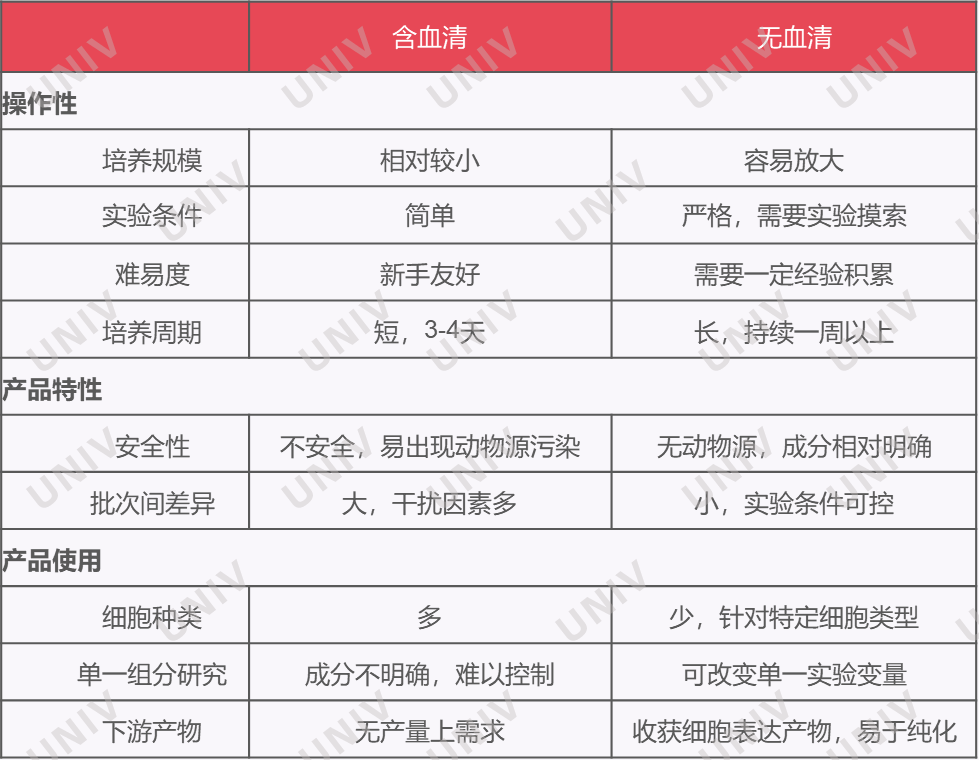
图1含血清和无血清培养体系的区别
△点击放大图片
文中部分相关产品:
| 名称 | 货号 |
| RPMI 1640 WITH GLUTAMINE, WITHOUT CALCIUM NITRATE | SH30809.01 |
| X-VIVO 15 with Gent L-Gln, Phen Red, 1 L | 04-418Q |
| Australian FBS, 500ML | SV30208.02 |
| New Zealand FBS | SH30406.05 |
培养条件
T细胞的培养温度为37°C;CO2 浓度通常为5%;此外,也需要防止细菌、真菌、支原体、内毒素、病毒等污染物的出现。这部分的内容大家可以参考《免疫细胞培养通关技巧之质量优化》。
文中部分相关产品:
| 产品名称 | 货号 |
| MYCOALERT DETECTION KIT- 10 TESTS | LT07-118 |
| 支原体清除剂 | abs9375-200ul |
| MYCOZAP 1 TREATMENT KIT | LT07-818 |
| 动态显色法内毒素检测重组鲎试剂盒 | abs50045-1kit |
3.T细胞激活
自然状态下,T细胞的激活需要两个信号:第一个信号T细胞上的抗原特异性T细胞受体(TCR/CD3)与抗原提呈细胞(APC)上的抗原肽-MHC分子复合物的相互作用,即抗原识别过程,第一信号是T细胞活化所必须的,但不能引起T细胞增殖和细胞因子释放。当T细胞表面表达的共刺激分子与APC表达的配体相结合时,就生成了第二个T细胞激活信号,其中最重要的是T细胞表面CD28分子与APC表面相应配体B7-1(CD80)和B7-2(CD86)的结合。而在体外培养T细胞时,则借助CD3和CD28抗体来模拟两个激活信号。另外,也可以将CD3和CD28抗体偶联磁珠或多聚体以激活T细胞,或者使用商品化的激活扩增试剂盒。
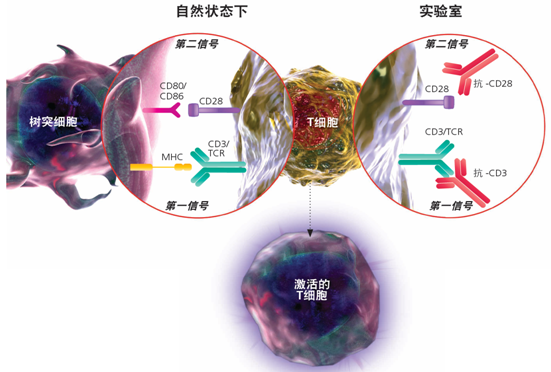
图2 T细胞的体内体外激活示意图
△点击放大图片
抗体法[3]:在体外联合使用抗CD3和CD28的抗体刺激T细胞,抗CD3单克隆抗体识别 TCR-CD3复合体上CD3分子的ε链并相互作用,从而增强T淋巴细胞的活化与增殖。抗CD28单克隆抗体与B7-CD28复合体上的CD28分子相互作用,能提供有效的共刺激信号,激发T细胞增殖,可诱导T细胞的分化、增殖和IL-2等细胞因子的分泌。从而模拟T细胞活化的双信号作用。
a) 使用anti-human CD3抗体(无菌PBS稀释)包被24孔板,包被浓度1μg/mL;室温放置4 h(也可4℃包被过夜),吸去未结合的抗体悬液;
b) 每孔加入500 μL含1%BSA的PBS溶液进行封闭,室温30 min,结束后用无菌PBS洗涤1次;
c) PBMC接种于上述24孔板中,接种密度1*106/mL,培养体系为含10%热灭活胎牛血清、1%双抗、3μg/mL anti-human CD28、100 IU/mL human IL-2的RPMI-1640培养基;
d) 培养3天后,收集细胞,计数,台盼蓝染色检测细胞活力,用于进一步分析。
磁珠法:以美天旎T Cell TransAct™, huma为例:在100nm右旋糖苷基质上分别耦联人源化的CD3、CD28抗体,高效模拟抗原递呈过程,实现高效、持久的T细胞激活。使用时,按照体积比1:100加入即可。
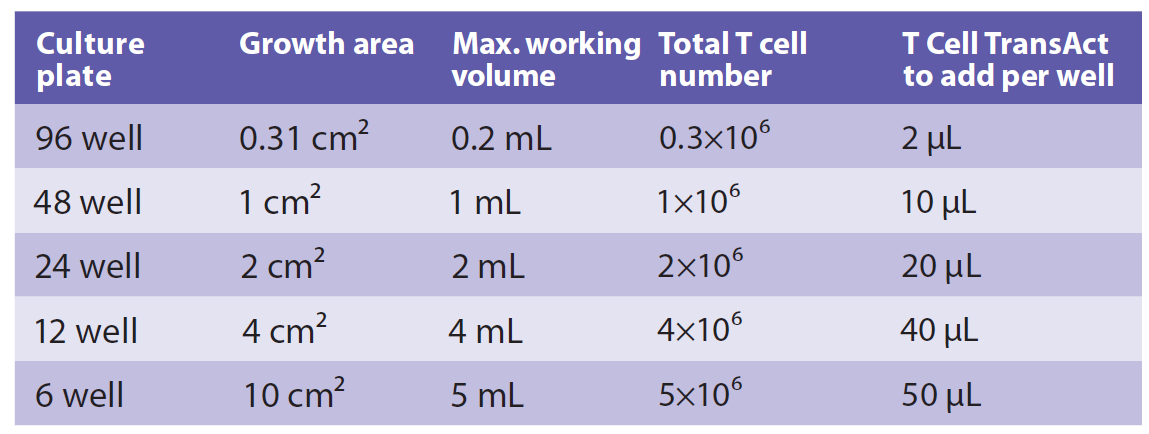
图3 不同孔板对应的T细胞密度及所需激活试剂体积
△点击放大图片
注意事项:
原代T细胞一般在体外的培养时间不超过三周,用于功能实验的T细胞建议培养时间在14天以内。
抗体法中CD3和CD28的包被浓度需要摸索确定,一般为1-10ug/ml,且多采用CD3包被,CD28游离的方法。
磁珠法中,磁珠分为微米级和纳米级,以T Cell TransAct™, human(130-128-758,纳米级)和T Cell Activation/Expansion Kit, human(130-091-441,微米级)为例, 130-128-758(纳米级)是通过换液,或者离心清洗就可以去除,130-091-441(微米级)则通过MACSiMAG分选器去除磁珠和抗体。
文中部分相关产品:
| 产品名称 | 货号 |
| Invivo anti-Human CD28 Monoclonal Antibody(15E8) | abs171614-100uL |
| Invivo anti-Human CD3 Monoclonal Antibody(OKT3) | abs171613-100uL |
| T Cell Activation/Expansion kit, human | 130-091-441 |
| T Cell Activation/Expansion Kit, mouse | 130-093-627 |
4.T细胞扩增
T细胞扩增使研究人员能够生成大量T细胞,以最大限度地发挥治疗潜力。通常会在培养物中添加特定细胞因子,例如白细胞介素2 (IL-2) 或 IL-7/IL-15,以支持T细胞扩增和存活。21年一篇文献发现:T细胞密度为2.5×105 cell/mL时的扩增效果优于较高或较低密度,且在高于50 IU/mL的IL-2浓度下表现出更高的扩增效率[4]。当需要大量抗原特异性T细胞时,可以反复接触抗原以激活T细胞从而达到扩增的目的,但是反复激活的方法应谨慎使用,因为它会导致T细胞衰竭和功能下降。在扩增阶段,可以观察T细胞克隆团的形成、检测细胞增殖情况或者流式细胞术检测相应的细胞标记物。
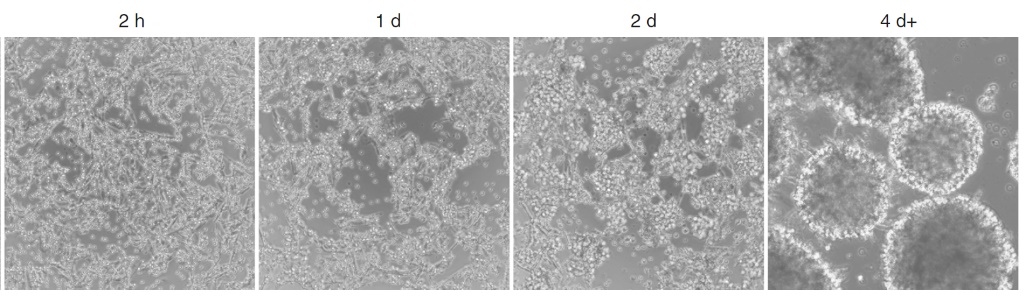
图4 T细胞扩增阶段形成的克隆团[5]
△点击放大图片
5.T细胞分化
不同类型的效应T细胞在免疫调节网络中发挥着核心作用,该网络充当人体的防线,并在疾病状态下引发免疫反应。如Th1细胞因子在识别和清除细胞内病原体如病毒和细菌,包括结核分枝杆菌、麻风分枝杆菌和利什曼原虫方面起着重要作用;Th2细胞介导针对细胞外寄生虫、细菌、过敏原和毒素免疫反应的活化和维持;Th17细胞在宿主防御细胞外病原体中发挥作用;Treg对维持自身耐受性和免疫细胞稳态至关重要。T细胞体外诱导分化需要添加的细胞因子或抗体大家可以参考图5,同时小优也给大家汇总了一份体外诱导T细胞分化方案(图6)。
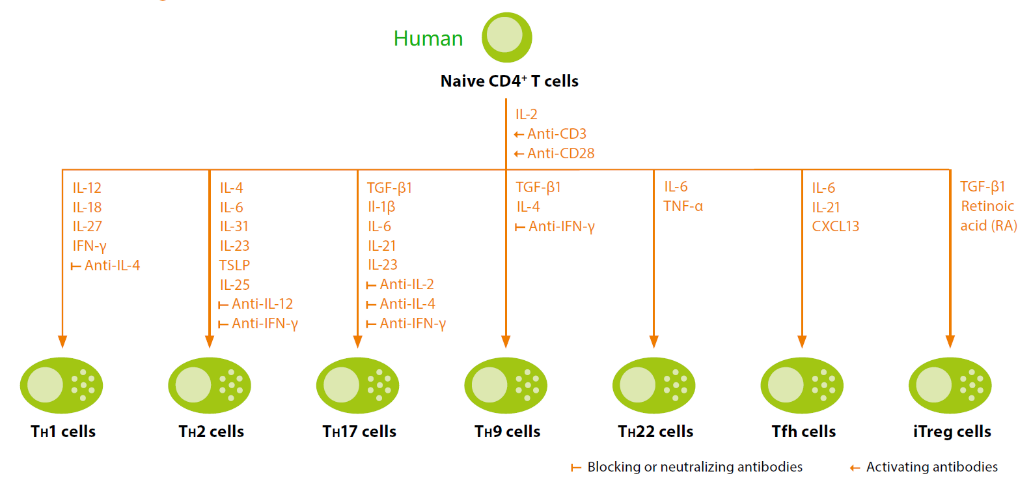
图5 Naïve T细胞在不同抗体或细胞因子作用下诱导分化为对应亚型
△点击放大图片
 图6 体外诱导T细胞分化方案[6]
图6 体外诱导T细胞分化方案[6]
△点击放大图片
文中部分相关产品:
| 产品名称 | 货号 |
| IL-2, Human | UA040108-500μg |
| IFN-γ Protein, Human | UA040053 |
| Recombinant Human IL-6 Protein | 206-IL |
| TGF-β1 Protein, Human | UA040085-1mg |
6.T细胞活力维持
T细胞活力对于任何T细胞培养实验或治疗的成功都至关重要,在这里需要确认三个方面的因素:避免T细胞培养密度过高而出现密度抑制的现象;确保培养体系可以提供T细胞必需的营养物质和生长因子;保证培养环境的无菌。
7.T细胞功能检测
一旦培养出足够数量的T细胞,就可以通过各种实验方法来评估T细胞的表型、功能和活力,比如:
细胞毒性试验:测量T细胞杀死靶细胞(例如癌细胞或感染细胞)的能力。
ELISpot检测:酶联免疫吸附斑点(ELISpot)实验可量化特定细胞因子的分泌,从而了解T细胞的功能。
流式细胞术:可用于分析T细胞的表面标志物、胞内蛋白及信号转导。

图7 T细胞不同亚型的表面标记物、转录因子以及分泌的细胞因子
△点击放大图片
文中部分相关产品:
| 产品名称 | 货号 |
| 人CAR-T细胞9色Panel | LXFH09-1 |
| 人T细胞分化12色panel | LXFH12-1 |
| 小鼠Th1/Th2/Th17+Treg细胞9色Panel | LXFM09-1 |
| PE Mouse Anti-Human CD3(UCHT1) | 561880 |
8.T细胞热门研究
小优以发表在Nature Protocols的《Tumor organoid–T-cell coculture systems》中描述的肿瘤类器官与T细胞共培养为例给大家介绍:
类器官part:在开始共培养之前,需从肿瘤组织中获取肿瘤细胞建立肿瘤类器官,在共培养前两天从基质胶中分离肿瘤类器官,共培养前一天用IFN-γ进行刺激,共培养当天,将肿瘤类器官解离成单细胞。
T细胞part:从外周血中分离PBMC,具体的操作方法也可以参考《免疫细胞培养通关技巧之样本制备》。
共培养part: 将肿瘤类器官单细胞悬液与PBMC一起培养在涂有anti-CD28的培养皿中,并加入IL2和anti-PD1。共培养一周后,将新的肿瘤类器官解离成单细胞悬液再次刺激PBMC。共培养两周后,可冻存T细胞(黄色)、评估T细胞对肿瘤细胞的反应性(绿色)或进行肿瘤类器官杀伤实验(蓝色)。
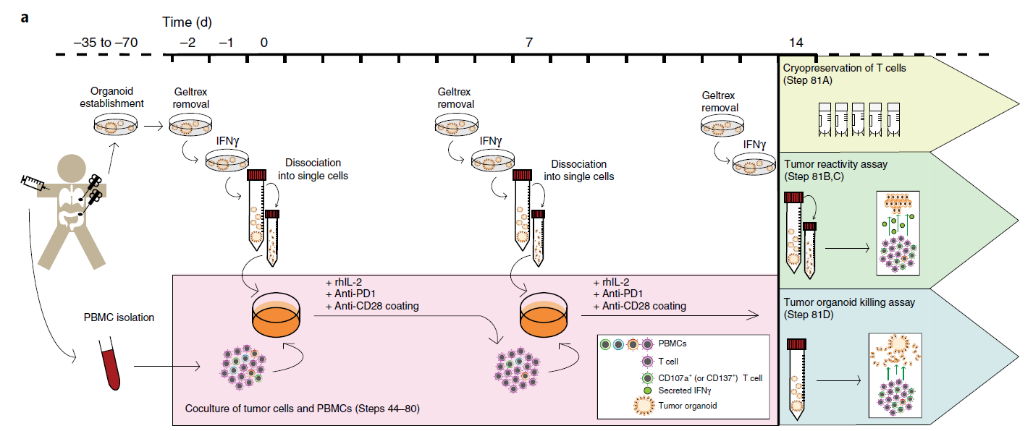
图8 肿瘤类器官- T细胞共培养系统流程图[7]
△点击放大图片
文中部分相关产品:
| 产品名称 | 货号 |
| Organotial人乳腺癌类器官培养试剂盒 | abs9446-1kit |
| Organotial小鼠正常肺类器官培养试剂盒 | abs9515-1kit |
| Cultrex Reduced Growth Factor Basement Membrane Extract, Type 2, Pathclear | 3533-010-02 |
| CryoMACS® Freezing Bags | 200-074-401 |
注意事项:
共培养前使用IFN-γ刺激肿瘤类器官的目的是使后续共培养时抗原呈递最大化
共培养时加入anti-PD1是为了抵消IFN-γ对PD-L1的诱导
肿瘤类器官与免疫细胞共培养时,需要精确控制免疫细胞比例及激活状态
免疫系统对肿瘤的反应是动态变化的,包括免疫监视、免疫逃逸和肿瘤免疫编辑等过程,这些都需要在模型中得到有效模拟
T细胞之外你还想了解哪些细胞?
除了免疫卫士-T细胞,人体还有许多细胞在“卖力工作”(图5)。人体有四大组织:神经组织、结缔组织、上皮组织、肌肉组织。每种细胞都有其存在的价值和研究的意义:神经元活动与情绪调节和心理健康紧密相关,研究神经元有助于理解抑郁症、焦虑症等心理疾病的成因;成纤维细胞与肿瘤细胞之间的相互作用影响肿瘤的生长和转移,了解这些相互作用有助于开发抗癌策略;巨噬细胞作为固有免疫的关键细胞,可参与炎症、肿瘤免疫、自身免疫疾病等多种生理病理过程。
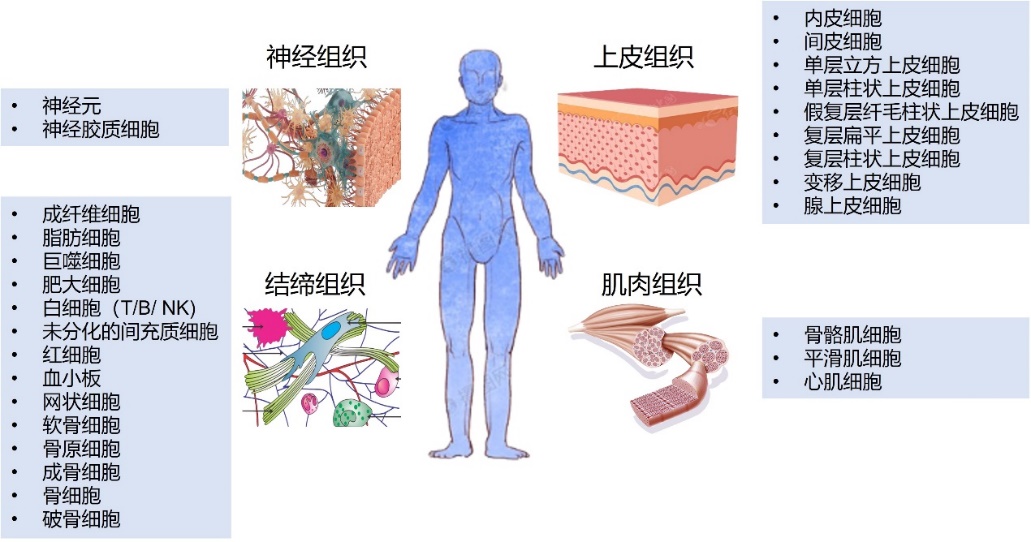
图5 人体四大组织及对应细胞类型
△点击放大图片
1. Dekkers, J.F., et al., Uncovering the mode of action of engineered T cells in patient cancer organoids. Nature Biotechnology, 2022. 41(1): p. 60-69.
2. Zhou, Z., et al., A T Cell‐Engaging Tumor Organoid Platform for Pancreatic Cancer Immunotherapy. Advanced Science, 2023. 10(23).
3. Soltantoye, T., et al., Soluble and Immobilized Anti-CD3/28 Distinctively Expand and Differentiate Primary Human T Cells: An Implication for Adoptive T Cell Therapy. Iranian Journal of Allergy, Asthma and Immunology, 2022.
4. Ghaffari, S., et al., Optimizing interleukin-2 concentration, seeding density and bead-to-cell ratio of T-cell expansion for adoptive immunotherapy. BMC Immunology, 2021. 22(1).
5. Zhang, D.K.Y., A.S. Cheung, and D.J. Mooney, Activation and expansion of human T cells using artificial antigen-presenting cell scaffolds. Nature Protocols, 2020. 15(3): p. 773-798.
6. Sekiya, T. and A. Yoshimura, In Vitro Th Differentiation Protocol, in TGF-β Signaling. 2016. p. 183-191.
7. Cattaneo, C.M., et al., Tumor organoid–T-cell coculture systems. Nature Protocols, 2019. 15(1): p. 15-39.