细胞因子是一类分泌型的小分子蛋白(肽),其分子量在6-70 kDa之间1,包括白细胞介素、干扰素、肿瘤坏死因子、生长因子和趋化因子2,它们在细胞信号传导、细胞间通讯及多种细胞和免疫功能中发挥关键作用,并参与炎症反应的调节,细胞生长与分化、趋化及促血管生成3。
细胞因子的产生受到严格调控。由于大多数细胞因子具有较高生物活性,它们在体液中的稳态浓度较低。在健康个体中,细胞因子在体液或组织中可能检测不到,或者以pg/mL 浓度存在1。细胞因子浓度升高可能表明与炎症或疾病进展相关的通路被激活4,因此常被用作生物标志物,用于了解和预测疾病进展及监测治疗效果。细胞因子的检测对于疾病研究和临床应用至关重要。
本文旨在介绍目前常用的细胞因子检测技术,包括:
单指标检测技术:ELISA,WB,TR-FRET
多指标检测技术:Luminex、CBA、抗体芯片
超灵敏多指标检测技术:MSD、PEA、Simoa®
单细胞水平的细胞因子检测:ELISpot、流式细胞术、质谱流式
质谱检测技术
常用细胞因子检测方法比较
常见免疫检测原理
细胞因子检测/定量常依赖于免疫检测。免疫检测利用抗体的高特异性识别来检测目的蛋白。常见免疫检测的灵敏度通常在1-100 pg/mL之间,检测原理为双抗体夹心法或直接法。
(A)双抗体夹心法:使用一对配对的捕获抗体和检测抗体。捕获抗体固定在如96孔板、微珠、玻璃或膜等固相载体上。检测抗体与酶、荧光标签或DNA标签偶联,通过机器检测其信号,实现对细胞因子的定量;
(B)直接法:将捕获抗体固定在载体上,对分析样本中的蛋白质进行荧光标记,与抗体孵育。
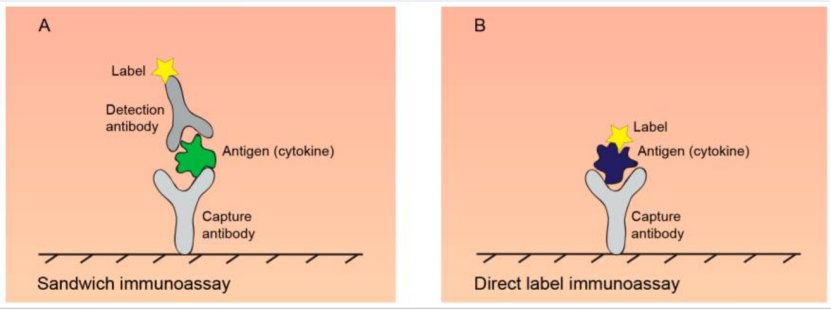
图:常见免疫检测的原理3
△点击放大图片
免疫检测对细胞因子的定量通常由标准曲线计算得出,标准曲线由数个已知浓度标准品测得的信号值绘制,以此推算未知样本的浓度。
在免疫检测中,样品成分(如其他蛋白质、离子、盐、pH 值或样品粘度)会对抗体表位的可及性、抗体与抗原的特异性/非特异性结合产生强烈影响,被称为基质效应。尽可能地减少基质效应是降低背景和准确定量的前提,可采用的方法是使标准品的基质组成与样本背景相似,或对样品进行稀释等。此外,检测应设置合适的对照,例如阴性对照、阳性对照、质控品(已测量的样品)等,以保证结果的准确性3。
单指标检测技术:酶联免疫吸附试验(Enzyme-linked Immunosorbent Assay,ELISA)
ELISA是基础和临床研究中对单一分析物进行定量分析的重要技术,可广泛用于多个物种和靶标的检测。目前商用的细胞因子ELISA试剂盒大多采用双抗体夹心法,能够高特异性检测复杂样品中的分析物,灵敏度高,操作简单方便,成本相对较低。但ELISA一次实验仅能检测一个靶标,若需在同一样品中检测多个靶标,操作多个ELISA较为复杂,时间花费长,且需要的样本量较大,后面提到的多指标分析技术可克服这些问题。另外,ELISA较窄的动态范围,使得部分样本需要稀释,这样可能会夸大样本间的差异7。
检测仪器平台:酶标仪
反应容器:96或384孔板
可检测种属:人、小鼠、大鼠、非人灵长类、猪、狗、牛、羊等多个种属
可检测样本类型:血清、血浆、细胞培养上清等,不同的试剂盒适配的样本类型不同。
所需样本体积:50-100 µL
单次实验可检测指标数:1
灵敏度:pg/ml
检测仪器平台:酶标仪
线性范围:2-3 logs,常规ELISA线性范围在10pg/ml-1000pg/ml,超敏试剂盒则为0.5-10pg/ml,不同试剂盒线性范围不同。
实验步骤
传统ELISA
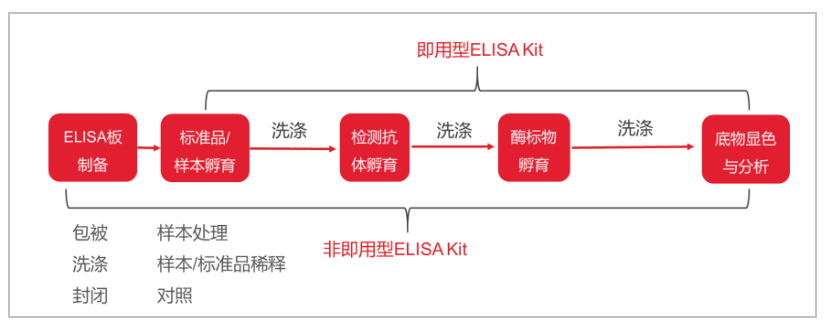
△点击放大图片
即用型ELISA详细操作步骤,以Mouse IL-1β ELISA Kit(abs520034-96T)为例
1. 准备好所有需要的试剂和标准品;
2. 从已平衡至室温的密封袋中取出微孔板,未用的板条请放回铝箔袋内,重新封口;
3. 向微孔板中加入300uL洗涤液,静置浸泡30秒,弃掉洗液在吸水纸上将微孔板拍干,请立即使用不要让微孔板干燥;
4. 分别将不同浓度标准品,实验样本或者质控品加入相应孔中,每孔100uL。用封板胶纸封
5. 住反应孔,室温孵育2小时;
6. 将板内液体吸去,使用洗瓶、多通道洗板器或自动洗板机洗板。每孔加洗涤液300uL,然
7. 后将板内洗涤液吸去。重复操作3次。
8. 在每个微孔内加入100uL检测抗体。用封板胶纸封住反应孔,室温孵育2小时;
9. 重复第5步洗板操作;
10. 在每个微孔内加入100uL SA-HRP,室温孵育20分钟。注意避光;
11. 重复第5步洗板操作;
12. 在每个微孔内加入100uL显色液,室温孵育5-30分钟,注意避光;
13. 在每个微孔内加入50uL终止液,孔内溶液颜色会从蓝色变为黄色。
14. 加入终止液后30分钟内,使用酶标仪测量450nm的吸光度值,设定540nm或570nm作为校正波长。
15. 计算结果
非即用型ELISA需自行将捕获抗体固定在孔板上,以下为抗体包被的详细步骤,以Human IL-6 DuoSet ELISA(DY206-05)为例
1. 将捕获抗体用不含载体蛋白的PBS稀释至工作浓度。每孔加入100 μL稀释后的捕获抗体,进行包被,密封后在室温下孵育过夜。
2. 每孔吸弃液体并用洗涤缓冲液清洗,重复此过程两次,总共洗涤三次。使用喷瓶、歧管分配器或自动洗板机将洗涤缓冲液 (400 μL) 注入每孔中进行清洗。每一步需完全去除液体。最后一次洗涤后,吸弃或倒置微孔板并在干净的纸巾上轻拍,去除剩余的洗涤缓冲液。
3. 每孔加入300 μL试剂稀释液来封闭孔板。室温下孵育至少1小时。
4. 重复第2步的吸弃/洗涤操作。
一步法ELISA
传统ELISA通常采用聚苯乙烯板,其疏水特性能够与蛋白质进行非特异性结合,使蛋白质能够附着在其表面,从而固定捕获抗体。然而,传统的ELISA方法需要多次洗涤,操作时间(3-5小时)相对较长,而且多次清洗和孵育可能会导致分析物脱落5。
亲和肽标签PS19(RAFIASRRIKRP)对亲水性聚苯乙烯表面有特异性亲和力,将此标签与谷胱甘肽S-转移酶(GST)进行基因融合后,可以被优先固定在亲水性聚苯乙烯(phi-PS)板上,而不会受到共存蛋白质分子的干扰5。另外,兔IgG与KPS19R10肽化学偶联后,也表现出较强的亲和力5。
基于这些发现,研究人员开发了一种使用带有肽标签的phi-PS板和连接蛋白作为配体蛋白的一步法ELISA5。这种方法避免了传统疏水性聚苯乙烯板(pho-PS)带来的非特异性结合问题,可以减少洗涤和孵育步骤,避免了因清洗导致的分析物脱落。与传统ELISA相比,一步法ELISA不仅显著缩短了操作时间,还保持了高灵敏度。
实验步骤:
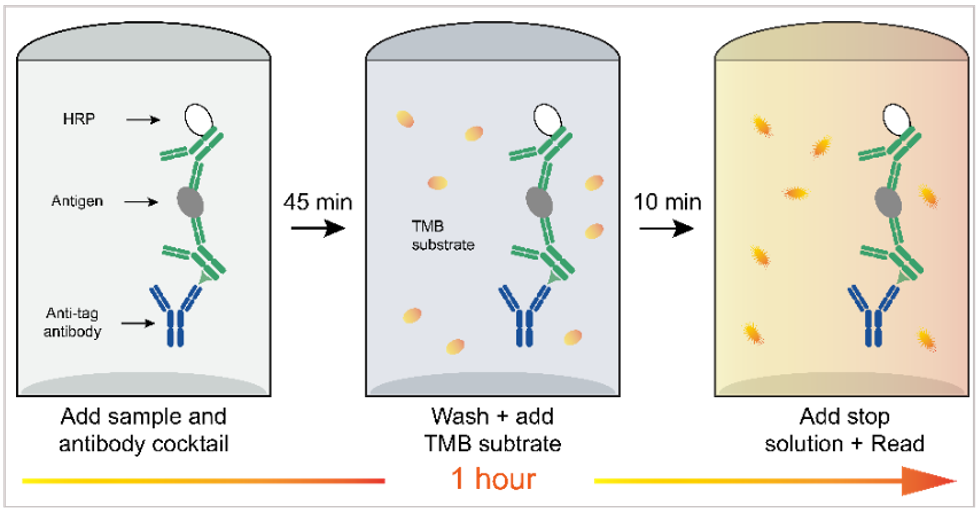
图:OneStep ELISA操作步骤简要示意图
△点击放大图片
OneStep ELISA详细操作步骤,以 Human IL-2 OneStep ELISA Kit(abs551116-96T)为例
1. 使用前将需要所有材料和试剂平衡至室温。建议所有标准品、对照品和样品一式两份做平行孔测试。
2. 准备所有试剂、工作标准品和样品。
3. 从可拆卸的板框上去除多余的酶标板条,将其放回含有干燥剂包装的箔袋中,重新密封并返回2-8ºC储存。
4. 取50μL样品或标准品加到相应的孔中。
5. 每孔中加入50μL抗体对混合液.
6. 贴上封板膜,在设置条件为“转速500转/分钟和温度37°C”的 酶标板恒温振荡器上孵育45分钟。
7. 用300μL 1X Wash Buffer清洗每个孔,清洗三次。最后一次洗涤后,把板子倒过来,在干净的纸巾上轻轻拍打数次,以去除多余的液体。
8. 每孔加入100μL TMB底物,在500转/分的酶标板恒温振荡器上避光显色10分钟。
9. 每孔加入100μL终止液,充分混匀后在30分钟内测定每个孔的OD450,使用设置为450nm的酶标仪。
10. 结果计算
技术文章:
讲座:
蛋白质免疫印迹法(Western Blot, WB)
ELISA常用于检测液体中的细胞因子,而WB更适用于分析细胞内以及复杂生物样本和组织中的细胞因子。在WB实验中,变性蛋白首先在聚丙烯酰胺凝胶中分离,随后被转移至硝酸纤维素膜或PVDF膜上,通过特异性抗体进行检测。虽然WB在检测细胞因子时可能不如 ELISA 灵敏,但它可提供蛋白质分子量信息,可区分剪接体或检测细胞因子分子降解,也可区分无活性前体和活性形式,或者是检测蛋白质的磷酸化等各种翻译后修饰。在检测前进行亚细胞组分分离(如核质分离、线粒体提取等),还可分析靶蛋白在细胞内的定位情况。
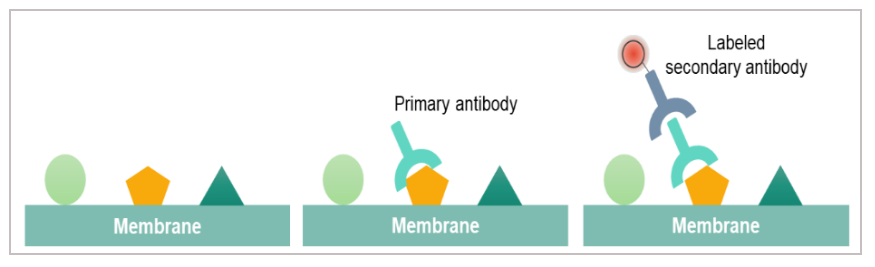
图:WB检测原理
△点击放大图片
检测平台:化学发光仪或荧光成像分析仪
反应场所:NC膜或PVDF膜
单个样本检测指标:1
可检测样本:细胞或组织裂解液所需样本量:10-150ug 总蛋白
灵敏度:pg~ng
数量级:无标准曲线,不可定量
实验步骤
一、样本准备
1. 裂解提取组织或细胞中的蛋白,并且测定蛋白纯度和浓度;
2. 蛋白溶液中加入适量蛋白上样缓冲液,置于沸水/金属浴中加热5-10min,后转移到冰上或者 4°C冰箱待用,短期可以保存于-20°C,长期请保存于-80°C。
二、SDS-PAGE胶的制备
3. 清洗玻璃板、梳子、制胶板和烧杯,晾干后装备好制胶板;
4. 根据目的蛋白的大小按配方配制不同浓度的分离胶,以10ml10%的分离胶为例:先依次加入4.6mlH20、2.7ml30% Acrylamide、2.5 ml1.5M Tris-Hcl(pH8.8)和0.1ml10% SDS,再加入 0.1ml 10%过硫酸铵和0.006mI TEMED立即混匀后倒入模具中,加入约1cm蒸馏水封顶;
5. 室温下30-60min待胶凝固后,倒去蒸馏水。按配方配制5%浓缩胶,以5ml为例:先依次加入3.4 ml H20、0.83ml 30% Acrylamide、0.63ml1.5M Tris-Hcl(pH6.8)和0.04ml 10% SDS,再加入0.04m10%过硫酸铵和0.005mI TEMED,混匀后立即倒入模具中,垂直插上梳子,注意不要有气泡。
三、电泳
6. 室温 30min 待胶凝固好后,将玻璃板固定在电泳桥中放入电泳槽,加入提前配制好的电泳液后,拔去梳子开始上样,选用相应蛋白分子量的 Marker,每个孔加入适量样品,在旁边空余的孔内加入适量蛋白Marker;
7. 电压调至80V,恒压状态开始电泳,约30min左右当 Marker条带分开后调整电压至 120V,继续电泳,直到指示剂溴酚蓝跑到凝胶最下端时,停止电泳。
四、转膜
8. 准备 PVDF 膜裁剪成合适大小并做好标记,提前配置好 1X 快速转膜缓冲液并预冷;
9. 用甲醇或者 PVDF 膜浸润激活液浸泡活化 PVDF 膜 30-60s
10. 电泳结束后,按顺序搭载转膜装置,将胶平整铺在电转夹上,将激活的PVDF膜覆盖于胶上,保证胶和膜之间没有气泡。缓慢加入预冷的1X快速转膜缓冲液,将转膜夹固定好后放入电转仪中,将电泳仪至于冰水混合物中,并且电泳仪内部需加入冰袋;
11. 电流 200-250mA,恒流状态,根据分子量大小设置转膜时间,开始电转。
五、封闭
12. 转膜结束后,先放入TBST漂洗一遍,去除膜表面的转膜液。再将PVDF膜转移到膜盒中,加入快速封闭液,室温轻摇15-30min(或使用5%脱脂奶粉溶液封闭 1h)。
六、免疫检测
13. 倒去封闭液,TBST在摇床上快速清洗三次,10 min/次。加入稀释好的一抗,室温摇床慢速孵育 2 小时或者 4°C过夜;
14. TBST快速清洗三次,10min/次。加入稀释好的二抗,室温摇床慢速摇晃孵育 1-2 h;
15. 弃去二抗,TBST 快速清洗三次,10min/次。
七、显影
16. 将显影液 A和 B等比例混合配成工作液(现配现用);
17. 把PVDF膜放在水平桌面上的保鲜膜上,在膜表面加入工作液,并使工作液完全覆 PVDF 膜,反应30-60s;
18. 取出PVDF膜,吸干多余的液体,放入化学发光仪中进行蛋白显影分析。
点此可查看WB成功指南,包括实验详细步骤,操作视频、实验小技巧及疑难解答等。
相关讲座:
时间分辨荧光共振能量转移(TR-FRET)
TR-FRET 是一种将时间分辨荧光(TRF, Time-Resolved Fluorescence)和荧光共振能量转移(FRET,Fluorescence Resonance Energy Transfer)相结合的技术。

图:THUNDERTM TR-FRET技术原理图
△点击放大图片
在FRET中,不同生物分子分别被标记上供体或受体荧光团。当生物分子相互作用时,供体和受体荧光基团靠近。此时,当供体被激发后,它可以将其发射能量转移给受体,受体进而发射特定波长的荧光。供体和受体的荧光发射波长不同,可通过仪器检测,从而实现对生物分子相互作用的定量分析。铕-藻蓝蛋白(Eu-APC 或 Eu-XL665)和铽-PE(Tb-PE)是两种常见的供体-受体对。Eu 的峰值激发/发射在 340/615 nm,而 APC 的峰值激发/发射在 615/660 nm。
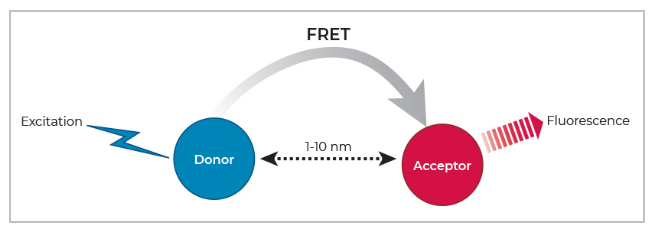
图:FRET原理
△点击放大图片
时间分辨荧光(TRF)通过使用长寿命荧光的镧系元素荧光团来降低背景信号。这种长寿命荧光持续数毫秒,因此,通过脉冲光源(例如闪光灯)激发荧光基团后,延迟一段时间再进行信号测量(即“计数窗口”),可以使仅存续纳秒的短寿命的荧光衰减后再进行测量。时间分辨荧光(TRF)能够显著提高信噪比。最常使用的镧系元素包括铕、铽和钐。这些元素通常以螯合物或笼状化合物的形式应用,以确保良好的信号强度和稳定性。
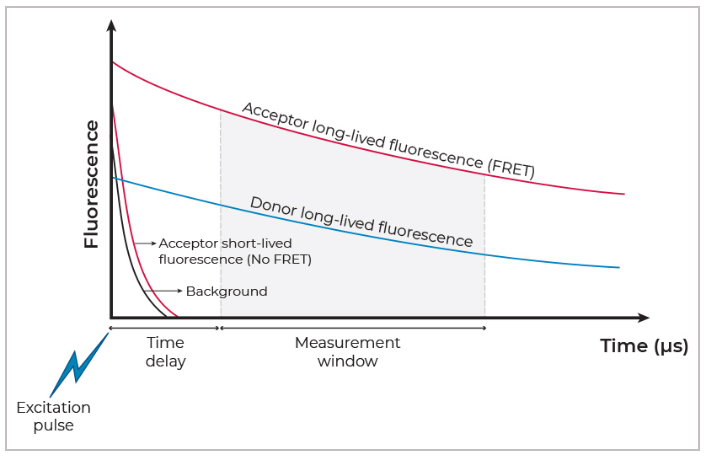
图:TRF原理
△点击放大图片
TR-FRET 通常用于分析分子间的相互作用,在检测细胞因子时,供体和受体通常是能识别同一个细胞因子不同抗原表位的抗体对。一种抗体用供体荧光团(铕穴合物)标记,而另一种抗体用受体荧光团(APC、ULight 或 d2)标记。它们特异性地与分析物结合,但结合位点不同,从而使供体和受体荧光集团靠近,实现 FRET2。
TR-FRET的时间分辨特性和近距离激发信号可以排除样本内其他成分的背景荧光,使其成为无需清洗的均相检测方法。其数据分析采用的是受体/供体荧光的比值,可进一步减少非特异性信号。由于以上种种优点,TR-FRET已广泛应用于药物研发,包括高通量筛选。
不过,由于TR-FRET涉及三个基本成分(供体、分析物和受体)之间的复杂物理特性,这三种成分的浓度和比例会显著影响信号,实验需要进行大量优化。FRET要求的近距离(20-90 Å)也给寻找合适的供体-受体对带来挑战2。
仪器平台:安装有TR-FRET模块的酶标仪
反应容器:96 、384 或 1536 孔板,推荐使用浅孔板
检测样反本种属:人、小鼠、大鼠、猪
可检测样本类型:细胞培养上清、血清
样本体积:样本体积15ul,整个反应体系仅20ul
灵敏度:pg/ml
线性范围:4 logs
特点:
1. 操作简单、快速:均相检测技术,无需洗板和包被,只需两步加样即检测,1-2h快速检测;
2. 反复读板,信号稳定:实验体系可支持反复读值,过夜、48h后读值亦可;
3. 节省样本:实验体系为20μl,样本仅需15μl;
4. 超高通量:兼容94孔,384孔和1536孔微孔板。
实验步骤:

△点击放大图片
详细操作步骤,以THUNDER™mouse IFNγ assay(KIT-MIFNG-100)为例
1. 准备缓冲液、标准品、样品及抗体等
2. 向孔板中添加15 µL标准品工作液或 15 µL 细胞上清液样品
3. 向每个检测孔中添加 5 μL 4X 抗体检测混合物 (Eu-Ab1 + FR-Ab2)
4. 密封膜盖住孔板,室温孵育 1 小时
5. 轻轻取下密封膜,在兼容TR-FRET 的微孔板读数仪上读取数据
多指标检测技术:液相悬浮芯片技术Luminex
与ELISA类似,Luminex技术也使用双抗体夹心法,其关键创新在于将抗体固定在微球表面。由于微球表面可包被大量抗体,因此大大增加了反应的表面积,提高了检测的灵敏度。

图:Luminex检测原理4
△点击放大图片
通过使用两种或三种不同的染料,并以不同比例对微球进行染色,可产生多达100种或500种不同颜色的微球。每种颜色的微球都具有独特的编码,并且只固定包被一种抗体,从而实现了编码与靶标的一一对应。由于微球是液态的,可将多种不同编码的微球混合在一起,放入同一个孔中。加入样本和检测抗体后,即可在一个样本中同时检测多种蛋白质。

图:Luminex多色微球
△点击放大图片

图:Luminex如何实现多指标检测
△点击放大图片
以同样检测20个指标为例比较Elisa和Luminex的不同,可见当样本量有限但需要检测的靶标众多时,Luminex技术更高效、更节省样本,且性价比更高,是目前应用最为广泛的多指标检测技术之一。
| 比较项目 | Luminex | Elisa |
| 检测靶标数量 | 20 | 20 |
| 样品数量 | 80 | 80 |
| 检测靶标组合 | 自由组合 | 单项检测 |
| 需96孔板数量 | 1块 | 20块 |
| 耗时 | 4-6个小时 | >4天 |
| 所需样品体积 | 25-50ul | ≥20*50μL |
| 重复性 | 同板操作影响少 | 多板检测人为因素多 |
| 单指标费用 | 低 | 高 |
检测平台:Luminex200、FLEXMAP 3D、MAGPIX
反应容器:96或384孔板
单孔可检测指标数:1~115
样本种属:人、小鼠、大鼠、非人灵长类、犬、猫、牛、马、猪、鸡、羊
可检测样本类型:血清、血浆、细胞上清、尿液、组织裂解液、乳汁、唾液、房水、脑脊液、支气管肺泡灌洗液等多种样本类型
所需样本体积:25-50μL
灵敏度:pg/ml
线性范围:3.5- 5.5 logs
实验步骤:

△点击放大图片
详细实验流程,以Human Luminex® Discovery Assay(LXSAHM)为例
1. 准备所有试剂、标准品和样品。
2. 向每孔加入 50 μL的标准品或样品。
3. 通过倒置或涡旋振荡来重悬稀释后的微球混合物。每孔中加入 50 μL微球混合物。用箔纸密封板。在设定转速为 800 ± 50 rpm 的水平轨道微孔板摇床上,室温孵育 2 小时。
4. 使用磁力洗板机进行清洗,将磁铁置于微孔板底部,等待 1 分钟后移除液体,向每孔加入 100 μL洗涤缓冲液,并再次等待 1 分钟后移除液体。重复此清洗步骤三次。
5. 向每孔加入 50 μL稀释后的生物素-抗体混合物。用箔纸密封板,并在设定转速为 800 ± 50 rpm 的摇床上,室温孵育 1 小时。
6. 如步骤 4 所述重复清洗。
7. 向每孔加入 50 μL稀释后的链霉亲和素-PE。用箔纸密封板,并在设定转速为 800 ± 50 rpm 的摇床上,室温孵育 30 分钟。
8. 如步骤 4 所述重复清洗。
9. 每孔加入 100 μL洗涤缓冲液重悬微珠。在设定转速为 800 ± 50 rpm 的摇床上孵育 2 分钟。
10. 在 90 分钟内使用 Luminex®分析仪读取结果。
实验指南:
讲座:
Cytometric Bead Array(CBA)
与前述Luminex技术类似,CBA也是基于微球的检测方法。不同的是CBA实现多个因子同时检测是利用了流式细胞仪可以识别同一种荧光素不同强度的特点。
将每种微球表面包被特定细胞因子的捕获抗体,通过流式细胞仪对微球和检测抗体上PE的荧光的强度进行分析,从而可以同时定量检测30种分析物。
仪器平台:流式细胞仪
反应容器:流式管
单管检测指标数:1~30
样本种属:人、小鼠、大鼠、狒狒、猕猴、恒河猴、牛、猪
可检测样本类型:血浆、血清、培养上清、泪液、体液、鼻腔冲洗液、细胞裂解液等液态样本
样本体积:25-50μL
灵敏度:常规10 pg/mL,高敏系列0.274pg/mL
线性范围:3-4 logs
实验步骤:
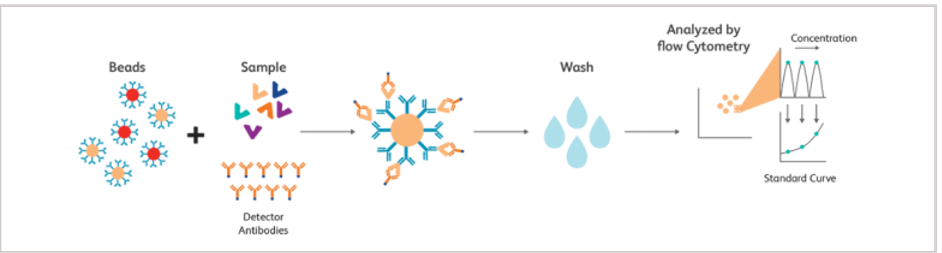
图:CBA的检测原理与实验流程
△点击放大图片
实验指南
相关讲座
抗体芯片
抗体芯片是检测蛋白的一种技术,包括双抗体夹心检测和直接检测两种形式。膜芯片通常是半定量的,采用化学发光或荧光检测,实验操作类似Western Blot,但不需电泳和转膜步骤。玻璃芯片通常是定量的,使用荧光检测。抗体芯片可同时检测多达1,200 种人类蛋白、640 种小鼠蛋白或 67 种大鼠蛋白,主要用于信号转导、蛋白质组学、肿瘤及其他疾病的相关研究。抗体芯片单次实验检测的样本数量较少,以R&D公司的Proteome Profiler系列产品为例,一个试剂盒检测4个样品,更适合做样品数量较少的多指标筛选。
仪器平台:膜芯片用化学发光仪,玻璃芯片需用玻璃芯片扫描仪
反应容器:膜或玻璃芯片
单张芯片可定量检测指标数:人类蛋白≤1200,小鼠蛋白≤640,大鼠蛋白≤67
检测种属:人、小鼠、大鼠、猪、牛、马、犬、兔、绵羊、猫、恒河猴、鸡、海豚
可检测样本:细胞培养上清、细胞组织裂解液、血清、血浆等
样本体积:定量芯片50-100ul
灵敏度:~pg/ml
实验指南:
相关讲座:
超灵敏多指标检测技术:电化学发光检测技术Meso-scale Discovery (MSD)
MSD超敏电化学发光技术由美国Meso Scale Discovery公司研发。 与传统的ELISA相似,MSD也是通过双抗体夹心法来定量目标蛋白。但其独特之处在于其采用了石墨烯材质的电极板作为反应容器,这种材质能显著增加捕获抗体的固载量。同时利用SULFO-TAG(三联吡啶钌)替代传统的酶或荧光染料标记在检测抗体上,当电极板通电时,SULFO-TAG发生一系列氧化还原反应,产生光信号,随后被仪器内的CCD相机捕获。MSD是电化学和化学发光两个过程的完美结合,可将许多非特异信号予以排除,受样本性质的影响更小,对于各类生物学样本的兼容度高。
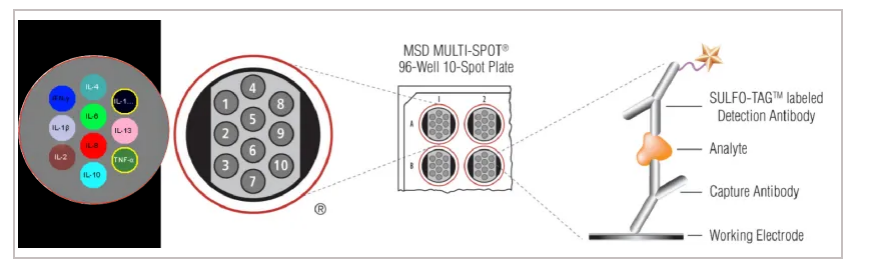
图:MSD检测原理
△点击放大图片
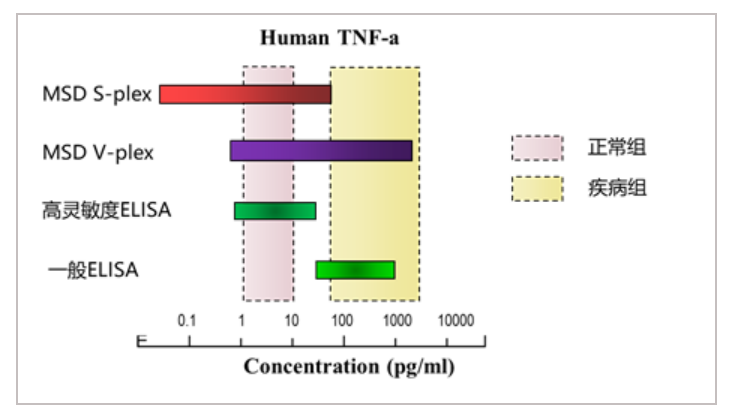
MSD的一大特点是超高的灵敏度及更宽的线性范围,它的灵敏度之所以可达到飞克级别,主要原因有以下几个方面:
1、石墨烯底板:其单位面积的抗体包被量较常规材质孔板提高约10倍
2、电化学发光技术:
MSD 以SULFO-TAG(三联吡啶钌) 作为发光基质,其分子量约为1000Da(约为HRP的1/40),空间位阻小,易于标记抗体,且不易阻碍其与待测物质的结合;当电极板通电时,三联吡啶钌上的钌元素会发生一系列氧化还原反应,循环反应持续进行并释放出光子,该光信号在620nm处发射,较荧光更稳定,不易淬灭;
3、包被方式:S-PLEX试剂盒孔板包被的是链霉亲和素,将其与生物素抗体结合。由于链霉亲和素与生物素有极高的亲和性,一个链霉亲和素可同时结合四个生物素分子,使得抗体包被量被大大提高。
目前,MSD技术在免疫学、疾病研究和药物开发等多个领域均得到了广泛应用。特别是在神经退行性疾病的研究中,MSD已成为aβ 38、40、42等蛋白检测的金标准,仅需10微升的样本量即可定量检测这些分析物。此外,MSD还提供了包括α-Synuclein、APP、NFL、NFH、Tau(total)、VEGF-A、GFAP以及不同磷酸化位点的Tau(如pT181、pT231、pT217)等在内的多种神经相关指标的检测产品,为科研人员提供了有力的研究工具。
检测仪器平台:MSD S120/MSD S600
反应容器:石墨烯材质的96或384孔电极板
单孔可检测指标数:1-10
检测种属:人、小鼠、大鼠、非人灵长类、犬
可检测样本类型:血清、血浆、脑脊液、尿液、细胞上清、组织裂解液、乳汁、唾液、房水、支气管肺泡灌洗液等多种样本
所需样本体积:10-25μL
灵敏度:可达fg/ml
线性范围:3–6 logs,线性范围更宽
△点击放大图片
实验步骤:
1.清洗并加入样品
用至少150ul/孔的洗涤缓冲液清洗酶标板三次。
每孔加入50 ul准备好的样品、校准品或对照品。
用粘性封板膜密封酶标板,并在室温下摇动孵育2小时。
2.清洗并加入检测抗体溶液
用至少150 ul /孔的洗涤缓冲液清洗酶标板三次。
每孔加入25 ul检测抗体溶液。用粘性封板膜密封酶标板,并在室温下摇动孵育2小时。
3.清洗并读数
用至少150 ul /孔的洗涤缓冲液清洗酶标板三次。
每孔加入150 ul的2X读数缓冲液T。
使用MSD仪器分析酶标板。
应用:
1. 神经退行性疾病、内分泌疾病、肿瘤免疫治疗等研究
2. Biomarker筛选
3. 药物免疫原性评估、抗体药物筛选、疫苗开发等
实验指南:
相关讲座:
邻近延伸分析(Proximity Extension Assay,PEA)
PEA使用一对与目标蛋白特异性结合的抗体,每个抗体都连接有一个独特的DNA序列。当两个抗体与目标蛋白质结合时,它们的DNA序列会靠近,通过DNA聚合酶催化进行延伸和扩增,最终通过实时定量PCR(qPCR)或二代测序(NGS)检测DNA信号,实现对目的蛋白的分析。PEA已被Olink®公司商业化,提供Explore HT(5300个指标)、Explore(384/3072个指标)、Target(48/96个指标)、Flex(半定制)、Focus(定制)系列试剂盒,一周最高可检测2064个样本,其中Target48/Flex/Focus系列可提供定量结果(pg/ml),其他则可提供相对定量的NPX值(Normalized Protein eXpression,均一化蛋白表达)。Olink®技术以其多指标、高通量、极微量样本及超高灵敏度的优势,在生物标志物发现、疾病机理研究、药物开发、临床诊断和人群健康研究等领域展现了广泛的应用前景。
检测平台:Olink® Signature Q100或二代测序仪
反应容器:96孔板
单孔检测指标:48~5400+
可检测种属:人、小鼠
可检测样本:血浆,血清,组织裂解液、细胞培养液、脑脊液、尿液、房水等多种体液样本
所需样本量:1-6ul
灵敏度:fg/ml
线性范围:10 logs,fg-mg/mL
单分子阵列:(Single Molecular Array,Simoa®)
Simoa®技术是一种用于检测极低浓度蛋白质的高灵敏度技术。它将样本中的目的蛋白捕获到含有特异性抗体的微珠(直径2.7μm)上,并将这些微珠分布在微流控芯片中的238000个小孔(nanowell)内。每个小孔体积非常小,直径仅4.5μm,体积约 40 fl 左右。将免疫复合物磁珠分配于微井中,再借助高分辨率荧光显微镜对荧光点进行计数,依据泊松分布理论,计算同时含珠子与荧光产物孔的数量/含珠子孔总数的比值,以此确定样品中的蛋白质浓度。Simoa® 的整个实验流程(包括样本稀释,试剂添加,孵育,洗涤,检测和分析等所有环节)均由专用仪器平台完成,降低了手工操作的误差,单次实验最多可检测10 个指标,比传统ELISA灵敏度提高1000倍以上,检测限低至1 fg/mL6。目前,Simoa®广泛应用在神经性疾病、肿瘤检测、传染性疾病等研究中。
实验平台:Simoa专用仪器
反应容器:96孔板或样本管
单次实验检测指标:≤10个
可检测种属:人、小鼠、大鼠、非人灵长类、牛、猪
可检测样本:血浆,血清,脑脊液、眼泪、细胞培养上清等多种生物样本
所需样本量:1ul-100 ul,平均25 ul
灵敏度:fg/ml
线性范围:2.5~4+ logs
单细胞水平的细胞因子检测:酶联免疫斑点实验(Enzyme Linked Immunospot Assay, ELISpot)
常见的免疫检测方法通常仅可检测由大量细胞产生、释放到组织或各类体液中的细胞因子,或是体外培养细胞释放的细胞因子,测得的是细胞的平均反应,无法检测某类细胞亚群(如抗原特异性 T 细胞或 B 细胞)的细胞因子分泌情况。ELISpot则可以在单细胞水平对抗体分泌细胞(ASC)及细胞因子分泌细胞进行检测。首先,将细胞孵育在包被有捕获抗体的多孔板上,该抗体可捕获分泌的细胞因子。去除细胞后,加入检测抗体,通过显色反应或荧光观察细胞因子的产生。每个产生细胞因子的细胞位置都显示为一个斑点。通过 ELISpot读板仪对斑点进行计数和分析。统计膜上的斑点数目,再除以当初加入孔内的细胞总数,即可以计算出阳性细胞的百分比。
目前,ELISpot的主要应用在以下领域:
1. 免疫学基础研究(T 细胞和 B 细胞,Th0/Th1/Th2 细胞分析):ELISpot可用来区分被激活的不同T细胞亚群。例如Th1细胞主要分泌IFN-γ,IL-2 和TNF-α,而Th2细胞分泌IL-4,IL-5和IL-13等。
2. 疫苗研究:ELISpot是检测和评价疫苗的细胞免疫水平的国际公认的标准工具,已广泛用于疫苗的研制和评估。
3. 肿瘤免疫研究和免疫治疗/细胞治疗:用于检测肿瘤抗原特异性的细胞免疫反应。
4. 感染性疾病研究与诊断:第一个被SFDA 批准的基于ELISpot法的诊断平台(T-SPOT.TB)已上市,此外,ELISpot还可用于其他感染性疾病如HBV,HCV等的抗感染免疫研究与诊断。
5. 自身免疫疾病研究:如I型糖尿病、多发性硬化、系统性红斑狼疮等疾病病因分析、预测、早期诊断、指导治疗以及预后分析等。
6. 其他:药物筛选、移植免疫研究等,适用于任何想要在单细胞水平研究蛋白分泌的实验。
检测平台:ELISpot Reader
反应容器:ELISpot 多孔板(通常是96孔板)
单次实验检测指标:ELISpot检测单个指标,FluoroSpot最高可测7种
可检测样本:人或动物的PBMC、脾细胞、其他类型的免疫细胞,如T细胞、B细胞等
灵敏度:1 in 100,000 cells
实验步骤:以Mouse IFN-gamma ELISpot Kit(EL485)为例
1. 在每孔中加入用200 μL无菌培养基,室温孵育20分钟。
2. 吸出孔内的培养基,立即向每孔中加入100 μL相应的细胞或对照。
3. 在湿润的37°C二氧化碳培养箱中孵育细胞。每个刺激的最佳孵育时间应由研究者确定。在孵育期间不要扰动细胞。
4. 吸出每个孔中的液体并清洗,整个过程重复三次共四次清洗。使用挤压瓶、歧管分配器或自动洗板机向每孔中加入250-300 μL的洗涤缓冲液进行清洗。最后一次清洗后,移除剩余的洗涤缓冲液。将板倒置并在干净的纸巾上轻拍。
5. 每孔中加入100 μL稀释的检测抗体混合物,2-8°C过夜孵育。或在摇床上室温孵育2小时。
6. 重复步骤4中的清洗程序。
7. 每孔中加入100 μL稀释的链霉亲和素-碱性磷酸酶浓缩液A,室温孵育2小时。
8. 重复步骤4中的清洗程序。
9. 向每个孔中加入100 μL的BCIP/NBT底物,室温避光孵育1小时。
10. 去除孔板中的BCIP/NBT底物溶液,用去离子水冲洗微孔板。将微孔板倒置轻敲以去除多余水分。从微孔板底部移除柔性塑料排水装置,用纸巾彻底擦干板底并完全晾干(室温下60-90分钟或37°C下15-30分钟)。
相关文章:
相关讲座:
流式细胞术(Flow Cytometry,FCM)
流式细胞术(Flow Cytometry, FCM)是一种在生物医学研究中广泛应用的技术,它通过测量细胞的物理和化学特性来对细胞进行快速、高通量的分析和分选。基于单细胞分析,可检测表达细胞因子的细胞的频率,并通过对细胞内细胞因子和细胞标记物进行染色来表征特定细胞群。流式细胞术能进行多参数分析,分析参数的数量与细胞群、目标细胞因子和流式细胞仪相关。但并非所有细胞因子都能通过单一方案检测到,检测低表达或新鉴定的细胞因子可能需要对染色进行严格优化。此外,细胞内存在细胞因子并不一定意味着它会从细胞中释放出来或在体内表现出生物学效应3。
检查平台:BD FACS Celesta等流式检测平台
样本类型:心脏、肝、肺、脾、肿瘤、肠、皮肤、血液等样本
质谱流式细胞术(Mass cytometry,CyTOF)
质谱流式细胞术(也称为CyTOF)是一种将流式细胞术和质谱法相结合的单细胞分析技术。该方法理论上每秒可对多达3000个细胞进行实时定量单细胞分析,并可以同时测量一个细胞中的60种不同标记物(蛋白质或其他生物分子)。与传统流式细胞术一样,细胞被特异性抗体染色,但这些抗体与元素标签(金属的稳定同位素)而不是荧光染料结合。细胞分析由电感耦合等离子体飞行时间质谱仪(ICPTOF-MS)进行。与基于荧光的流式细胞术相比,该技术的主要优势是分辨率高、灵敏度高,可以同时测量大量标记物,而且不需要补偿发射光谱重叠。然而,该技术无法进行细胞分选,而且结果的质量控制和统计分析也具有挑战性3。
质谱(Mass spectrometry,MS)
质谱(MS)是蛋白质组学的一项基本技术,用于蛋白质的鉴定和定量。在经典的自下而上的蛋白质组学工作流程中,蛋白质先被分离并用酶(如胰蛋白酶)消化成肽段,之后肽段经过浓缩、脱盐、高效液相色谱(HPLC)分离,再通过质谱分析。串联质谱(MS/MS)测量肽段的质荷比及其片段离子,实现对肽段/蛋白质进行特异性的鉴定和定量。
然而,质谱在细胞因子检测中面临若干挑战。首先,质谱仅能检测带电荷的肽,而不同肽的离子化效率存在差异。其次,细胞因子等低分子量蛋白质产生的肽段少,并且在复杂的生物样本中含量极低,因此在没有适当的富集步骤下难以检测。此外,尽管质谱技术具有高重复性和特异性,但由于其对低丰度蛋白质如细胞因子的检测灵敏度有限,通常需要样品预处理。蛋白质鉴定过程依赖于现有数据库,这在非人类物种的研究中可能不够全面。总的来说,与免疫学方法相比,质谱技术在灵敏度上可能有所不足3。
常用细胞因子检测方法比较
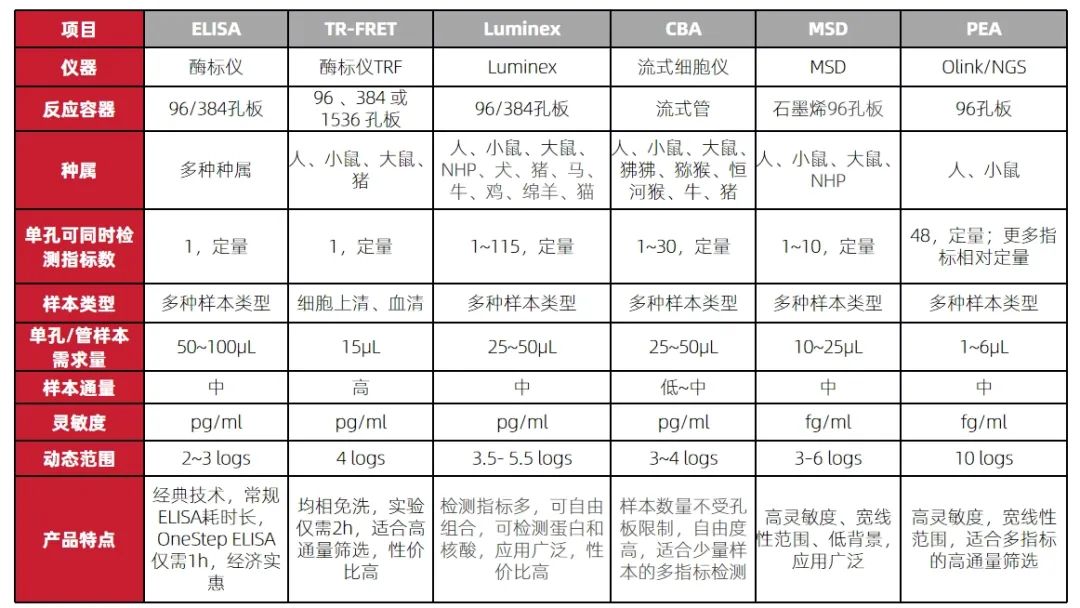
△点击放大图片
细胞因子的检测方法众多,每种方法各有优劣势,科研人员需根据样本种属、指标、样本体积、数量、仪器平台及价格等挑选适合的技术,也可联系小优为您推荐合适的方案。优宁维提供完整的细胞因子检测解决方案,包含仪器、试剂耗材及服务,为您的科研保驾护航。
相关文献:
1.Stenken JA, Poschenrieder AJ. Bioanalytical chemistry of cytokines--a review. Anal Chim Acta. 2015 Jan 1;853:95-115.
2.Platchek M, Lu Q, Tran H, Xie W. Comparative Analysis of Multiple Immunoassays for Cytokine Profiling in Drug Discovery. SLAS Discov. 2020 Dec;25(10):1197-1213.
3.Kupcova Skalnikova H, Cizkova J, Cervenka J, Vodicka P. Advances in Proteomic Techniques for Cytokine Analysis: Focus on Melanoma Research. Int J Mol Sci. 2017 Dec 13;18(12):2697.
4.Dinarello CA. Proinflammatory cytokines. Chest. 2000 Aug;118(2):503-8.
5.Kumada Y, Katoh S, Imanaka H, Imamura K, Nakanishi K. Development of a one-step ELISA method using an affinity peptide tag specific to a hydrophilic polystyrene surface. J Biotechnol. 2007 Jan 1;127(2):288-99.
6.Cui M, Cheng C, Zhang L. High-throughput proteomics: a methodological mini-review. Lab Invest. 2022 Nov;102(11):1170-1181.
7. Leng SX, McElhaney JE, Walston JD, Xie D, Fedarko NS, Kuchel GA. ELISA and multiplex technologies for cytokine measurement in inflammation and aging research. J Gerontol A Biol Sci Med Sci. 2008 Aug;63(8):879-84.