泛素化作为蛋白翻译后修饰(PTM)的方式之一,不仅参与蛋白质的降解,在调节细胞功能方面也发挥着重要作用。泛素化相关文章发表也呈逐年上升趋势,且泛素化研究成功跻身于2021国自然医学部20大热点之中。
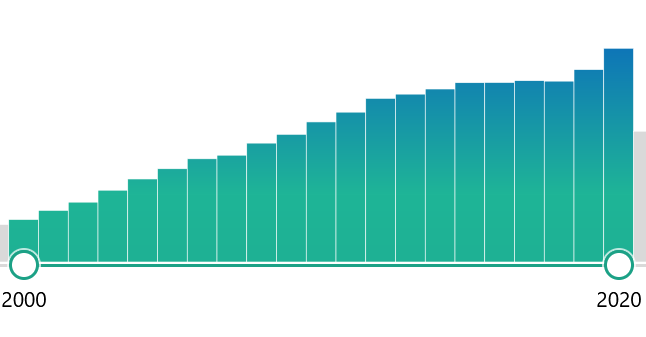
PubMed---ubiquitination
△点击放大图片
今天,小编也是阅读了大量文献,总结了泛素化的基本知识,泛素连接酶的类别,泛素化的功能,最后以2篇文献为例来阐述泛素化的功能研究。
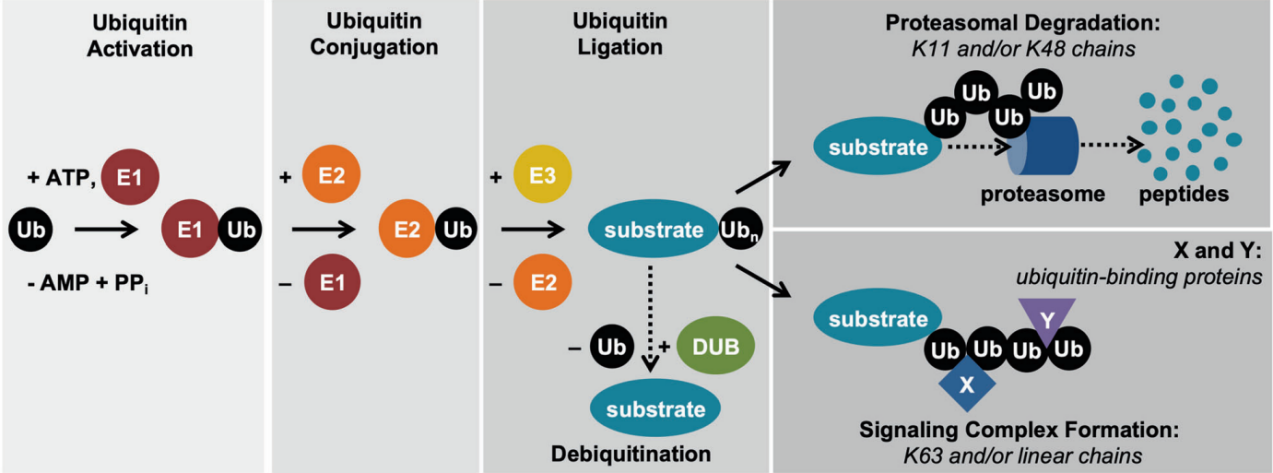
泛素(ubiquitin, Ub)是一种由 76 个氨基酸组成的分子量约8.5 kDa 的小分子蛋白质, 广泛存在于所有真核细胞中, 且序列高度保守, 从酵母到人仅相差 3 个氨基酸。泛素化是指泛素在一系列酶的催化作用下共价结合到靶蛋白的过程。泛素化过程通常需要3种泛素化酶的协同作用:E1 泛素激活酶、E2泛素结合酶和E3泛素连接酶。
Ubiquitin proteasome system
△点击放大图片
①在ATP供给能量的情况下,泛素激活酶E1将泛素分子活化;
②泛素激活酶E1将活化的泛素分子传递给泛素结合酶E2;
③泛素连接酶E3将结合E2的泛素连接到靶蛋白上。
据估计人基因组编码2种E1s、大约40种E2s和超过600种E3s。根据泛素向靶蛋白转移的具体结构域的不同,将E3s进一步分为三类: 含HECT结构域的E3s、含RING结构域的E3s以及含 U-box 结构域的E3s.
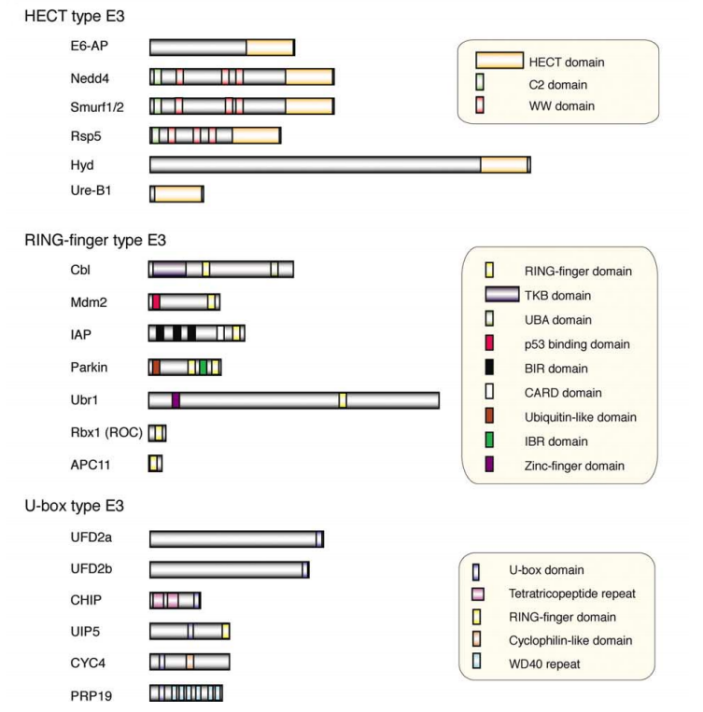
Three families of ubiquitin-protein ligases (E3s)
[Nakayama H . U-box proteins as a new family of ubiquitin ligases[J]. Biochemical and Biophysical Research Communications, 2003.]
△点击放大图片
不同的泛素连接酶E3参与形成泛素链的机制不同。所有的E3都具有连接靶蛋白和特定E2的能力。HETC结构域家族的泛素连接酶E3s是目前所知的唯一的可以和泛素形成硫酯键中间体的泛素连接酶,并且它可以直接催化靶蛋白的泛素化。RING结构域家族最典型的特点是具有环指结构域,RING结构域的氨基酸序列为: Cys-X2-Cys-X(9-39)-Cys-X(1-3)-His-X(2-3)-Cys-X2-Cys-X(4-48)-Cys-X2-Cys (X为任意氨基酸)。U-box家族的泛素连接酶E3是真核细胞蛋白质翻译后质量控制所必需的。此家族的泛素连接酶CHIP可以与Hsc/Hsp70相互作用,说明U-box结构域E3s可能通过分子伴侣发生作用来识别未折叠或者错误折叠的蛋白质,从而对蛋白质的质量控制起着重要作用。
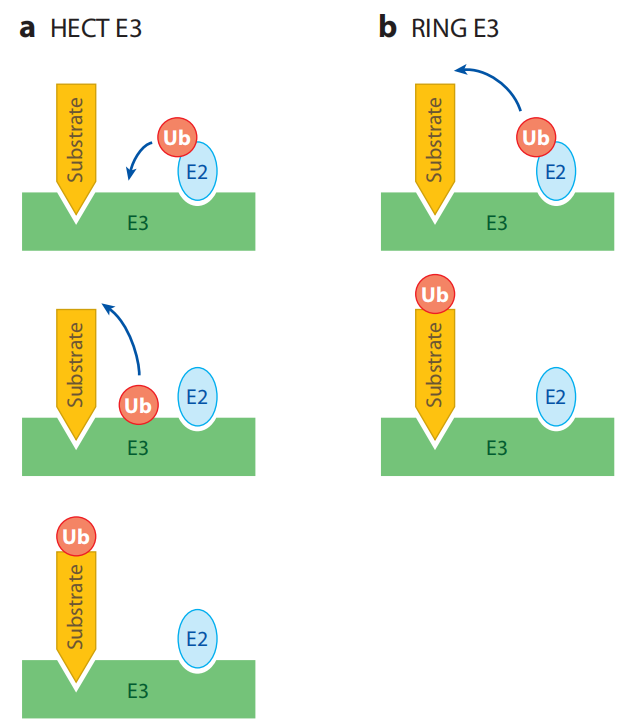
HECT and RING E3s work by different mechanisms.
[ Deshaies R J , Joazeiro C . RING domain E3 ubiquitin ligases.[J].
Annual Review of Biochemistry, 2009, 78(1):399-434.]
△点击放大图片
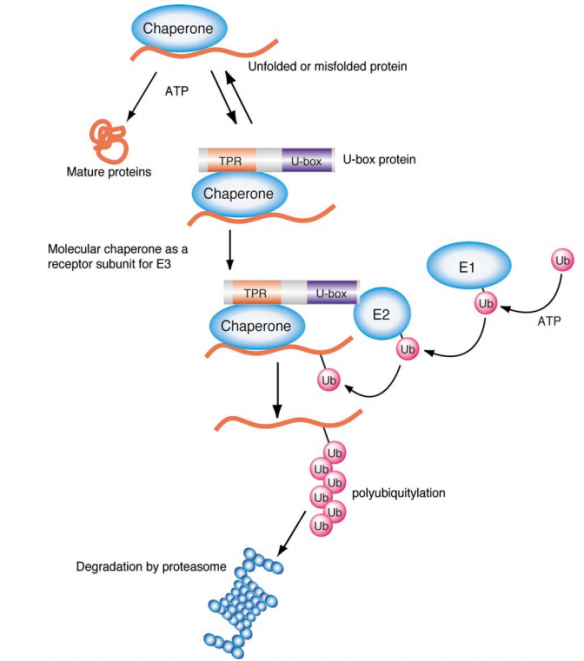
Role of U-box type E3s in the ubiquitylation of unfolded proteins.
[Nakayama H . U-box proteins as a new family of ubiquitin ligases[J]. Biochemical and Biophysical Research Communications, 2003.]
△点击放大图片
泛素化不仅参与蛋白质数量的调节,不同的泛素化链长度(单泛素化、多泛素化以及多聚泛素化)及多种多样的泛素化链类型(连接通过Met1, Lys6, Lys11, Lys27, Lys29, Lys33, Lys48 和 Lys63)在蛋白质活性、蛋白-蛋白相互作用以及蛋白质亚细胞定位中发挥极为重要的调控功能。由于泛素化的多样性与多价性,泛素化广泛参与各种生理过程, 包括细胞增殖、凋亡、自噬、内吞、DNA损伤修复以及免疫应答。
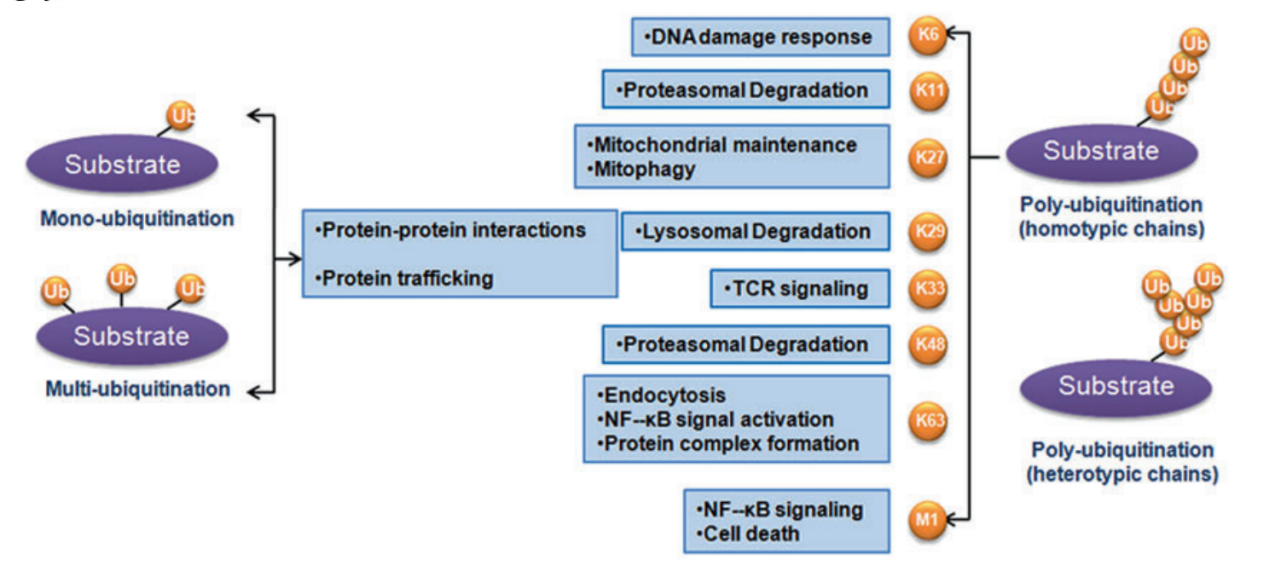
The classification of ubiquitination and corresponding biological functions
[Liu J , Cheng Y , Zheng M , et al. Targeting the ubiquitination/deubiquitination process to regulate immune checkpoint pathways[J]. 信号转导与靶向治疗(英文), 12(2):11.]
△点击放大图片
泛素化与细胞凋亡
Ubiquitination and degradation of the FADD adaptor protein regulate death receptor-mediated apoptosis and necroptosis
FADD 接头蛋白的泛素化降解调节死亡受体介导的细胞凋亡和坏死性凋亡

△点击放大图片
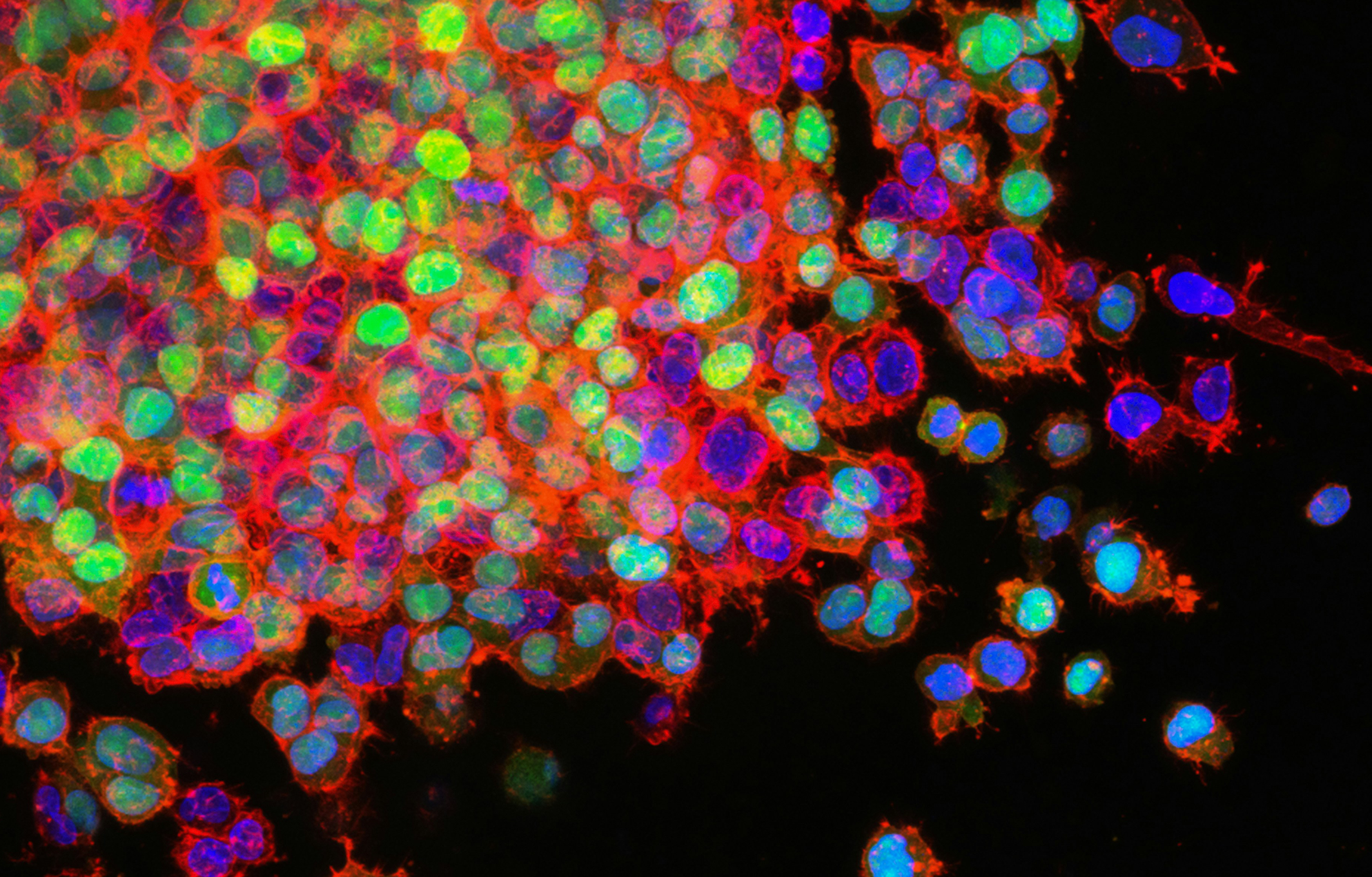
Fas 相关蛋白与死亡域 (FADD) 是死亡受体介导的外在细胞凋亡和坏死性凋亡的关键组成部分。本文表明 FADD 受 Makorin 环指蛋白 1 (MKRN1) E3 连接酶介导的泛素化和蛋白酶体降解的调节。 MKRN1 敲低导致 FADD 蛋白稳定并形成快速死亡诱导信号复合物,通过促进 caspase-8 和 caspase-3 裂解以响应死亡信号,从而导致对外在细胞凋亡的超敏反应。文章还表明 MKRN1 和 FADD 参与了 caspase 抑制后坏死体形成和坏死性凋亡的调节。在使用 MDA MB-231 乳腺癌细胞的异种移植模型中,在肿瘤坏死因子相关的凋亡诱导配体治疗后,MKRN1 的下调导致肿瘤生长的严重缺陷。同时 FADD 敲低可解除 MKRN1 耗竭对肿瘤生长的抑制。文章揭示了一种新机制:通过泛素化诱导的降解途径调节具有死亡结构域的fas相关蛋白。
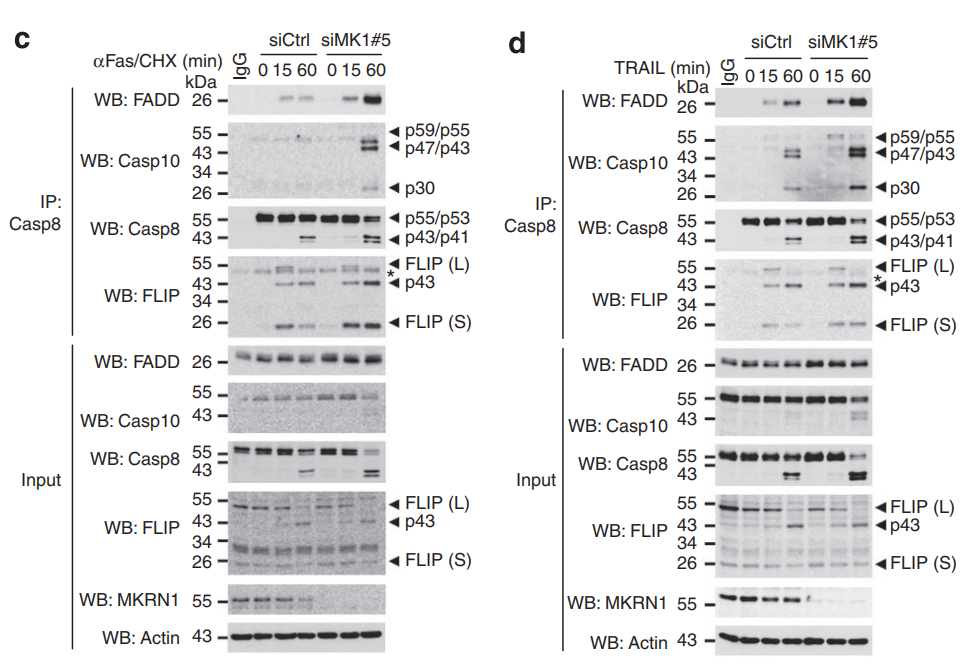
△点击放大图片
敲低MKRN1,加速了死亡诱导信号复合体(DISC)的形成,促进caspase 8介导的外源性细胞凋亡。
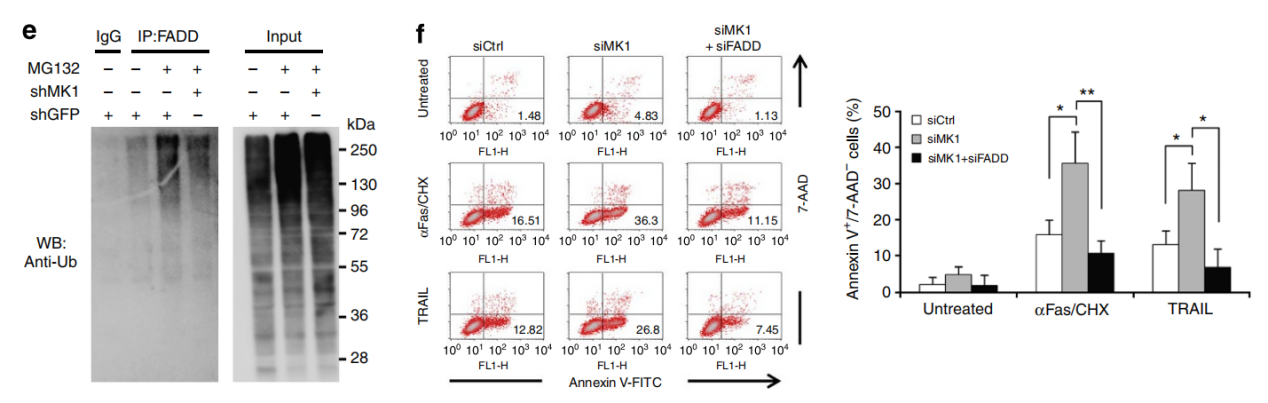
△点击放大图片
MKRN1敲低显著降低了FADD 泛素化,表明 MKRN1 介导了 FADD 泛素化。MKRN1通过介导FADD泛素化降解负调控死亡受体介导的细胞凋亡。
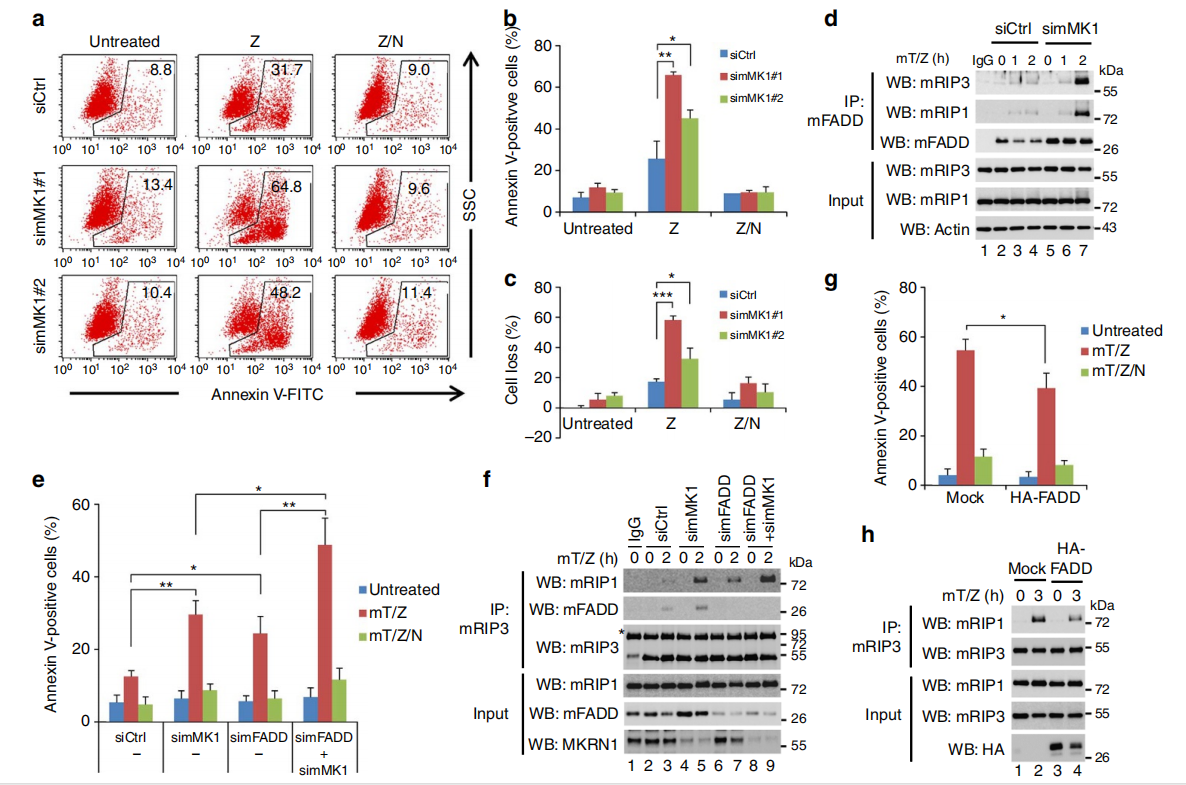
△点击放大图片
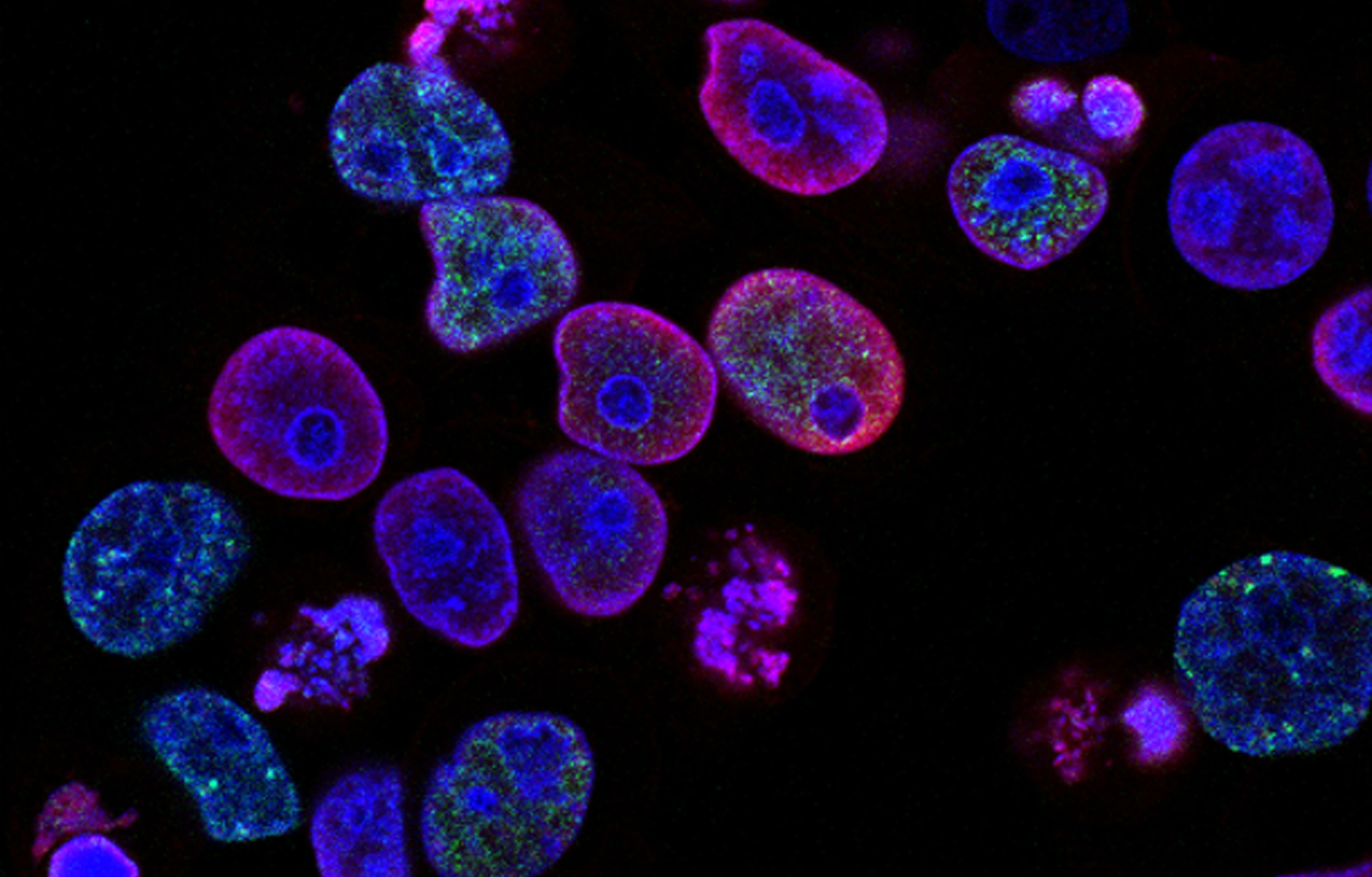
L929小鼠成纤维细胞中,敲除MKRN1显著增强坏死性细胞死亡,而nec-1可以逆转此现象。敲除MKRN1,用mTNFα 和 z-VAD-fmk处理细胞,可以发现 RIP1–RIP3–FADD复合体的形成。说明当细胞凋亡途径被抑制时,MKRN1 耗竭通过增加坏死体复合物的形成来促进坏死性凋亡。
FADD 消耗显著引起了RIP1-RIP3 复合物的增加,表明在MKRN1耗竭的细胞中,FADD敲除会进一步加强坏死性细胞死亡。即使 FADD 敲低,MKRN1 耗竭也会增加坏死体形成和坏死性凋亡,表明 MKRN1敲低以独立于FADD 的方式增强坏死性凋亡,但 MKRN1 敲低后的 FADD稳定可以延缓坏死性细胞凋亡。
泛素化与细胞自噬、细胞代谢
在哺乳动物细胞中,ULK1和PI3K-III激酶复合物是负责自噬启动和自噬小体形成的两种主要蛋白。泛素连接酶TRAF6介导k63连接泛素链的形成,在诱导自噬中起重要作用。TRAF6促进ULK1的K63 泛素化,从而增强ULK1的稳定性和功能。另外,TRAF6还催化Beclin-1 K63的泛素化。Beclin-1 泛素化发生在BH3结构域,从而阻断Beclin-1与Bcl-2相互作用,从而促进自噬反应。
与TRAF6和AMBRA1不同,泛素连接酶NEDD4和RNF216分别通过形成K11和K48泛素链,促进Beclin-1蛋白酶体降解。K63泛素化在应对应激条件或通过反馈机制加速自噬启动时促进自噬的发生,而K48-和K11-泛素化则通过降解自噬核心蛋白阻止自噬的发生。
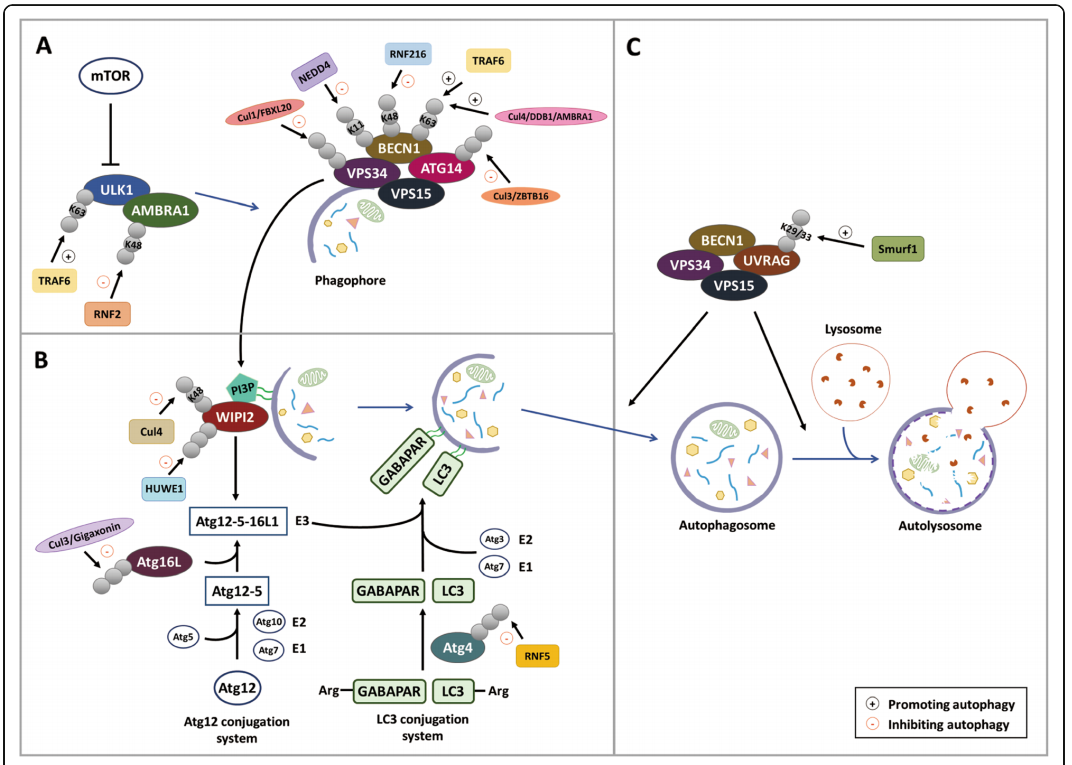
Functional roles of ubiquitin ligases in regulating autophagy
[Chen R H , Chen Y H , Huang T Y . Ubiquitin-mediated regulation of autophagy[J]. Journal of Biomedical Science, 2019, 26.]
△点击放大图片

△点击放大图片
VPS34 K29/K48 branched ubiquitination governed by UBE3C and TRABID regulates autophagy,proteostasis and liver metabolism
由UBE3C和TRABID调控的VPS34 K29/K48链泛素化调控自噬、蛋白质稳态和肝脏代谢
文章展示了泛素连接酶UBE3C和去泛素化酶TRABID相互调节VPS34的K29/ k48链泛素化,发现这种泛素化增强VPS34与蛋白酶体的结合降解,导致自噬抑制。在内质网和蛋白毒性胁迫下,UBE3C招募到吞噬体被抑制,但却加强了其与蛋白酶体的结合。这个开关削弱了UBE3C对VPS34的作用,从而提高自噬活性,以促进蛋白质稳态和细胞存活。特别是在肝脏,我们发现TRABID介导VPS34的稳定对脂质代谢至关重要,且在脂肪变性的病理发生过程中下调。本研究确定了VPS34的泛素化类型,并阐明了其在蛋白质稳定和肝脏代谢中的细胞命运和生理功能。
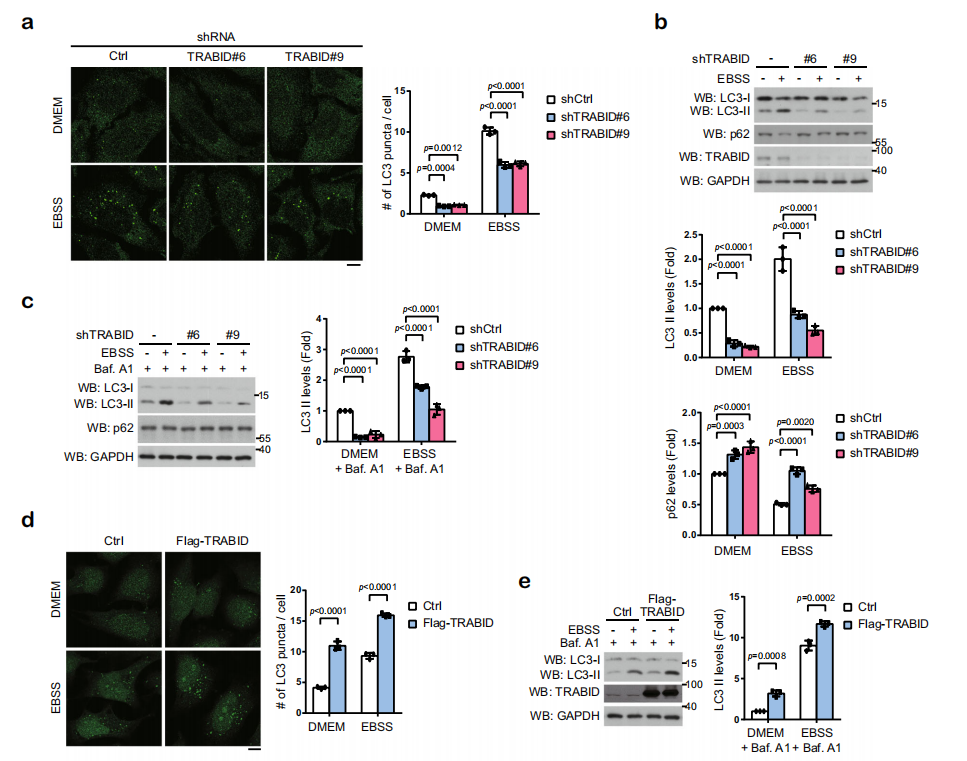
△点击放大图片
敲除TRABID,发现无论是在DMEM培养基还是在EBSS培养基中培养细胞,自噬体的形成及LC3酯化程度均减弱,但不影响P62的积累。即使用巴弗洛霉素A1阻止自噬流的发生,也会得到相同的结果。过表达TRABID,在DMEM培养基或EBSS培养基中培养细胞,或使用巴弗洛霉素A1处理,均可发现LC3的酯化程度升高。说明TRABID可以促进自噬体的形成。
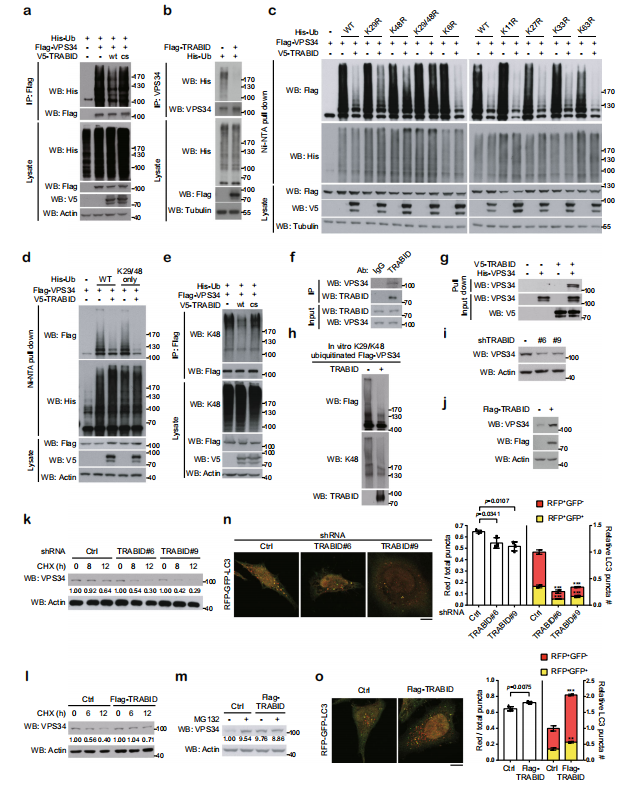
△点击放大图片
在VPS34复合物的亚基中,TRABID过表达降低了转染和内源性VPS34的泛素化水平。研究TRABID影响的泛素化类型发现,单独的K29R和K48R泛素链突变仅削弱TRABID引起的VPS34去泛素化,而 K29R/K48R双突变泛素链完全消除了TRABID引起的VPS34去泛素化作用。仅K29/48泛素链即可使TRABID诱导的VPS34去泛素化类似野生型效果。另外用K48泛素链特异性抗体证明TRABID,而非其CS突变体,可以去除VPS34的K48链接的泛素链。另外,体外实验证明TRABID通过去除VPS34的K29和K48连接的泛素化来维持VPS34蛋白稳定,以促进自噬泡的成熟。
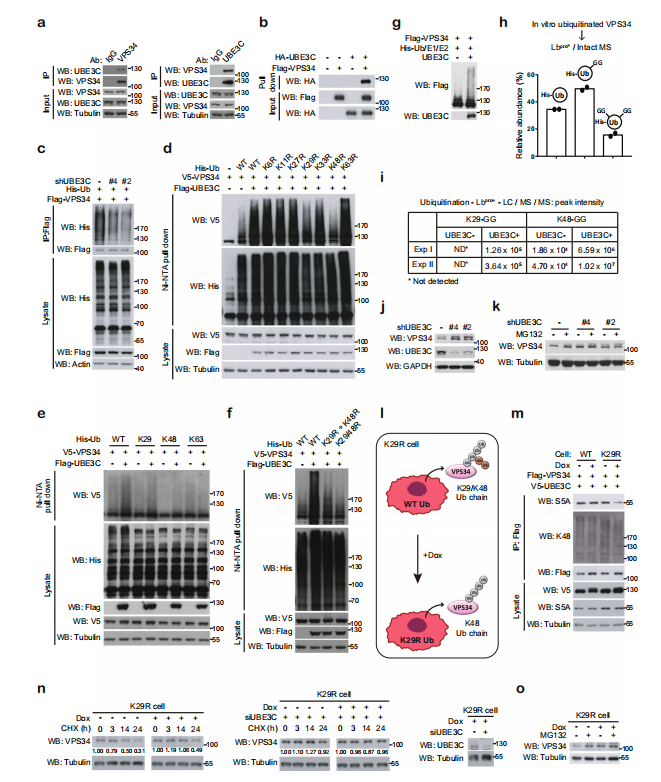
△点击放大图片
实验证明UBE3C和VPS34存在相互作用。敲除UBE3C,VPS34泛素化减弱;过表达UBE3C,VPS34泛素化增强。在对UBE3C使VPS34泛素化形成的泛素链类型研究发现,突变K29/K48泛素链,VPS34泛素化被抑制。单独的K29或K48泛素链,可以部分维持UBE3C对VPS34的泛素化作用,而K63泛素链没有此功能。双突变的K29和K48泛素链抑制了UBE3C对VPS34的泛素化作用。体内体外实验证明了UBE3C催化VPS34形成K29-或K48-泛素链。
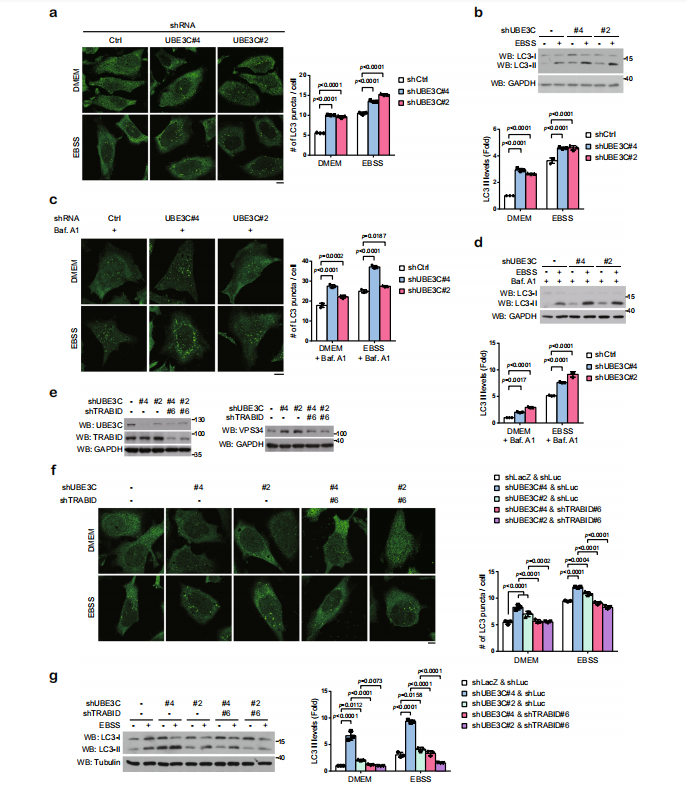
△点击放大图片
敲除UBE3C,促进VPS34的表达及LC3的酯化,说明UBE3C抑制自噬泡的形成和成熟。UBE3C和VPS34双敲除实验可以逆转此现象。说明在基础或者饥饿条件下,UBE3C和VPS34共同调节VPS34的稳定性,这对维持自噬活性的平衡非常重要。
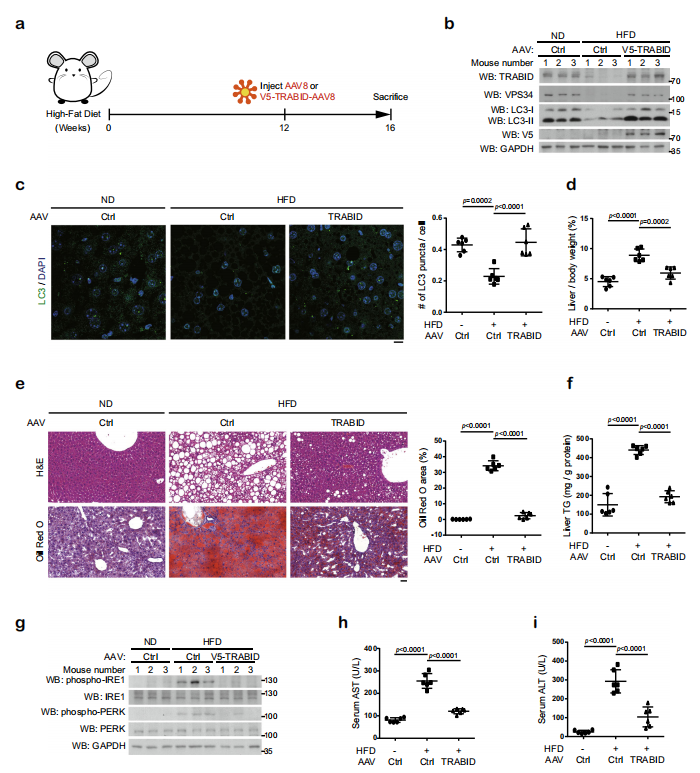
△点击放大图片
为了探索TRABID介导的VPS34在肝代谢中的作用,作者用高脂肪饮食(HFD)建立非酒精性脂肪肝(NAFLD)小鼠模型。HFD降低肝自噬活性,减少LC3酯化,且发现VPS34和TRABID表达量明显减少,说明游离脂肪酸降低TRABID的表达。rAAV-TRABID治疗4周后,VPS34表达量升高,自噬活性增强,且明显降低高脂饮食引起的体重增加。另外,通过检测肝脏中 p-IRE1和p-PERK水平,说明rAAV-TRABID可以降低HFD导致的内质网应激反应。
综上所述,本研究在关键自噬调节因子VPS34上发现了此前未被发现的K29/ k48支链泛素化,并识别了相互控制该泛素化的酶UBE3C和TRABID。阐明了这种泛素化增强的蛋白酶体降解命运,揭示了这种泛素化对内质网、蛋白质质量控制和肝脏代谢的影响。
总之,泛素对细胞的生命活动不可或缺。尽管泛素发现已有半个多世纪,与泛素相关的研究成果也层出不穷,但是由于泛素化的复杂性,人们目前的认知只是冰山一角,很多问题仍有待研究。目前,泛素连接酶E3作为泛素化传递链的最后一步,其底物仍是该领域研究的热点。由于E3和底物之间复杂的交叉作用,传统的基因敲除、RNAi等技术,很难实现更深入的研究。今年来,基于质谱的蛋白质组学发展迅速,成为了研究细胞信号转导中蛋白质的强大工具,已用于蛋白质翻译后修饰等多个领域。此技术将有助于研究细胞不同生命活动中差异显著的蛋白质的性质,如蛋白质丰度、蛋白质间相互作用、蛋白翻译后修饰等,了解这些变化的规律将有助于精确定位泛素化靶点,并针对性治疗相关疾病。
部分相关产品:
| 货号 | 品名 | 反应种属 | 实验应用 |
| abs104031-50ul | Rabbit anti-MKRN1(Center) Polyclonal Antibody | H | WB |
| 9661 | Cleaved Caspase-3 (Asp175) Antibody | WB,IP,IHC-P,IF-IC,F | H M R Mk |
| 9496 | Cleaved Caspase-8 (Asp374) (18C8) Rabbit mAb | WB | H |
| 8510 | FLIP (D16A8) Rabbit mAb | WB,IP | H M R |
| 2782 | FADD Antibody (Human Specific) | WB | H |
| 3493 | RIP (D94C12) XP® Rabbit mAb | WB,IP,IF-IC,F | H M R Hm Mk |
| 4263 | PI3 Kinase Class III (D9A5) Rabbit mAb | WB,IP | H M R Mk |
| abs104432-50ul | Rabbit anti-UBE3C (Center) Polyclonal Antibody | H | WB |
| 12741 | LC3A/B (D3U4C) XP® Rabbit mAb | WB,IHC-P,IF-IC,F | H M R |
| 3495 | Beclin-1 (D40C5) Rabbit mAb | WB,IP | H M R Mk |
| 43124 | Ubiquitin (E4I2J) Rabbit mAb | WB | H M R |
| 8081 | K48-linkage Specific Polyubiquitin (D9D5) Rabbit mAb | WB | all |
| 5621 | K63-linkage Specific Polyubiquitin (D7A11) Rabbit mAb | WB | all |
| 14482/5562 | PTMScan® Ubiquitin Remnant Motif (K-ε-GG) Kit | / | / |