近几年类器官技术发展迅速,被认为是生命科学领域最具有突破性的前沿科学技术之一,也是当下的研究热点之一。类器官作为一种成体干细胞体外培养出的3D细胞培养物,表现出显著的自我组织特性,在形态、结构、基因表达等方面与原组织具有高度同源性,打破目前了传统在体、离体模型存在的局限性,为肿瘤疾病研究、医学和新药的开发提供了全新的研究思路。
在Pubmed上搜索 “类器官” 这一词条,类器官相关文章从2010年的42篇,在短短十年间,跃升到2020年的2097篇,2021年过去四分之三,也已经达到了1815篇。类器官以极迅猛的态势成为研究热点。借助类器官,我们可以深入观察了解器官的生长发育过程,了解疾病的发生原因。同时,类器官在器官移植和药物筛选上也颇具前景。
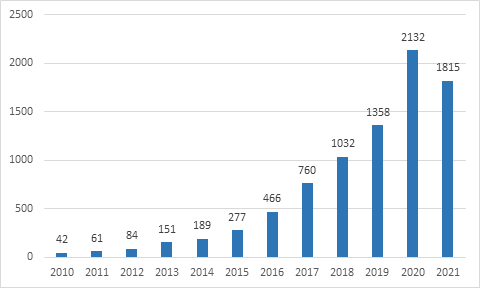
2010-2021年类器官相关文章数量柱形图
△点击放大图片
接下来小优带大家一起深度剖析一篇来自cell的文章,跟大家一起捋捋研究类器官的思路吧。
《Cardioids reveal self-organizing principles of human cardiogenesis》
人们已经成功体外培养出脑、肠道、胃、肝脏、胰腺等类器官,但是在心脏类器官领域一直进展缓慢。心脏由多层组织组成,包括许多不同类型的细胞:心肌细胞、非心肌细胞和神经元细胞,这些细胞协同工作,以确保心脏的正常运作,从而向身体的其他部位不断供应新鲜的含氧血液。它的复杂结构给心脏类器官的培养带来了困难和挑战。
研究人员发现在体外培养心脏类器官的过程中,心肌细胞往往以团块形式存在,而不会形成体内常见的组织结构,因此无法很好地构建体外模型进行心脏疾病的研究。
直到 3D 类器官技术出现后,人们才成功在体外构建出心脏类器官。本篇文章的作者Mendjan 教授的研究团队也成为了全球首个体外自组织心脏类器官模型,该模型可自发形成空腔,自主跳动,无需支架支持。同时,这种心脏类器官在受伤后可以自主动员心脏成纤维细胞迁移修复损伤。接下来我们一起看看这篇文章的研究思路吧。
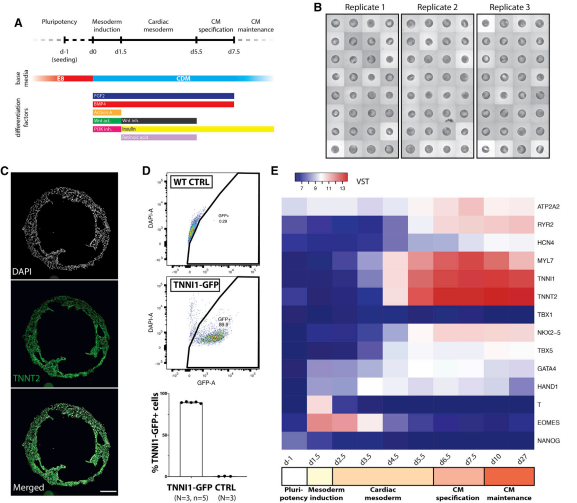
01 体外心腔样结构的形成
为了探究在体外是否可以培养出3D 室状结构,作者采用了一种基于时间控制的差异化方法,来调控心源性关键信号通路,如控制ACTIVIN、骨形态发生蛋白(BMP)、成纤维细胞生长因子 (FGF)、视黄酸 (RA) 和 WNT。在前期的研究中发现,在2D培养中 hPSC 90%以上定向为分化中胚层、心脏中胚层和跳动 CM 祖细胞(图 1A)。接下来通过添加细胞外基质补充培养基(ECM)、粘连蛋白 521/511 来筛选在 3D 心脏形成的因素。结果发现在补充了ECM之后,中胚层形成前添加521/511可以诱导细胞内部结构的形成,并成为一个空心的、跳动的3D结构。当完全在CM 呈阳性的3D结构中进行非贴壁高通量培养,结果发现外源性快速且可重复的3D结构的形成不需要 ECM添加。除此之外也通过流式以及分子的方法做了相关的实验验证了3D培养形成的结构具有心脏的相关特征。
总的来说,体外成功培养出功能性 hPSC 衍生的心腔结构模型,并具有可重复自组装和心脏的相关特征。
△点击放大图片
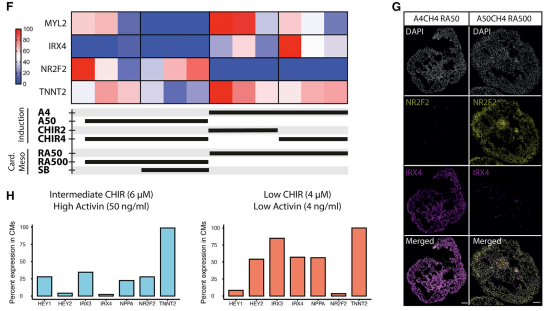
图 1. 体外心腔样结构的形成
△点击放大图片
(A) 心脏分化方案;
(B) 高通量差异化方法,显示了包含心腔的跳动结构在生成;
(C) 第 7.5 天取样冷冻切片的结果显示心腔结构具有 CM 特异性标记 TNNT2的表达;
(D) 在第 7.5天流式结果也显示了心腔结构存在TNNI1-GFP+;
(E) CM 分化过程中关键基因的表达;
(F) 取样第14天的类器官,qPCR显示在诱导阶段具有不同浓度的活化素和 CHIR99021视黄酸;
(G) 第10天的心室 (IRX4) 和心房 (NR2F2)的 CM免疫染色显示优化的左心室条件 (A4CH4 RA50) 与
非优化条件 (A50CH4 RA500);
(H) scRNA-seq结果显示中间 WNT(CH6)/高激活素 (A50)/RA500与低 WNT(CH4)/低激活素 (A4)/RA50相比具有更高的CM 百分比,更多的心房与更多的心室标志物。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| TGFb1 Recombinant Human TGF-beta 1 Protein | 240-B |
| Recombinant Human/Mouse/Rat Activin A Protein | 338-AC |
| Recombinant Human FGF basic/FGF2/bFGF (146 aa) Protein | 233-FB |
| Recombinant Human R-Spondin 1 Protein | 4645-RS |
| Cultrex UltiMatrix Reduced Growth Factor Basement Membrane Extract | BME001 |
| Cultrex Spheroid Formation Extracellular Matrix, 10X | 3500-096-01 |
| Human NKX2.5 Antibody | AF2444 |
| Human COUP-TF II/NR2F2 Antibody | PP-H7147-00 |
| Phalloidin 鬼笔环肽 | abs47047480 |
| 11-cis Retinoic Acid | abs42190117 |
| 11-cis Retinoic Acid | abs42190117 |
| LY 294002 hydrochloride | 1130 |
02 心脏中胚层在体外自组织形成腔
接下来探究内部的空腔是否由由内在的形态发生形成。通过分析不同时间点的样品,空腔在心脏中胚层(HAND1+)中形成,并有如MYL7关键心脏标志物的前期表达。腔体扩增既不是由细胞凋亡驱动,也不是由区域增殖差异驱动。重要的是,SOX17+/EOMES+ 内胚层在分化过程中不存在,表明心脏中胚层腔不是由于内胚层结构而产生的。这与体内研究结果一致。通过系列实验得出结论,心脏中胚层具有自组装成CM的腔式结构。引人注目的是,在SOX2+前肠缺失的情况下,鸡中胚层外植体在体外发育成类似于人类心脏中胚层的搏动腔状结构,证明了在条件允许的情况下的体外心源性自我形态发生(图 2B、S2G 和 S2H)。虽然诱导期的中胚层看起来是同质的,实验中观察到在心脏中胚层阶段开始时外周的F-肌动蛋白和膜结合 β-连环蛋白的信号更高。随后的空化与外围中胚层密度的增加相吻合,F-肌动蛋白、N-钙粘蛋白的积累和更高的核密度(图 2C和 2D)。相比之下,相比之下,发育结构的中心部分,即空腔首次出现的地方,外观较松散,N-钙粘蛋白和β-连环蛋白信号降低(图 2C)。通过这些实验得出人类心脏具有自组织的关键特征——持续的规范、内在的自我模式化为中胚层,以及自我形态发生以塑造空腔。

△点击放大图片
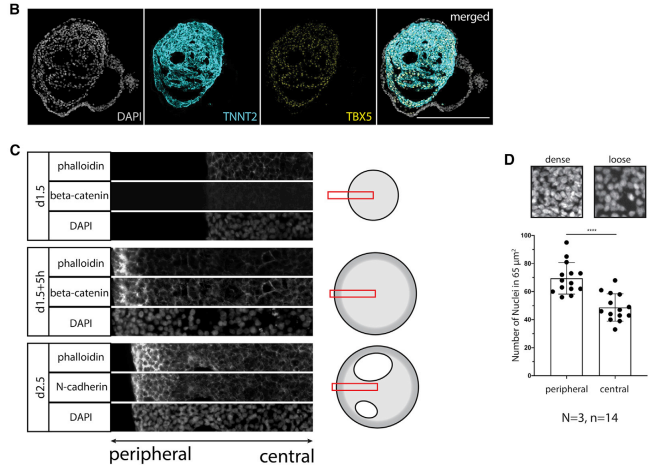
图 2. 心脏中胚层在体外自组织形成腔
△点击放大图片
(A) 不同时间点的空腔的形成分析;
(B) 在人类心脏中胚层条件下,来自鸡胚胎的心脏中胚层外植体形成带有腔的腔室状 CM 结构;
(C) 第 1.5 天和第 2.5 天之间心腔(从外围到中心)的详细图像显示通过 F-肌动蛋白(鬼笔环肽)、膜结合β-连环蛋白(PY-654-beta)的差异表达形成松散和致密的中胚层隔室 -catenin) 和 N-钙粘蛋白。
(D) 心脏中胚层中央松散,外周致密。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| N-Cadherin (D4R1H) XP® Rabbit mAb | 13116S |
| VE-Cadherin (D87F2) XP® Rabbit mAb | 2500S |
| SOX18 Antibody | NBP2-58004 |
| Human HAND1 Antibody | AF3168 |
| endo-IWR 1 | 3532 |
| SB 431542 | 1614 |
03 WNT 和 BMP 控制心脏的自我形成
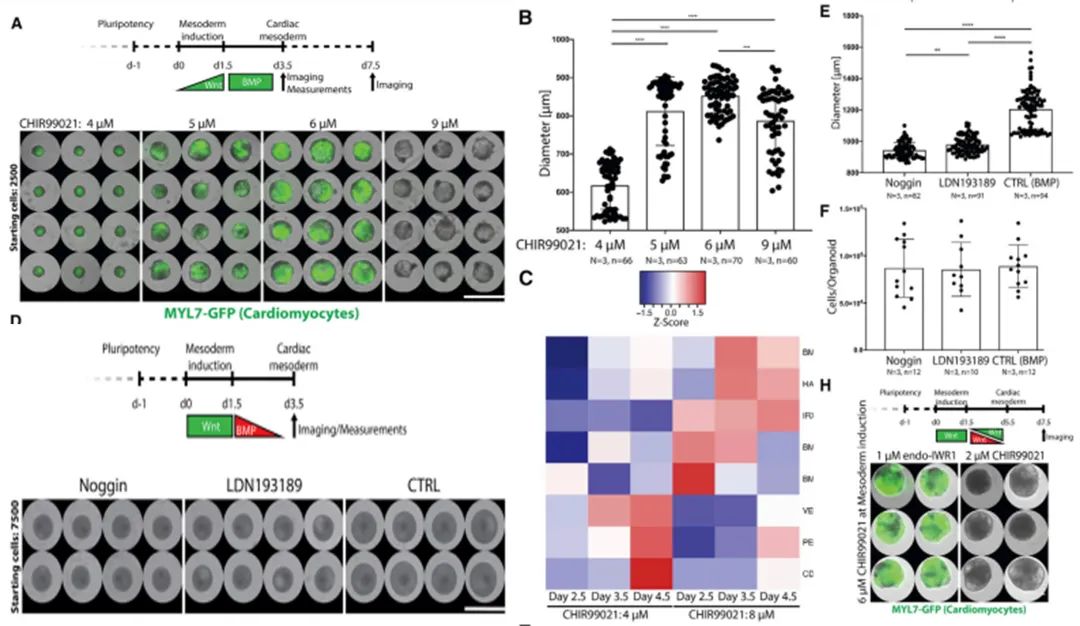
接下来通过一系列实验用形成的类器官剖析了蛋白信号如何控内在形态发生和模式化,包含中胚层形成过程中的成像分析以及不同剂量的WNT和BMP对心脏中胚层形成的影响等。结果发现,在中胚层诱导过程中更高剂量的 WNT 信号驱动了心脏中胚层后期的腔扩张(图 3A 和 3B),这在之前没有报道过。适当中等剂量的WNT 促进腔形态发生和 CM结构。重要的是,最高剂量的 WNT 促进了没有CM结构的空腔形成(图 3A),这突出了细胞分化与形态发生的信号控制存在显着差异。为了确定控制心腔形态发生的 WNT 下游介质,我们进行了 RNA-seq 分析并比较了由较高(大腔)和较低(小腔)WNT 信号剂量诱导的中胚层的基因表达谱。在晚期心脏中胚层的差异表达基因中,我们确定了 BMP 信号传导的已知心脏介质(BMP4、BMP2 和 BMPR2)及其一些中胚层靶标(HAND1 和 IRX3)(图 3C)。BMP在多个阶段驱动心脏发生,那BMP 是否可以指导模式和形态发生以形成心腔。为了分析这个问题,接下来使用天然抑制剂Noggin 或化合物LDN193189 在心脏中胚层的最初 2 天内阶段屏蔽了 BMP 信号。结果发现, BMP的抑制导致腔体形态发生受损、心脏中胚层的密度和尺寸减小,但总的细胞数保持稳定(图3D-3G)。相比之下,心脏中胚层形成阶段的 WNT对于空腔的形成不是必需的(图 3H),尽管已知它对于心脏发生是必不可少的。这些结果说明心脏的形成与形态发生的控制可能是根本不同的过程,中胚层 WNT-BMP 信号轴控制结构和形态发生——这两个关键的组织过程。
△点击放大图片
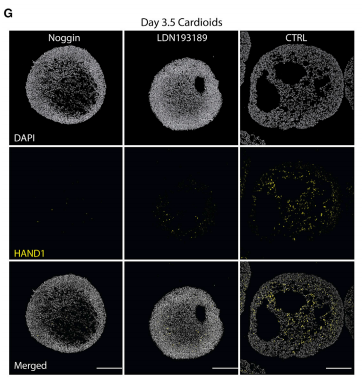
图 3.WNT 和 BMP 控制心脏的自我形成
△点击放大图片
(A) 中胚层诱导过程中 CHIR99021 的不同浓度显示出对心脏结构直径(第 3.5 天)和 CM形成(第 7.5 天)有显着影响。
(B) 在第 3.5 天的心脏结构直径。
(C) BMP 靶基因(HAND1、IRX3、BMP4、BMP2 和 BMPR2)在空腔形成过程(8 mM CHIR99201) 中上调,而 EC 基因(PECAM1、CDH5 和 VEGFA)在使用 4 mM CHIR99021 时会上调。
(D) 使用 Noggin (100 ng/mL) 或 LDN193189 (0.2 mM) 抑制 BMP可减小心脏直径。
(E) 在第 3.5 天测量心脏的直径,实验组分别是有和没有 BMP的抑制。
(F) 细胞计数的结果表明,直径减小,但细胞数量没有减少。
(G) Noggin 和 LDN193189 处理会干扰空腔扩张。
(H) 心脏中胚层形成的阶段,Wnt的激活可以抑制CM分化但不抑制心腔扩张。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| Recombinant Human BMP-4 Protein | 314-BP |
| Recombinant Human PDGF-BB Protein, CF | 220-BB |
| Recombinant Human Noggin Protein | 6057-NG |
| CHIR 99021 | 4423 |
| Human EOMES Antibody | AF6166 |
| WT1 (D8I7F) XP® Rabbit mAb | 83535S |
| CD31 (PECAM-1) (D8V9E) XP® Rabbit mAb | 77699S |
| Ki-67 (D3B5) Rabbit mAb | 9129S |
04 心脏形成需要HAND1
早就有报道显示信号通路和下游转录因子的突变会影响心管和心腔发育并导致严重人类心脏畸形,但是疾病具体病因和潜在的心脏形态发生机制尚不清楚。接下来,做了一系列实验来验证HAND1 或 NKX2-5在心脏形成过程中的影响。NKX2-5 KO之后心脏中胚层中的 HAND1 表达不受影响,这与人和小鼠 FHF 心脏中胚层中 NKX2-5相对于 HAND1 表达的延迟一致。另一方面,在 HAND1 KO 中,我们观察到心脏中胚层中数据表明 HAND1 在心脏中胚层中 NKX2-5 的上游起作用,而 NKX2-5 在 CM 中位于 HAND1 的上游。这种表型表现为较小尺寸心脏(N = 9,n = 246)形成更小的腔。(图 4B-4E)。接下来的实验分析是否可以通过外源信号因子来弥补HAND1 KO 表型。在中胚层诱导过程中增加 WNT 信号的剂量弥补了 HAND1 KO 表型,证实了WNT参与心腔形态发生(图 4F 和 4G)。综上所述,这些数据表明,可以在高通量平台中对心脏形成和遗传性心脏缺陷进行定量建模。

△点击放大图片

图 4. 心脏中胚层(第 3.5 天)形成需要 HAND1
△点击放大图片
(A) HAND1 KO 之后NKX2-5 会下调。
(B) 与 HAND1 K组相比,WT组会有更多的空腔(箭头)。
(C) HAND1 KO表现出更小空腔和数量更少的空腔。
(D) HAND1 KO组和 WT组心腔扩张直径的分析。
(E) WT组和HAND1 KO组空腔覆盖的心形区域的百分比。
(F) 直到第 3.5 天(心脏中胚层阶段)类器官形成,在中胚层诱导期间通过 CHIR99021增加的WNT信号弥补了HAND1 KO组类器官中的空腔缺陷。
(G) 心脏直径的量化表明增加WNT可以挽救空腔缺损。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| Recombinant Human/Mouse Wnt-5a Protein | 645-WN |
| Recombinant Human Wnt-11 Protein | 6179-WN |
05 WNT、ACTIVIN VEGF 协调内皮和心肌形成
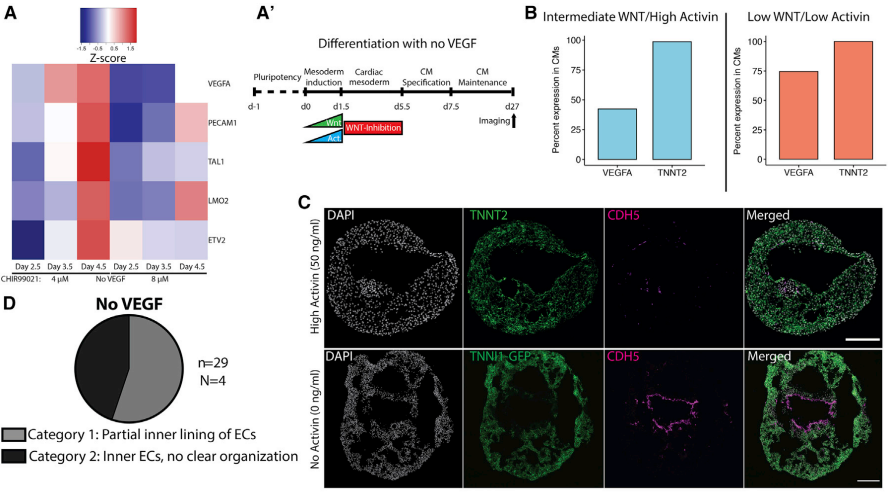
接下来实验探讨了心脏的形成相关的信号通路。实验发现,在心脏中胚层形成阶段,较低的 WNT 激活导致 VEGF-A 和其他 EC 特异性因子(ETV2、TAL1、LMO2 和 PECAM1)的上调(图 5A 和 5A’)。同时,低 WNT/低 ACTIVIN 条件诱导的心室样心脏的 scRNA-seq 分析显示,与中等 WNT/高 ACTIVIN 诱导的心脏相比,表达 VEGF-A 的CM比例更高(图 5B)。然后发现中胚层形成期间较低水平的 WNT 信号与低剂量ACTIVIN的信号相结合,诱导促进了心脏向内的后期 ECs的形成(图 5C和 5D)。这些 ECs 通常 (55.2%, N = 4, n = 29) 形成心腔的部分内衬(图 5C-5E、S5A 和 S5A0),但从未在心腔的外部。相比之下,在更高的 WNT 和 ACTIVIN 剂量条件下,从未观察到在没有外源性 VEGF添加的的情况下EC的形成(图 5C)。那多少剂量的WNT 和 ACTIVIN 信号可以诱导中胚层后期EC的形成呢,接下来的系列实验进行了探讨。结果表面这表明 VEGF 刺激了两层的早期分离,这是胚胎心脏中胚层和心管阶段的一个重要方面。然而,外源性 VEGF 不足以控制 EC 衬里的正确外部与内部方向。因此,WNT/ACTIVIN 的剂量和 VEGF 信号传导的所调控的腔形态发生和 CM 和 EC衬里的模式和体内调控相似。进一步的分析发现在不存在 WNT 抑制和存在VEGF 在心脏中胚层形成阶段,心形结构包含 ECs 和没有 CM 的 COL1A1+细胞可以重复形成(图 5G)。这些数据表明,当心脏指向性自组织产生前两个心脏谱系时,它们可用于剖析心肌和心内膜共同发育的各个方面和阶段的情况。
△点击放大图片

△点击放大图片
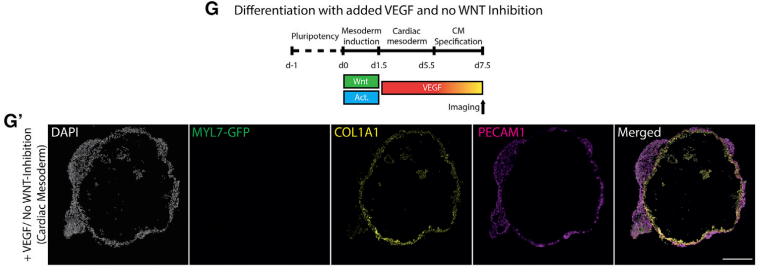
图 5. WNT、ACTIVIN 和 VEGF 协调内皮和心肌形成
△点击放大图片
(A) 与高 WNT(CHIR99021,8 mM)相比,中胚层诱导期间的低剂量的WNT(CHIR99021,4 mM)可以导致 EC 特异性基因(VEGFA、TAL1、LMO2、ETV2 和 PECAM1)更高表达。
(A’) 在没有 VEGF、低或高剂量WNT 和激活素的情况下进行分化的时间线。
(B) 与优化的心室样 CM(低 WNT [CHIR:4 mM]/低激活素 [4 ng/mL],N = 2,n = 5,097)相比,表达 VEGF中间 WNT(CHIR:6 mM)/高激活素 [50 ng/mL] 条件,N = 2,n = 1,717)的CM的百分比增加。
(C) 在无激活素条件下出现部分 EC 衬里的图像。
(D) 不同 EC的形成和衬里发的量化。
(E) 类别 1 和 2 的图像。
(F) 使用添加的VEGF和中间剂量的WNT(CHIR:6 mM)/高激活素(50 ng/mL)以及WNT抑制实验组进行分化的时间线。
(F’)FACS 数据的量化显示了心脏中CM和EC的稳定比率。
(F’’) 心形线显示出CM和EC层的分离以及一层成纤维细胞样细胞 (COL1A1+) 的出现。
(G) 使用添加的VEGF和中间剂量的WNT(CHIR:6 mM)/高激活素(50 ng/mL)以及无WNT抑制进行分化的时间线。
(G’) 当WNT在心脏中胚层形成阶段不受抑制并添加VEGF时,心脏的冷冻切片仅包含ECs和成纤维细胞样细胞而没有CMs。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| Recombinant Human VEGF 165 Protein | 293-VE |
| COL1A1 (E8F4L) XP® Rabbit mAb | 72026S |
| Recombinant Human EGF Protein, CF | 236-EG |
| IWP2 | 3533 |
06 心形中的心内膜和成纤维细胞样细胞
根据文献报道接下来研究了心脏的细胞异质性。当使用中间剂量的WNT激活和VEGF时,结果发现CMs 与 ECs 的比率稳定在 41% (MYL7+) 到 53%(CDH5+)(图 5F’)。大量 RNA-seq 数据和心脏细胞类型特异性单细胞表达用于发育中的人类心脏,进一步证实了这一观察结果。分选细胞的 Smart-seq2和用于基于体内人类心脏数据对细胞进行分类的 scRNA-seq 分析进一步证实了关键的CM和EC标记谱和 GO 项(图 6A、6D、S6D 和 S6E) ,而其余细胞 (MYL7 /CDH5) 表达与推定的EC衍生成纤维细胞样细胞相关的基因(例如 SOX9、MSX1/2、COL1A1 和 COL3A1)(图 6A)。为了确定心形中的EC特性,实验对排序的CDH5+心形EC进行了 Smart-seq2分析,并将它们与使用完善的2D分化方案生成的 EC 进行比较,结果发现2D分化方案使用与3D中类似的介质条件,来自血管类器官的EC、人脐静脉内皮细胞 (HUVEC) 和人心脏微血管内皮细胞 (HCMEC)(图 6C 和 6D)。实验发现心形衍生ECs与来自血管类器官的ECs最相似,尽管它们有时间差异(第 7.5 天与第 18 天)。重要的是,来自心脏的EC显示增加了心脏的转录水平转录因子,如 GATA4/5 和相关基因具有心内膜样特征(NFATC1,NPR3)(图 6D)。总体而言,这些结果表明3D中CMs和ECs的形成触发了心内膜识别和内皮细胞的重要方面生理。
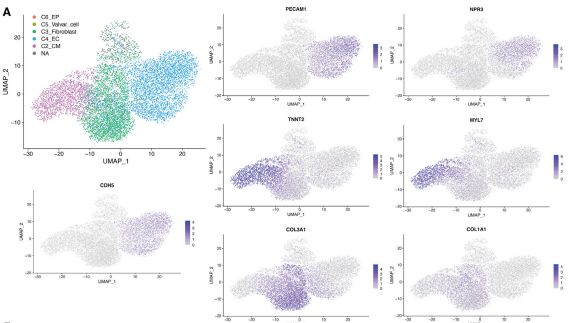
△点击放大图片
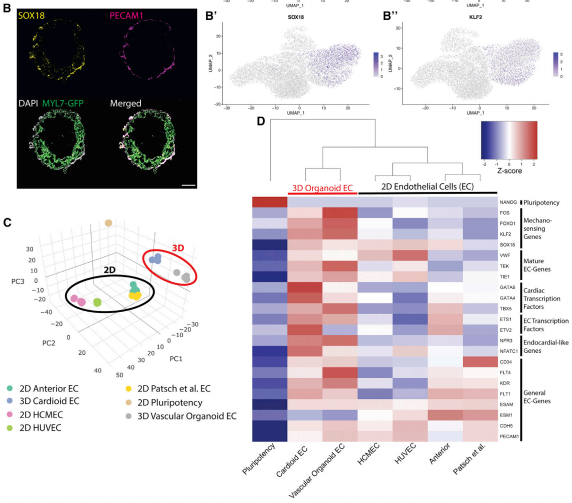
图 6. 心形细胞对 VEGF治疗的细胞特性
△点击放大图片
(A) 基于文献报道确定的标记物对补充VEGF的心形指向性细胞进行分类。
(B–B’) 心脏EC表达机械感应基因(如 KLF2、SOX18)。
(C) 2D衍生的ECs、hPSCs 和来自心形(第 7.5 天,中间WNT剂量)和血管的3D衍生ECs的PCA类器官(第 18 天)。
(D) 机械感应和成熟基因、心脏转录因子、EC转录因子、心内膜样和一般EC基因在FACS分选的EC中的表达。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| Human SOX17 Antibody | AF1924 |
| Human/Mouse/Rat SOX2 Antibody | AF2018 |
| SOX18 Antibody | NBP2-58004 |
07 3D类器官作为发育损伤模型
为了模拟心脏的这种形成过程,实验开发了一种基于已知的信号序列来指定脊椎动物和 hPSC 中的前外膜器官与心形指向相兼容的心外膜分化方案(图7A)。为了分析是否是心脏这些信号因子的内源性表达刺激心外膜/心型的相互作用,接下来在不含外源性 TGF-b、FGF 和 PDGF培养基中将心形指向性与心外膜聚集体共培养。在2-7天内,我们观察到心脏上方的心外膜细胞扩散。7天后,没有额外的生长因子添加,心外膜细胞与 CM 层相互作用,迁移到其中,并进行分化(图7B-7D)。迁移细胞下调心外膜 WT1 并上调 SMC 和 CF 标志物 ACTA2(图7D)和 COL1A1(图7C),和在体内发生的一样。引人注目的是,一些迁移的心外膜衍生细胞开始与心形 EC 相互作用(图7B和7D)。通过一系列实验,最后得出在没有外部信号的情况下,共培养会触发心外膜在心脏的内在扩散,其向内迁移、分化以及与CM和EC的相互作用。为了测试3D模型作为发育损伤模型的潜力,实验在单系(仅包含 CM)和三系(包含 CM)(图 7G 和 7F)、EC(图 7H、7I)中进行了冷冻损伤或心外膜(图 7E 和 7G)和相关的成纤维细胞样细胞。损伤部位的特征是强烈、紧密的DAPI信号、通过TUNEL染色检测到的严重坏死、有限的细胞凋亡和没有明确的CM增殖反应。在时间过程实验中,我们在损伤部位观察到三铬染色,表明局部ECM积累(图7G)。在相比之下,在三系心形指向中,我们观察 COL1A1+成纤维细胞对损伤部位的显着趋向性和强烈的纤连蛋白积累(图7E和7G)。总之,实验表明实验室建立了一个高通量的人类具有内在自组织能力的心脏和3D结构,让人想起早期人左心室心室。实验还表明,该3D结构可用于模拟三种主要心脏谱系发育的潜在机制,包括腔形成和损伤反应。
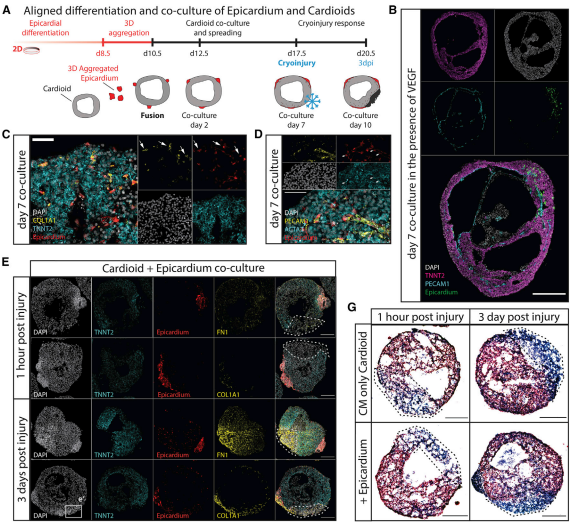
△点击放大图片
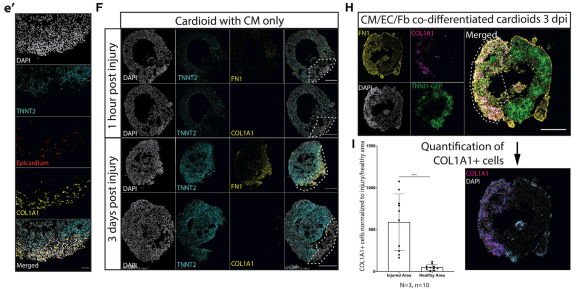
图 7. 心外膜和心内膜衍生的成纤维细胞对心型的冷冻损伤有反应
△点击放大图片
(A) 心外膜共培养和冷冻损伤示意图。
(B) 在 100 ng/mL VEGF-A存在下,与心脏结构 (TNNT2+) 共培养7天后荧光标记的心外膜衍生物的共聚焦图像,包括 EC (PECAM1+) 衬里。
(C 和 D)COL1A1+ (C) 和 ACTA2+ (D) 心外膜衍生物与包含 ECs (PECAM1+) 的心脏结构共培养 7天后的共聚焦图像。
(E 和 F) 在存在 (E) 或不存在 (F) 心外膜的情况下,冷冻损伤反应(损伤后 1小时和3天)染色纤连蛋白 (FN1) 和 COL1A1+ 细胞的共聚焦图像。
(G) 受伤后1小时和3天,在存在或不存在心外膜的情况下,冷冻损伤的心脏结构的Masson 三色染色(蓝色,结缔组织;红色,肌肉)。
(H) CM+EC+成纤维细胞共分化心形在损伤后3天的共聚焦图像标记FN1和COL1A1+细胞。
(I) 损伤后3天,共分化 CM+EC+成纤维细胞心形的受伤(紫色)与健康(蓝色)区域中 COL1A1+ 细胞的定量。COL1A1+ 细胞的数量被归一化为损伤面积/总面积。虚线标记数字中的受伤区域。
本步骤中涉及到的产品如下:
| 产品名称 | 货号 |
| TUNEL Assay Apoptosis Detection Kit(FITC) | abs50033 |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | 9664S |