人体对温度的感知能力对我们生存至关重要,是我们感知世界并与之互动的重要方式。天气渐渐转凉,小伙伴们是不是也开始穿上长袖长裤了呢?改变自身适应环境看起来好像是一个理所当然的行为,但是我们的机体又是怎样去感知到温度的呢?
上周小优为您带来了2021年诺贝尔生理学或医学奖获得者David Julius教授对温度和疼痛感受的离子通道蛋白TRPV1和TRPM8的研究,以及Ardem Patapoutian教授对机械压力感受的离子通道蛋白Piezo1和Piezo2的研究介绍。
看完这篇文章相信大家肯定对这两个教授的工作有了一个全面的了解。今天小优在David Julius教授关于TRPV1的研究文章中,选择了一篇非常有代表性的文章和大家继续探讨,来看一看大牛是怎样研究离子通道蛋白的。
随着David Julius对TRPV1以及其家族的研究,开启了人类对温度感应区域的涉足。通过分析辣椒素如何引起灼烧感,Julius发现了一个能够对辣椒素反应的离子通道蛋白,这个辣椒素受体被命名为TRPV1。
TRPV1的发现是一项重大突破,为发现其他温度感应受体通道蛋白开辟了道路。Julius围绕着TRPV1做了很多研究,也陆续发现了TRPM8等其他和温度感应相关的TRP家族蛋白。如此开创性与系统性的研究工作,也使他获得了2021年诺贝尔生理学或医学奖。

TRP家族温度和疼痛传导
△点击放大图片
今天小优为大家带来的是Julius其中一篇发表在“Neuron”上面关于TRPV1的研究,实验设计非常精妙和有趣,我们一起来目睹大师的风采吧。
文章题目:《TRPV1通道具有热敏性并可以被磷酸肌醇脂质负调节》

△点击放大图片
01 TRPV1在人造细胞膜中的功能重构
为了在一个明确的重组模型中研究TRPV1,作者使用MBP标签在Sf9昆虫细胞中构建并表达TRPV1,并用活细胞钙成像和全细胞膜片钳进行检测(Fig. 1A-C)。使用这个模型,作者可以获得可溶,均一的蛋白的生化性质,并通过Superose 6凝胶过滤层析进行检测(Fig. 1D)。
为了检测纯化出来的通道蛋白的功能,作者构建了MBP-TRPV1蛋白模型到大豆脂质提取物中。使用MBP标签可以保持蛋白的稳定性,避免蛋白质降解。作者使用电生理的方法对重组蛋白进行检测。Capsaicin可以引起大的,外向整合性的电流,并且可以被TRPV1典型的拮抗剂Capsazepine抑制(Fig. 2A and B)。作者用包含KcsA(对照通路蛋白)的脂质体做对照,发现Capsaicin不能引发电流。
类似的结果表明激动剂 resiniferatoxin(rtx)和2-aminophenylborate (2-APB)也可以激活TRPV1(Fig. 2C)。质子也可以激活TRPV1,但是不像capsaicin和其他的亲脂性配基,应用在通道胞外表面的质子结合位点才会有作用。
有趣的是,作者发现酸化的灌流液不能引起离体脂质体的反应,但是酸化的电极液可以引起大的,capsazepine可抑制的电流(Fig. 2C and D)。当使用DkTx spider toxin peptide时也获得了相同的结果,蜘蛛毒素肽也被认为时在胞膜外表面激活TRPV1(Fig. 2E)。这些TRPV1激活剂引起的外向整流性电流表明是通道蛋白的固有属性,不涉及到其他的细胞因子。
综上结果表明,纯化的TRPV1通道模型保持了天然受体的生化特性,并且重组到脂质体中也可以有效观察到外整流电压关系。

△点击放大图片

△点击放大图片

△点击放大图片

△点击放大图片
部分相关产品(更多请联系优宁维)
| 货号 | 名称 | 备注 |
| 17524802 | HisTrap HP | His标签纯化柱 |
| 17526801 | Ni Sepharose HP | His标签填料 |
| 17531801 | Ni Sepharose FF | His标签填料 |
| 28918780 | MBPTrap HP | MBP标签纯化柱 |
| 28935597 | Dextrin Sepharose HP | MBP标签填料 |
| 29148721 | Superdex 75 Increase 10/300 GL | 凝胶过滤层析柱 |
| 28990944 | Superdex 200 Increase 10/300 GL | 凝胶过滤层析柱 |
| 29091596 | Superose 6 Increase 10/300 GL | 凝胶过滤层析柱 |
| SH30278.02 | SFX-Insect | 昆虫培养基 |
| abs47000726 | Capsaicin | / |
| 0464/10 | Capsazepine | / |
| abs42026582 | Resiniferatoxin | / |
02 TRPV1是固有的热敏感性
接下来作者继续研究重组的TRPV1通道是否能被热激活。离体的脂质体显示了强烈的,外整流热诱发电流,热激活极限值是41.5±1.1℃ ,并且具有温度依赖(Fig. 3A-C)。热诱发反应可以被Capsazepine破坏(Fig. 3D)。有趣的是,这些数据并不会随着诱发电流改变,表明温度觉阈值并不依赖于存在于系统中的通道数目。
温度激活下,TRPV1快速的转换到开启状态,其中涉及到大量的构象运动。在快速的激活过程中,焓和熵都有大量的改变。为了发现是否TRPV1通道在脂质体和细胞膜中都具有相同的热激活速率和动力学,作者使用红外激光二极管系统来对脂质体传递快速的温度跳跃并检测诱发电流(Fig.3E and F)。热诱发反应表明脂质体检测到的热激发阈值(42.5 ± 0.16°C),激发动力学(τ = 3.5 ± 0.3 ms)和焓和熵的改变(ΔH = 86.2 ± 3.9 kcal/mol and ΔS = 249.2 ± 12.2 cal/mol·K, respectively)都和TRPV1表达的哺乳细胞(HEK293)检测到的相同。
综上结果表明,纯化的TRPV1蛋白具有固有的热敏性和基本的热响应属性。

△点击放大图片

△点击放大图片
03 脂质代谢的调节
大量炎症因子会增强TRPV1对热的敏感性,因此产生热痛觉应对组织损伤。对于某些因子的敏化作用可以被直接的离子通道变构明显调节,而另外一些通过激活代谢性受体和下游的第二信使信号通路起作用。
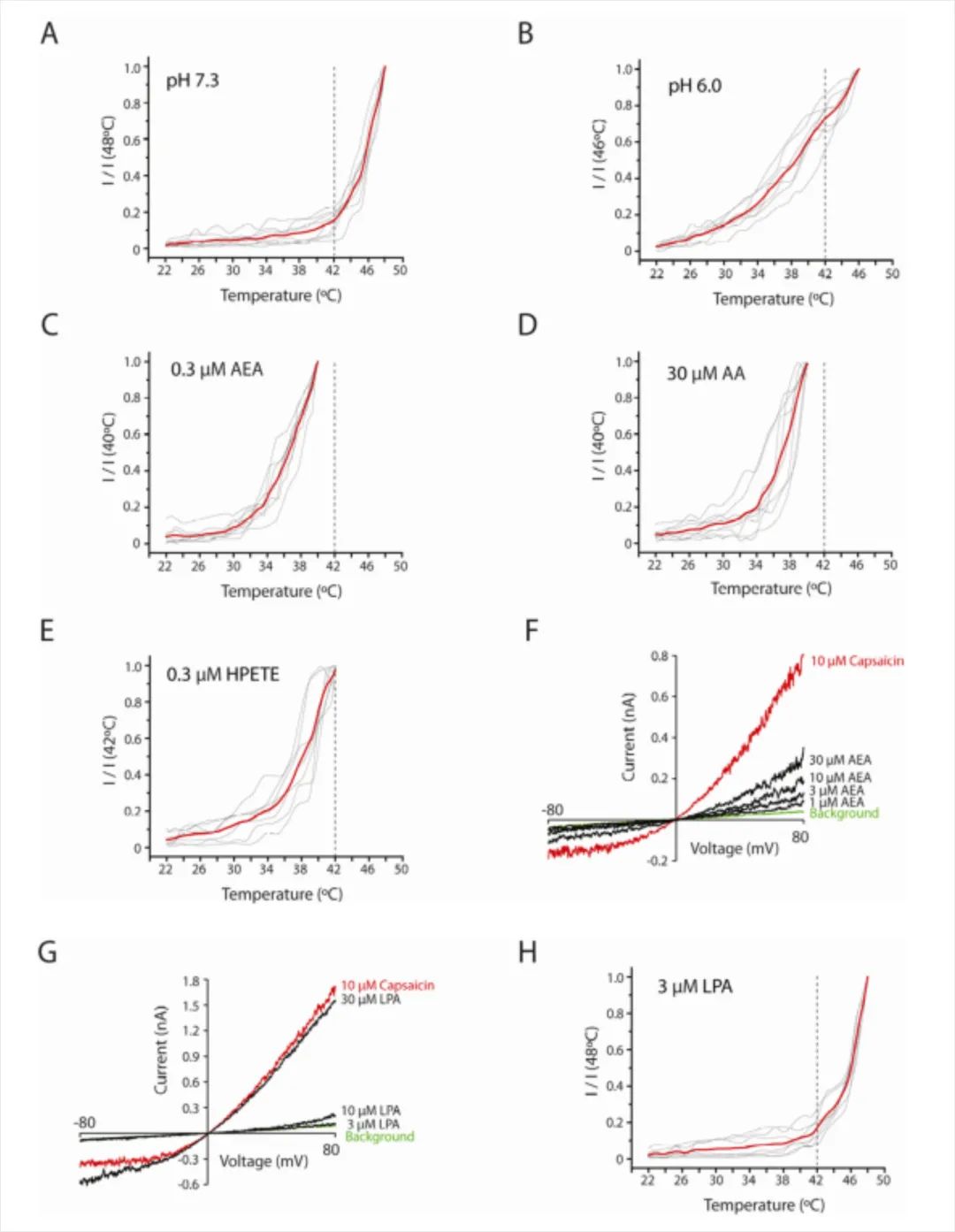
作者接下来使用重构脂质模型检测在其他细胞蛋白或者第二信使不存在的情况下,这些因子是否可以直接激活TRPV1。结果表明,一些生物活性的脂质,例如anandamide(AEA), arachidonic acid(AA)和12-HPETE也会引起明显的热敏,甚至在低于通道激活所需的浓度时(Fig. 4C-F)。
相反,diacylglycerol(DAG)和leukotriene B4不能激活或者敏化TRPV1。lysophosphatidic acid (LPA) 可以在室温激活TRPV1,产生和Capsaicin引起的同等级的电流,然而anandamide, arachidonate或者HPETE,亚剂量的LPA都不能引起TRPV1对热的敏化反应,表明LPA是一个有效的通道激活剂,但是是一个弱的别构调节剂,可能表明TRPV1上不同位点对应着不同的脂质第二信使(Fig. 4G and 4H)。
综上结果表明,这些促进疼痛的生物活性脂质可以作为通道的直接激活剂或者变构调节剂。
△点击放大图片

△点击放大图片
部分相关产品(更多请联系优宁维)
| 货号 | 名称 | 规格 |
| 663647 | Anandamide | 1mg |
| abs42020942 | Lysophosphatidic Acid | 5mg |
| abs44103153 | Arachidonic Acid | 20mg |
| abs42000322 | 12-HpETE | 25ug |
| abs42020826 | LTB4 (Leukotriene B4) | 50ug |
04 磷酸肌醇脂质对TRPV1负调节
TRPV1和磷酸肌醇是否存在相互作用,以及这个相互作用是否会促进或者抑制通道一直存在争议,作者使用重构的TRPV1蛋白模型进行验证。大约有7%的大豆提取物的磷脂还是未知成分。
因此,作者首先改造了脂质模型使它只含有确定的成分,包括1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine,-phosphoethanolamine, 和–phosphor-(1′-rac-glycerol)(POPC, POPE, and POPG), sphingomyelin, and cholesterol。纯化的TRPV1重构进这个缺少磷酸肌醇的脂质模型中,强烈的外整流电流可以被Capsaicin和热引发,表明刺激物作用于通道本身,而并不依赖于PIP2或者其他磷酸肌醇(Fig. 5A and B)。
接下来,作者继续研究添加特定的磷脂到这个脂质模型中会不会改变化学或者热阈值。实验发现增加PI,PIP2或者PI4P可以降低Capsaicin的热敏性,而PI和PI4P具有最大的效应(Fig. 5C)。有趣的是,等效水平的PIP3不会改变Capsaicin的热敏性,这表明磷酸肌醇种类作用的特异性。
综上结果表明,一些磷酸肌醇种类,例如PIP2,通过降低TRPV1对化学或者热刺激的敏感性来抑制TRPV1作用。

△点击放大图片

△点击放大图片
05 C末端脂质相互作用调节通道敏感性
作者通过之前的研究猜测TRPV1的赖氨酸/精氨酸富集的C末端和带负电的磷脂头部基团相互作用,从而抑制通道的激活。PLC介导的PIP2水解通过减少相互作用从而激活通道。作者接下来通过脂质模型来对这个猜想进行验证。
首先,作者验证截短TRPV1蛋白模型的C末端PIP2相互作用结构域会不会影响磷酸肌醇调节。结果发现,脂质模型并没有展现出PI介导的热敏性(Fig. 6A)。
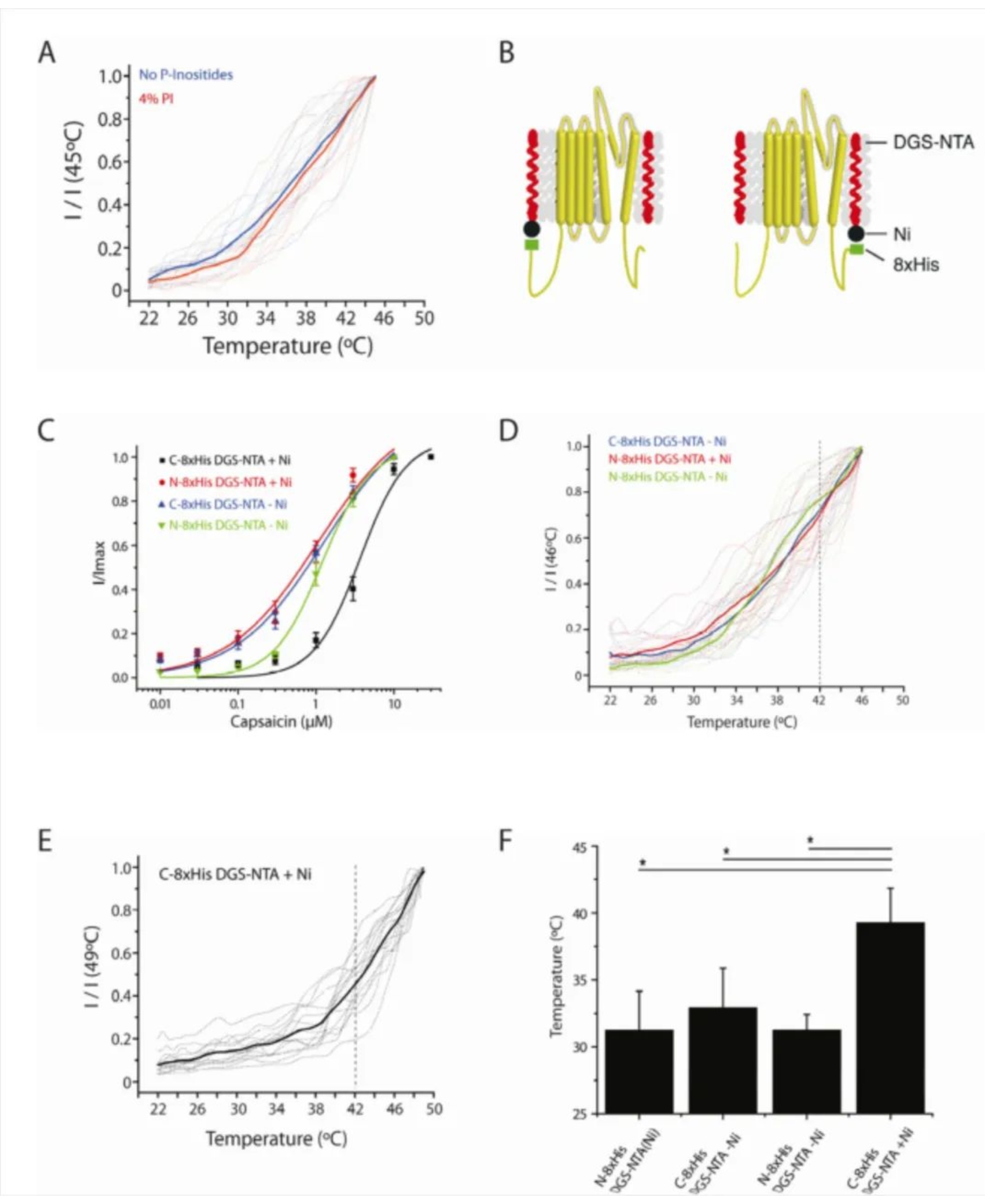
然后,作者验证当C末端结构域重新添加后,PI的调节是否可以被修复。作者设计了一个带有8X His标签的C末端结构域。这个C末端结构域被表达,纯化和重构到脂质模型中。此外作者还构建了一个NTA修饰的脂质(DGS-NTA),它的头部基团可以Ni依赖性的和His标签相互作用。
作者发现,在脂质模型添加了C端结构域,PI和DGS-NTA之后,脂质模型对于Capsaicin的作用呈现Ni依赖性。作为对照,作者在N端做了同样的实验发现没有Capsaicin的致敏性(Fig. 6B and C)。同样结果显示,热激活的作用也呈现Ni依赖性(Fig. 6D-F)。
综上结果表明,TRPV1的C末端结构域和膜脂有直接的功能性的相互作用,并且会调节通道对化学和热刺激的敏感性。
△点击放大图片

△点击放大图片
全文总结,作者通过在重构的脂质中加入表达和纯化的TRPV1蛋白,在宏观的水平对通道进行分析。
在这个模型中,重构的通道展现了在缺少任何磷酸肌醇存在的情况下固有的热和化学敏感性。而添加PIP2会引起通道化学和热敏性降低,表明PIP2和其他的磷酸肌醇对TRPV1功能的负调节作用。而PIP3不会抑制TRPV1,推测可能促疼痛因子,例如神经生长因子,激活受体酪氨酸激酶,可以通过PLC或者PI3激酶介导通路激活TRPV1。
此外,作者还验证了TRPV1 C末端的胞质尾区和膜脂质具有相互作用,从而改变通道对化学和热刺激的敏感性。

△点击放大图片