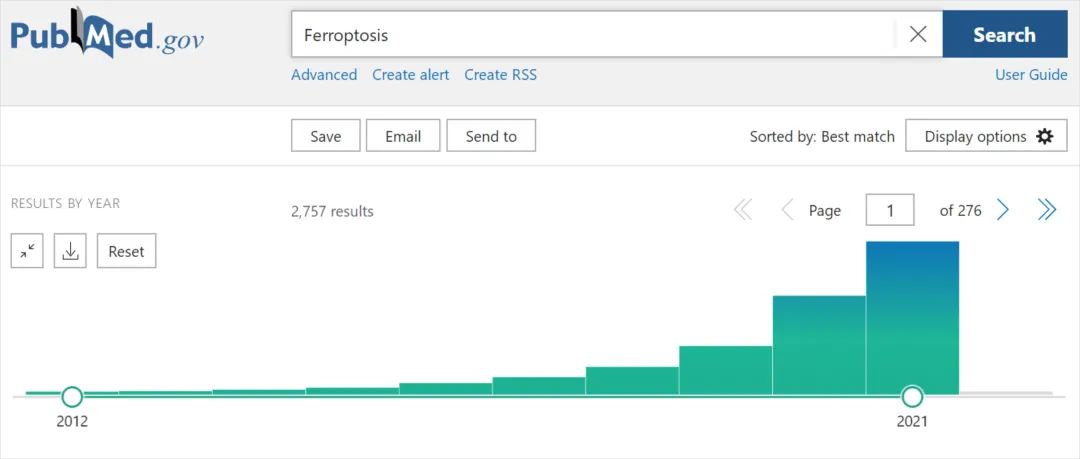
自2012年该名词被创造以来,在过去的几年里,铁死亡的研究领域经历了指数级的增长。
这种由铁依赖性磷脂过氧化作用驱动的独特的细胞死亡方式受多种细胞代谢途径的调节,包括氧化还原稳态、铁代谢、线粒体活性和氨基酸、脂质和糖的代谢,以及与疾病相关的各种信号通路。
△点击放大图片
在近3000篇文献里,我们如果仔细查阅,是可以学到很多很多东西的。还记得吗?之前小优关于铁死亡是写过2篇文章的:
一篇是P53和能量胁迫对铁死亡的影响研究属于技术研究型;
另一篇是53分的铁死亡综述,对其机制与疾病等方面都有全面提及;
在了解到大家对铁死亡领域如此关注,小优也是绞尽脑汁,想写些新花样。于是小优也是做了一些梳理,今天以几篇有代表性意义的文献为例,把铁死亡的整个研究历程分为“发现”、“机制研究”、“疾病应用”3个方面,来看看铁死亡的“前世今生”。
01 铁死亡的发现
虽然铁死亡这个术语是2012年才被提出来的,但它的一些方面或特殊形式很久以前就已经被观察到了,尤其是到了近代,一些铁死亡诱导剂的不断发现,才让这种独特的细胞死亡方式进入大众眼帘。最有代表性的当属在2003年首次被鉴定为铁死亡诱导剂的erastin。

△点击放大图片
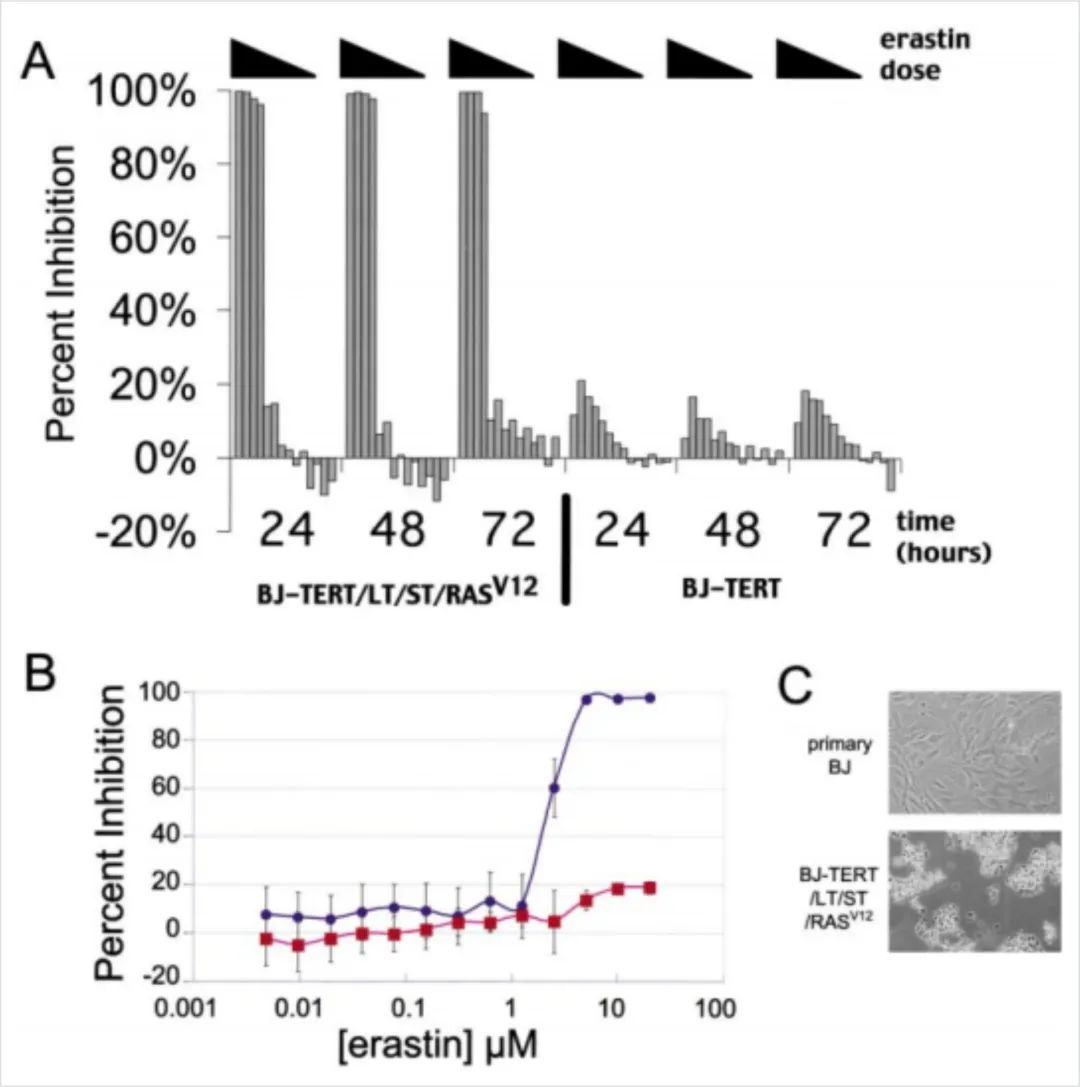
图1:Erastin以ST/ RASv12依赖的方式诱导细胞快速死亡
△点击放大图片
(A) erastin对BJ-TERT和BJ-TERT/LT/ST/RASV12细胞的时间依赖性作用。
(B) erastin对BJ-TERT(红色)和BJ-TERT/LT/ST/RASV12(蓝色)细胞Alamar Blue染色的影响。
(C) BJ-TERT /LT/ST/RASV12和BJ原代细胞经erastin处理后的照片。
结论:鉴定的一种新化合物erastin,它仅对表达ST和RASV12的细胞是致命的,并且有一定程度的特异性。erastin的致死作用一旦发生,是迅速和不可逆的。
在这之后,不断的有铁死亡诱导剂被发现,并且具体的靶标也被研究透彻,下表只是展示了一部分:

图2:影响铁死亡的小分子或药物
△点击放大图片
在对诱导剂进行如火如荼的研究同时,科学家也发现了一些与众不同的细胞形态学特征。在发生铁死亡的BJeLR细胞中,线粒体比正常线粒体小,线粒体膜密度增加,线粒体嵴减少/消失,癌细胞未见核浓缩或染色质边缘化。这些特征有助于我们与其他细胞死亡方式如凋亡、自噬等区分开。
意义:到此,我们的铁死亡研究进入了懵懵懂懂阶段。发现了一些物质可以导致细胞以未知的方式死亡,并且也能观察到这种死亡过程中的独特形态学变化,但是并不清楚在这种死亡方式中的“关键人物”,对其缺乏机理的认知。
02 铁死亡的机制研究
接下来就到了2012年,一篇CELL文章是铁死亡最早的文献报道,这里正式提出了“铁死亡”这个名词。

△点击放大图片
作者在针对RAS突变基因的药物筛选中找到了两个药物erastin和RSL3,探寻这两种药物作用机制以及对RAS基因突变的治疗效果。
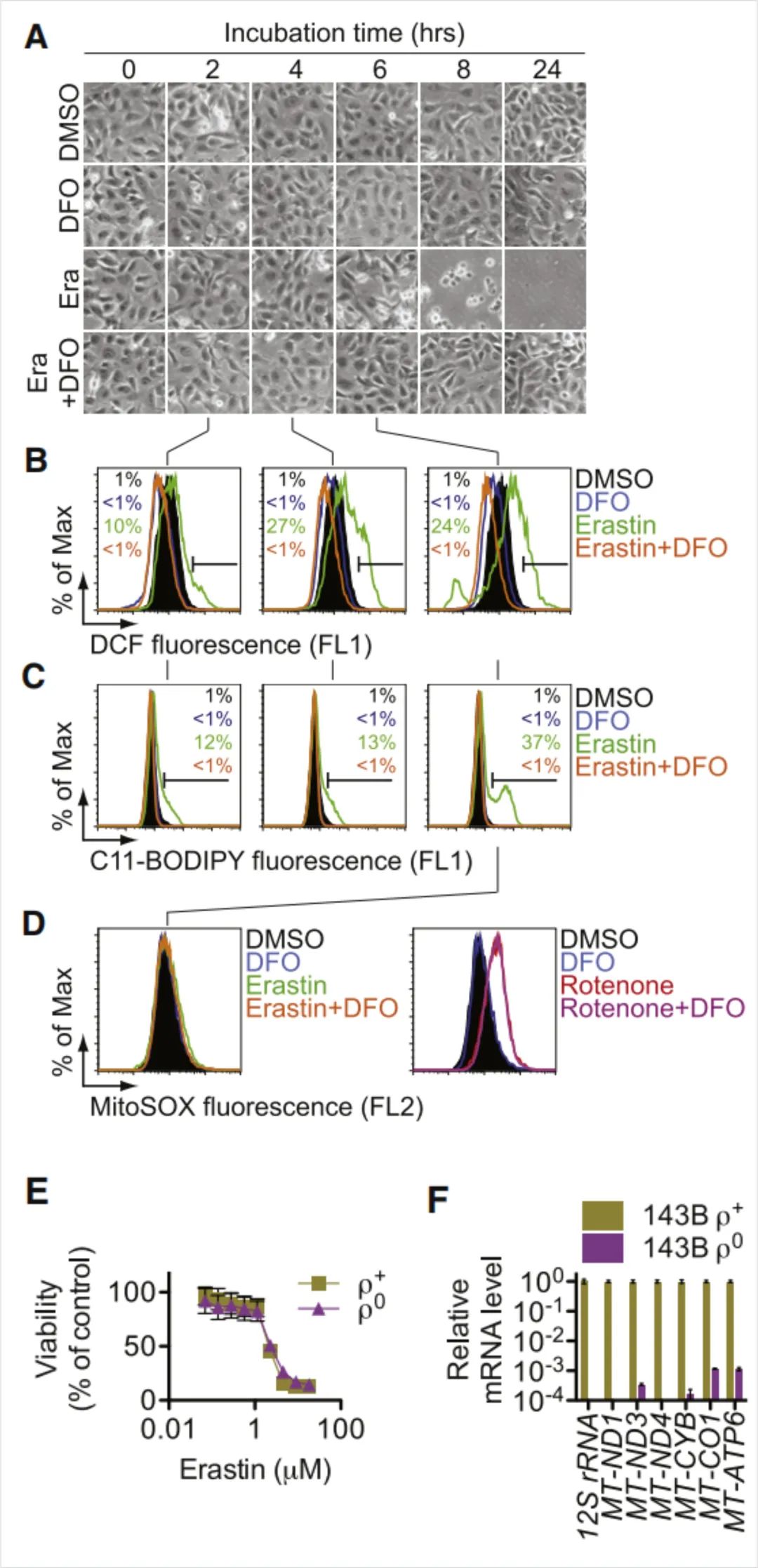
图3:erastin诱导的死亡触发了细胞内ROS的积累,DFO可以抑制其产生
△点击放大图片
(A) HT-1080细胞活力随时间的可视化±erastin (Era, 10μM)和DFO (DFO, 100μM)。
(B和C)使用H2DCFDA和C11-BODIPY流式细胞仪评估随着时间(2,4,6小时)的细胞质和脂质ROS的产生。
(D)用erastin±DFO或鱼藤酮(250 nM)±DFO处理HT-1080细胞6小时后评估线粒体ROS。(E)erastin诱导143B ρ0和ρ+细胞死亡。
(F) ρ0和ρ+细胞中mtDNA编码的转录水平。
在携带RAS突变基因的HT-1080纤维肉瘤细胞模型中,发现erastin不仅能通过调节线粒体电压依赖性阴离子通道(VDAC)发挥抗肿瘤作用,同时抑制Na+非依赖性胱氨酸/谷氨酸逆向转运体(Xc-)系统重要组成亚单元(SLC7A11)功能, 减少胞内谷胱甘肽合成的基本原材料,导致铁依赖性脂质活性氧的累积增加,诱导细胞死亡。而这种由选择性致死小分子物质erastin触发的新型调节性细胞死亡是被我们先前忽视的类型,即“铁死亡”。
总结:
1. 致癌的RAS选择性致死小分子erastin触发一种独特的铁依赖性非凋亡细胞死亡,我们称之为铁死亡。铁死亡依赖于细胞内铁,但不依赖于其他金属,在形态学、生物化学和遗传学上不同于凋亡、坏死和自噬。
2. 非凋亡形式的细胞死亡可以促进某些肿瘤细胞的选择性消除或在特定的病理状态下被激活,因此,铁死亡的激活导致某些癌细胞的非凋亡破坏,而抑制这一过程可以保护生物体免受神经退化。
意义:这篇文章的出现,正式提出了铁死亡这个概念,并且将其与铁联系起来,对机理也有一些潜在的探讨。除此之外,它指明了铁死亡与疾病之间的利害关系。但是铁在铁死亡中的具体作用仍不清楚,不能用简单的H2O2依赖的、铁催化的ROS产生的增加来解释铁死亡。
自2012年“铁死亡”出现,科学界对它的研究就开始多了起来,不过面对全新的领域,相当于摸黑前进,但是一个接一个的靶点在科学家的努力下,也逐渐被发现。我们以2个关键靶点GPX4和P53为例。
GPX4

△点击放大图片
作者使用导致GPX4部分敲除的shRNA沉默GPX4 mRNA,可以强烈地感知细胞对(1S,3R)-RSL3的感知(图4A)。相反,当我们过表达GPX4时,我们发现它对(1S,3R)-RSL3致死性产生了很强的抗性(图4B),这与相关靶蛋白的预期一致。
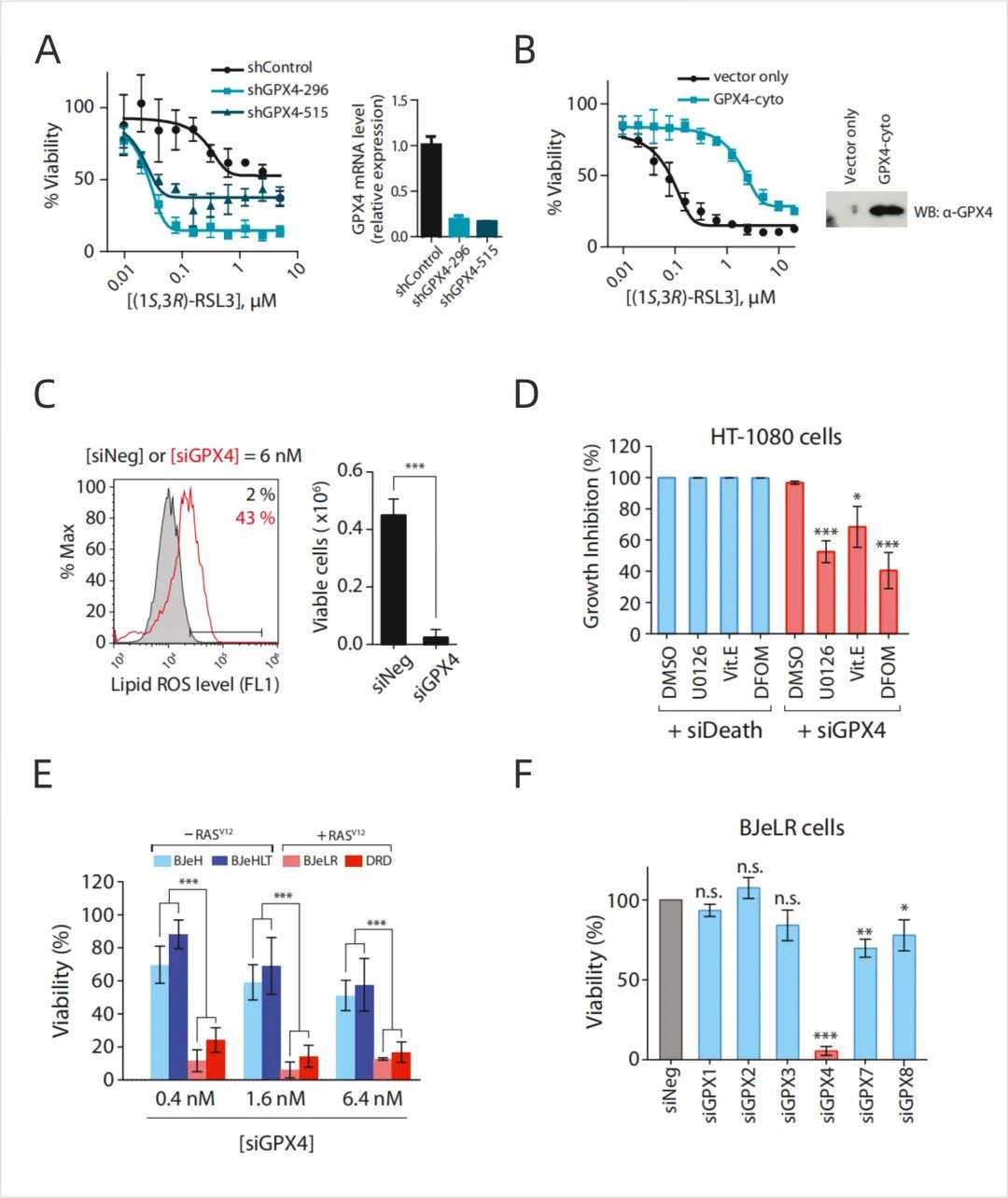
△点击放大图片
图4:RSL3靶向GPX4诱导铁死亡
(A) shRNA下调GPX4使HT-1080细胞对(1S, 3R)-RSL3致敏。
(B)过表达GPX4使HT-1080细胞耐受(1S, 3R)-RSL3致死。
(C)经靶向GPX4的siRNA转染的HT-1080细胞通过BODIPY-C11染色检测,脂质ROS水平增加。siNeg与任何已知的哺乳动物基因都没有同源性,因此被用作阴性对照。
(D)已知的铁死亡抑制剂,10μM U0126, 100μM Vit.E或100μM DFOM均能抑制siGPX4诱导的细胞死亡,而不能抑制siDeath诱导的细胞死亡。
(E) GPX4基因敲除在4个BJ来源的同基因细胞系中显示选择性致死。
(F)其他GPX亚型与嗜铁细胞死亡无关。
siGPX4在BJeLR和DRD细胞(HRASV12)中诱导选择性的细胞死亡,而在BJeH和BJeHLT细胞(野生型HRAS)中没有诱导选择性的细胞死亡,这体现了erastin和RSL3的选择性致死(图4E)。这些数据表明,GPX4是RSL3的主要靶点,介导了RSL3特异性在含致癌HRAS的BJ来源成纤维细胞中诱导铁死亡的能力。
总结:GPX4过表达和敲除可调节12种铁死亡诱导剂的致死性,但不能调节11种具有其他致死机制的化合物的致死性。此外,在异种移植小鼠肿瘤模型中,两种代表性的铁死亡诱导剂阻止肿瘤生长。177个癌细胞系的敏感性分析显示,弥漫性大B细胞淋巴瘤和肾细胞癌对GPX4调节的铁死亡特别敏感。因此,GPX4是铁死亡途径导致癌细胞死亡的重要调节因子。
意义:确定GPX4是铁死亡的中枢调节因子,并且可以在小鼠肿瘤异种移植物中诱导铁死亡,提供了铁死亡诱导化合物的可能治疗应用。
P53
p53是一种肿瘤抑制基因,能够通过下调胱氨酸/谷氨酸转运蛋白中的关键组成成分SLC7A11的表达抑制细胞对胱氨酸的摄取,并增强细胞对铁死亡的敏感性。P53 3KR是p53蛋白的一种乙酰化缺陷突变形式,保留了对SLC7A11表达的调控能力,并能够促使细胞在ROS诱导的应激状态下发生“铁死亡”过程。

△点击放大图片
作者研究了p53 3KR介导的铁死亡细胞死亡是否与ROS应激反应有关。
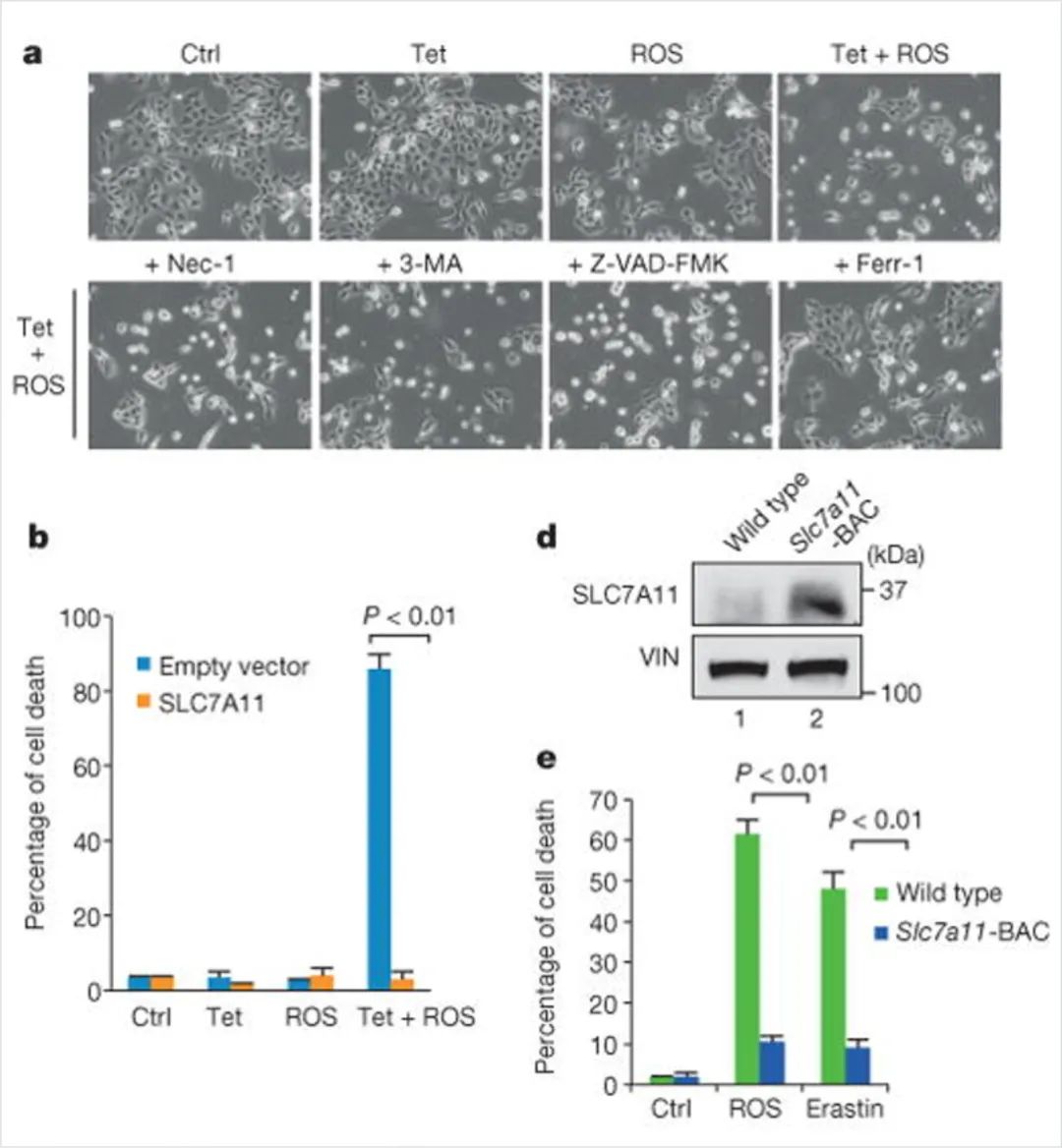
△点击放大图片
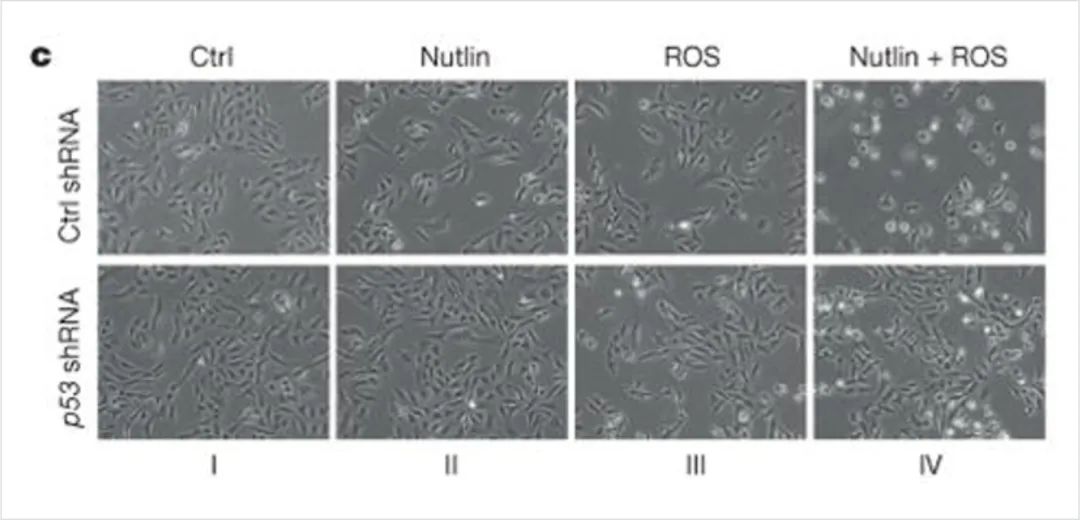
图5:P53介导的ROS反应中的铁死亡
△点击放大图片
(A)Tet-on p533KR细胞用doxycycline和具有特定细胞死亡抑制剂的ROS处理24小时。
(B)用正常或过表达SLC7A11的质粒转染Tet-on p533KR细胞,然后用doxycycline和ROS处理16小时。
(C)将p53敲低的U2OS细胞用nutlin和ROS处理24小时后拍照。
(D)野生型和Slc7a11-BAC转基因小鼠产生的MEFs做Western blot。
(E)将指定基因型的MEFs用ROS或erastin处理8小时。
如图5a所示,单独p53 3KR诱导或ROS处理均未观察到明显的细胞死亡。然而,值得注意的是,p533KR诱导和ROS处理联合诱导了大量细胞死亡,这一死亡被FERR-1或SLC7A11的过表达(图5b)特异性地抑制。这些结果表明,在ROS胁迫下,p533KR的激活导致细胞铁死亡,与细胞周期停滞、衰老和凋亡无关。
最近的研究表明,野生型p53蛋白可以被Nutlin-3激活。在大多数人类癌细胞中,Nutlin-3介导的p53激活可诱导可逆的细胞周期停滞,但不会导致细胞死亡,这可能限制其在癌症治疗中的有效性。因此,作者随后研究了抑制MDM2是否能调节p53介导的人类癌细胞铁死亡。
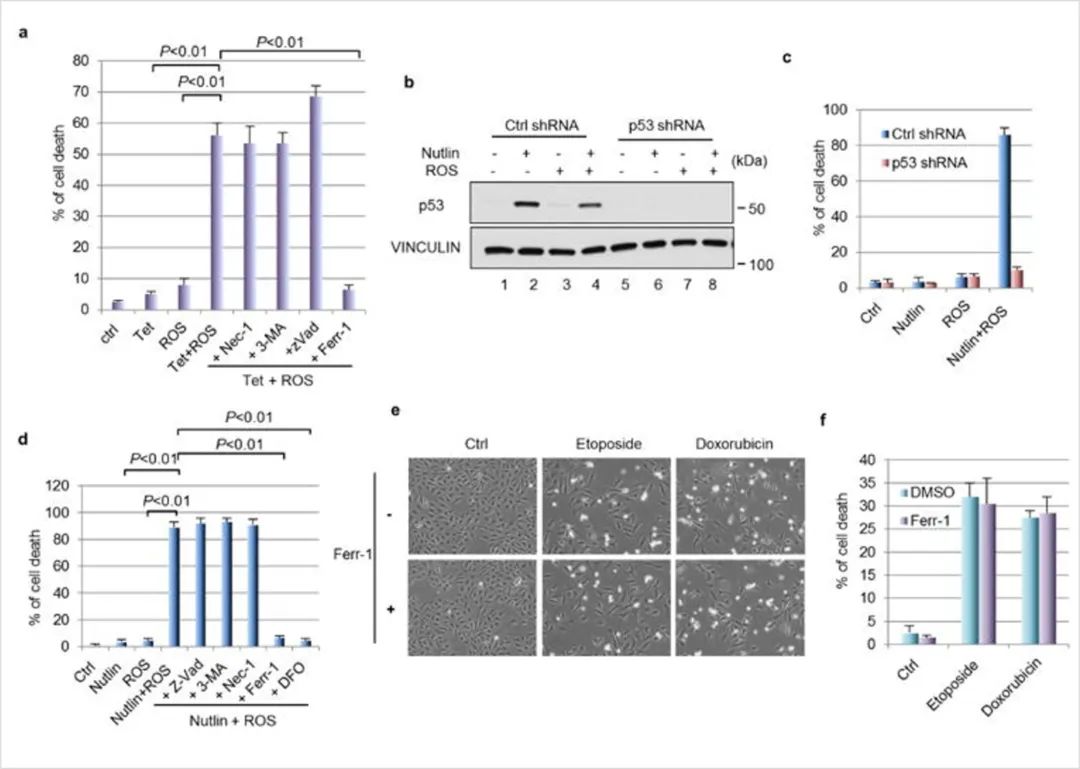
图6:nutlin/ROS 协同调控的铁死亡
△点击放大图片
(A)细胞死亡百分比如图6a所示。
(B)稳定敲除p53的U2OS细胞用10 μM的nultin处理24h,然后加入ROS(叔丁基过氧化氢,350 μM)处理4h。
(C)细胞死亡的量化,如图6c所示。
(D)先用nutlin (10 μM)处理U2OS细胞24 h,然后用ROS(叔丁基过氧化氢,350 μM)和指示细胞死亡的抑制剂处理U2OS细胞;24小时后定量测定细胞死亡。
(E)用dna损伤剂(依托泊苷,20 μM;阿霉素,0.2 μg/ml)在含或不含ferr-1 (2 μM)的情况下作用48 h。
(F)细胞死亡在f中定量。
结果显示,细胞死亡反应是p53依赖的,因为它在内源性p53被敲除后被取消,细胞死亡再次被铁死亡抑制剂FERR-1拯救,但是FERR-1治疗不能抑制DNA损伤诱导的细胞死亡。因此,这表明p53介导的铁死亡是由ROS特异性诱导的,而不是由DNA损伤诱导的。
总结:对突变小鼠的分析表明,这些非典型p53活性有助于胚胎发育和与MDM2丢失相关的致死性。此外,SLC7A11在人类肿瘤中高度表达,其过表达抑制ROS诱导的铁死亡,并消除p533KR介导的异种移植模型中的肿瘤生长抑制。
意义:作者的发现揭示了一种新的肿瘤抑制模式,该模式基于p53对胱氨酸代谢、活性氧反应和铁缺乏的调节。
在对铁死亡关键基因进行发掘的同时,对铁死亡的应用研究也值得我们重视。
“铁死亡”在神经退行性疾病、肿瘤、缺血再灌注损伤等疾病的发生发展中起关键作用。“铁死亡”激活可以导致肿瘤细胞死亡,现已发现多种肿瘤细胞对药物诱导的铁死亡相当敏感。因此,抑制“铁死亡”可以防治神经退行性疾病和缺血再灌注损伤等的发生,换句话说,可以通过“铁死亡”诱导剂来治疗肿瘤和“铁死亡”抑制剂来治疗神经退行性疾病。
铁死亡与线粒体的联系
动物细胞中ROS有三种来源:巨噬细胞、线粒体呼吸链和线粒体多不饱和膜的脂质过氧化。线粒体是细胞代谢的重要场所,是ROS的产生者和靶点,调节ATP水平和钙稳态,也是氨基酸、脂质和核苷酸的生物合成途径的枢纽。并且就2021年度国自然热点的中标数来看,线粒体方向高居第三,说明线粒体研究大有可为!!!那么铁死亡与线粒体能碰撞出怎么样的火花呢?
2015年以来,人们对发现抑制铁死亡的化合物和机制非常感兴趣。
△点击放大图片
在这项研究中,作者证明了XJB-5-131、JP4-039和其他基于氮氧化物的脂质过氧化缓解剂防止HT-1080、BJeLR和panc-1细胞中铁性细胞死亡的能力。合成了几种活性氧清除剂XJB-5-131和JP4-039的类似物,以探索结构——活性关系和亚细胞定位对这些新型铁抑制剂效能的影响。
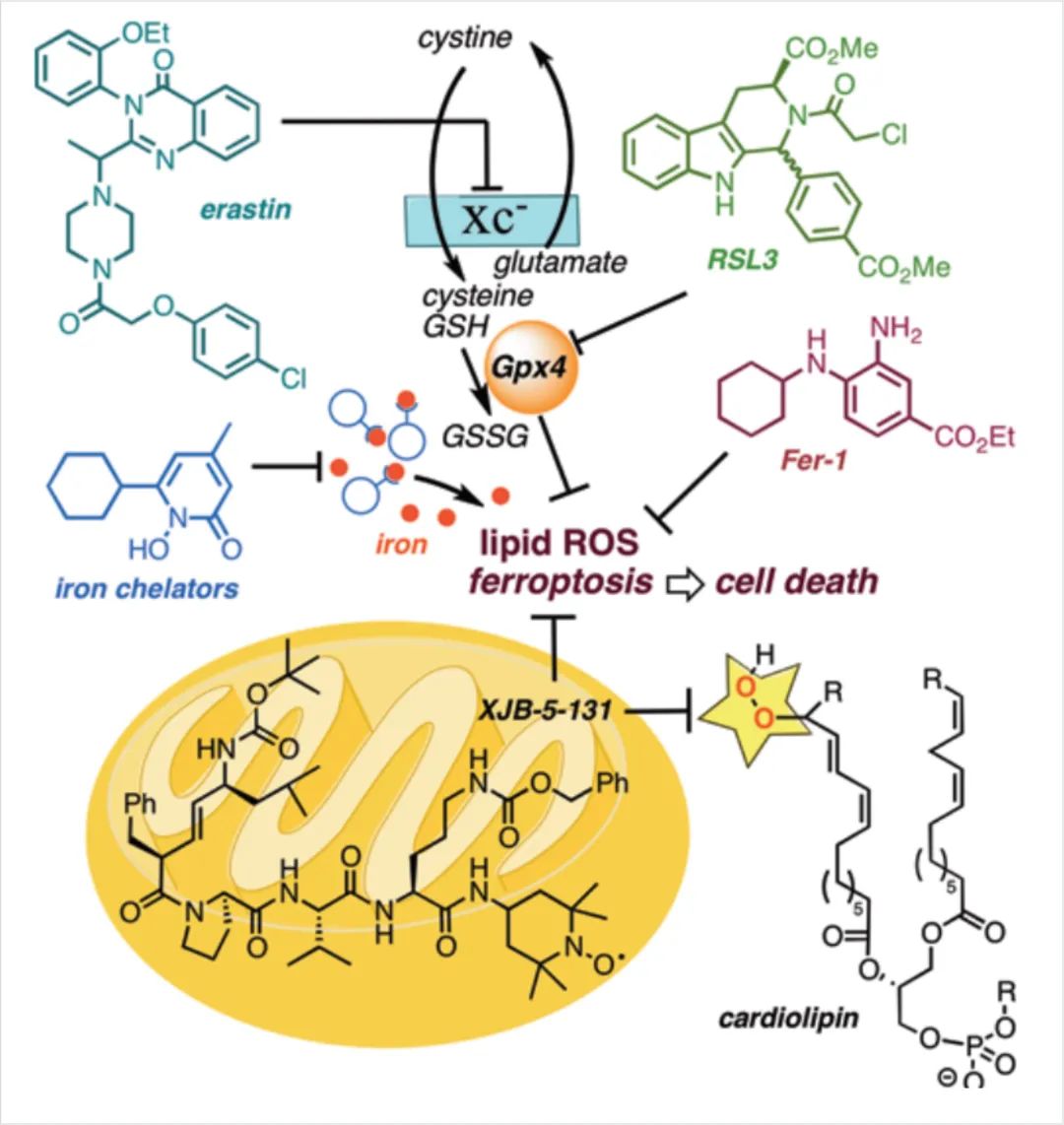
图7:线粒体内脂质过氧化在铁死亡中的关键作用
△点击放大图片
它们的生物活性与它们的结构、相对亲脂性和各自在线粒体中的富集相关联超过几个数量级,揭示了线粒体内脂质过氧化在铁死亡中的关键作用。这些结果还表明,防止线粒体脂质氧化可能为缺血/再灌注诱导的组织损伤、急性肾损伤和其他涉及铁调细胞死亡途径的病理提供可行的治疗机会。
总结:线粒体脂质氧化在促进铁链细胞死亡途径中起关键作用,这一过程的有效抑制剂需要主要定位于线粒体才能具有显著的效力。
意义:发现了线粒体靶向氮氧化物在多种细胞环境中是铁死亡的有效抑制剂,提示了一种创造抑制铁死亡药物的新方法。但是,确定铁死亡抑制剂在多大程度上能促进肿瘤形成,以及铁死亡的诱导剂在多大程度上可能引发退行性病变,都需要进一步研究。
铁死亡与自噬的联系
自噬是一种保守的细胞内分解代谢过程,将细胞成分传递到溶酶体进行降解。自噬确实可能在特定的环境下促进细胞死亡,但其潜在的机制一直难以捉摸。

△点击放大图片
这篇文章报告了自噬的关键作用,特别是在铁死亡中,细胞铁储存蛋白的自噬降解(一个称为铁蛋白自噬的过程)。首先测试了铁死亡诱导条件是否能刺激自噬。
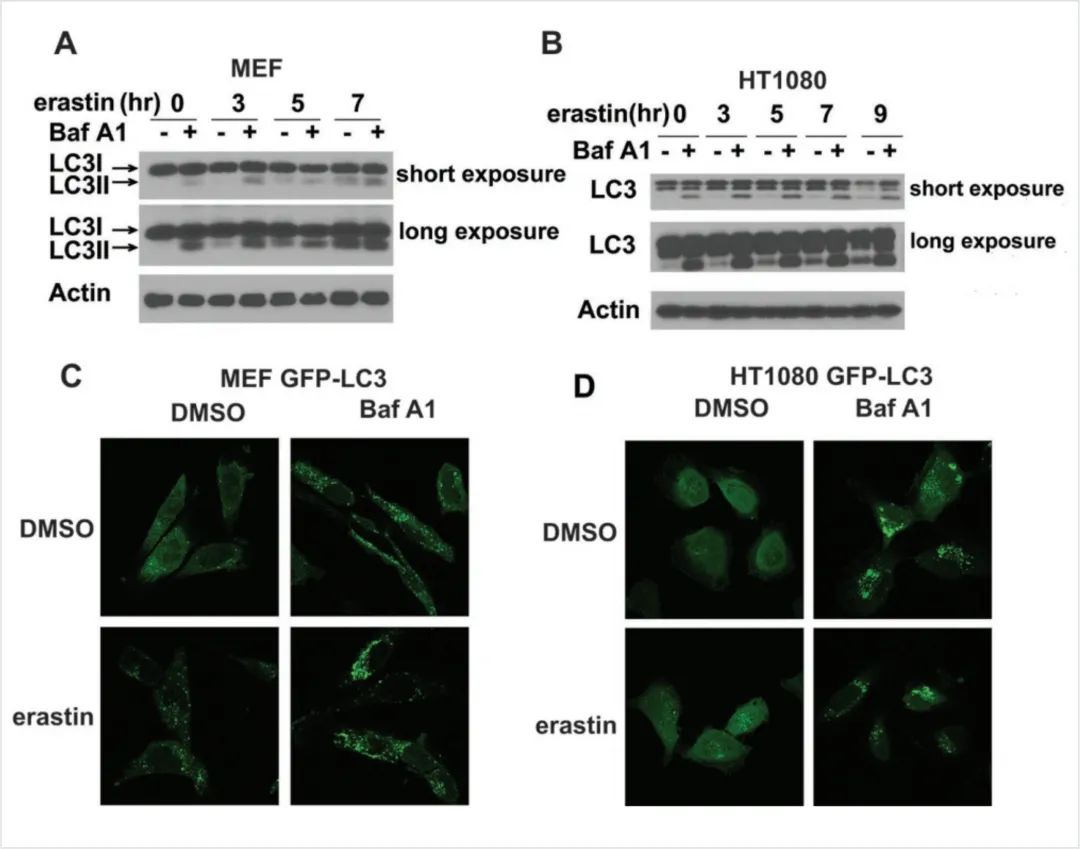
图8:铁死亡诱导物激活自噬
△点击放大图片
(A.B) Erastin诱导MEFs和HT1080细胞的LC3转化。相对于LC3I(迁移较慢的形式),LC3II(迁移较快的形式)的积累表明自噬的诱导。
(C.D) Erastin诱导MEFs (C)和HT1080细胞中GFP-LC3斑点形成(D)。
用铁下垂诱导剂erastin处理MEFs和人纤维肉瘤HT-1080细胞,诱导LC3I转化为LC3II和GFP-LC3点状形成,这是自体吞噬反应的标志(图8A-8D)。溶酶体抑制剂bafilomycin A1 (BafA1)可进一步增强LC3II累积和LC3-GFP点状形成,表明自噬的功能完整通量。
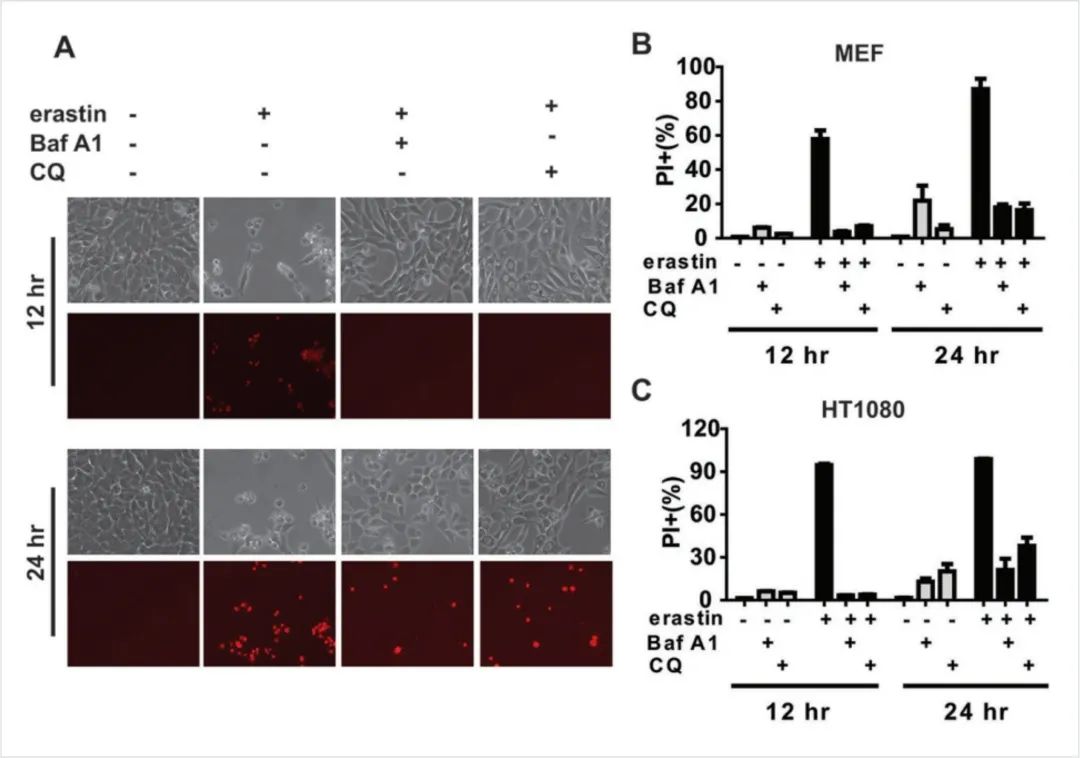
图9:自噬正向调节铁死亡
△点击放大图片
(A-C)自噬抑制剂BafA1和CQ抑制MEFs (A, B)和HT1080细胞(C)的铁死亡。在A中,显微镜下显示了自噬抑制剂的作用(黑色和白色:收缩作用;红色:PI染色)与抑制剂和治疗时间的关系。B和C组采用PI染色结合流式细胞术定量细胞死亡。
图9说明:溶酶体抑制剂BafA1和氯喹(CQ)可以显著阻断erastin诱导的MEFs和HT1080细胞的铁死亡,这是通过碘化丙啶(PI)染色结合流式细胞术测量的结果。结合其他的一些研究,BafA1和CQ在较早的时间点阻断了铁死亡,但在较晚的时间点抑制作用逐渐丧失,尤其是使用较高剂量的erastin时。综合来看,抑制溶酶体功能(自噬流量的终点)可以显著减弱和延缓铁死亡的过程。
总结:通过阻断自噬或敲除NCOA4来抑制铁蛋白吞噬,消除了与铁死亡相关的细胞不稳定铁和活性氧的积累,以及最终的铁死亡。因此,铁死亡是一种自噬性细胞死亡过程,NCOA4介导的铁蛋白受体通过控制细胞铁稳态支持铁死亡。
除了GPX4和P53,像SLC7A11、NFE2L2等靶点也不断的被发现,我们便不一一展示。下图做了一个较为全面的总结,分享给大家
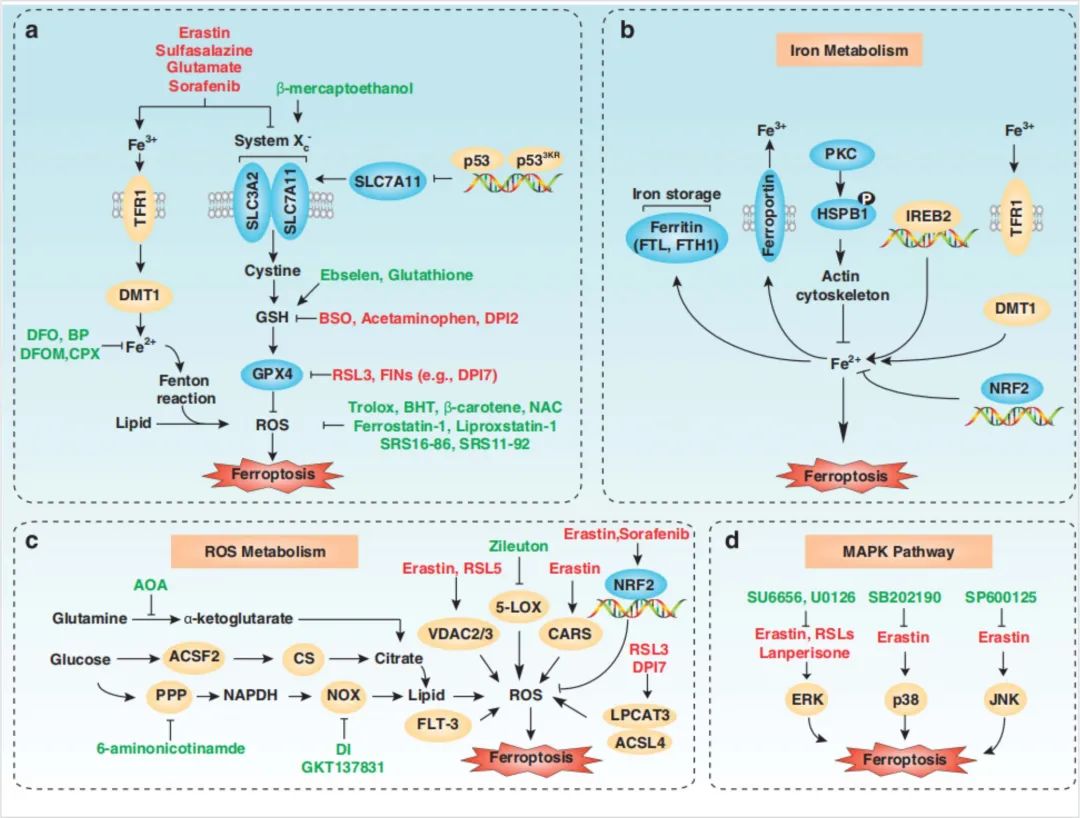
图10:铁死亡的分子机制和信号通路
△点击放大图片
总结:
1. 铁死亡是一种调控细胞死亡的形式,主要依赖于铁介导的氧化损伤和随后的细胞膜损伤。
2. 铁死亡可通过两种主要途径引起:外源性/转运体依赖途径,以及内源性/酶调节途径。
3. 铁积累的增加,自由基的生产,脂肪酸供应和脂质过氧化的专用酶是诱导铁死亡的关键。
4. 多个氧化和抗氧化系统,与自噬和膜修复机制共同作用,形成了铁死亡中脂质过氧化的过程。
尽管在理解调节铁死亡的机制方面取得了可观的进展,但我们仍然不知道到底是什么确切的分子事件导致了铁死亡形式的最终细胞死亡,我们希望在接下来的几年里,铁死亡的执行机制将被明确阐释。
03 铁死亡与疾病
随着铁死亡的神秘面纱逐渐被揭开,其在疾病上的研究应用也越来越受到关注。抗疟药青蒿素及其衍生物已被探索为潜在的抗癌药物,但其潜在机制存在争议。我们就以下面一篇文章为例,看看青蒿素化合物是如何使癌细胞对铁死亡敏感。

△点击放大图片
青蒿素(ART)是从中国传统植物黄花蒿中分离出来的天然产物,其生物利用度提高的半合成衍生物是有效的抗疟药物。因为ART及其衍生物可以与铁反应并触发细胞中ROS的产生,所以作者在这项研究中试图研究它们在调节癌细胞中铁死亡的潜在作用。
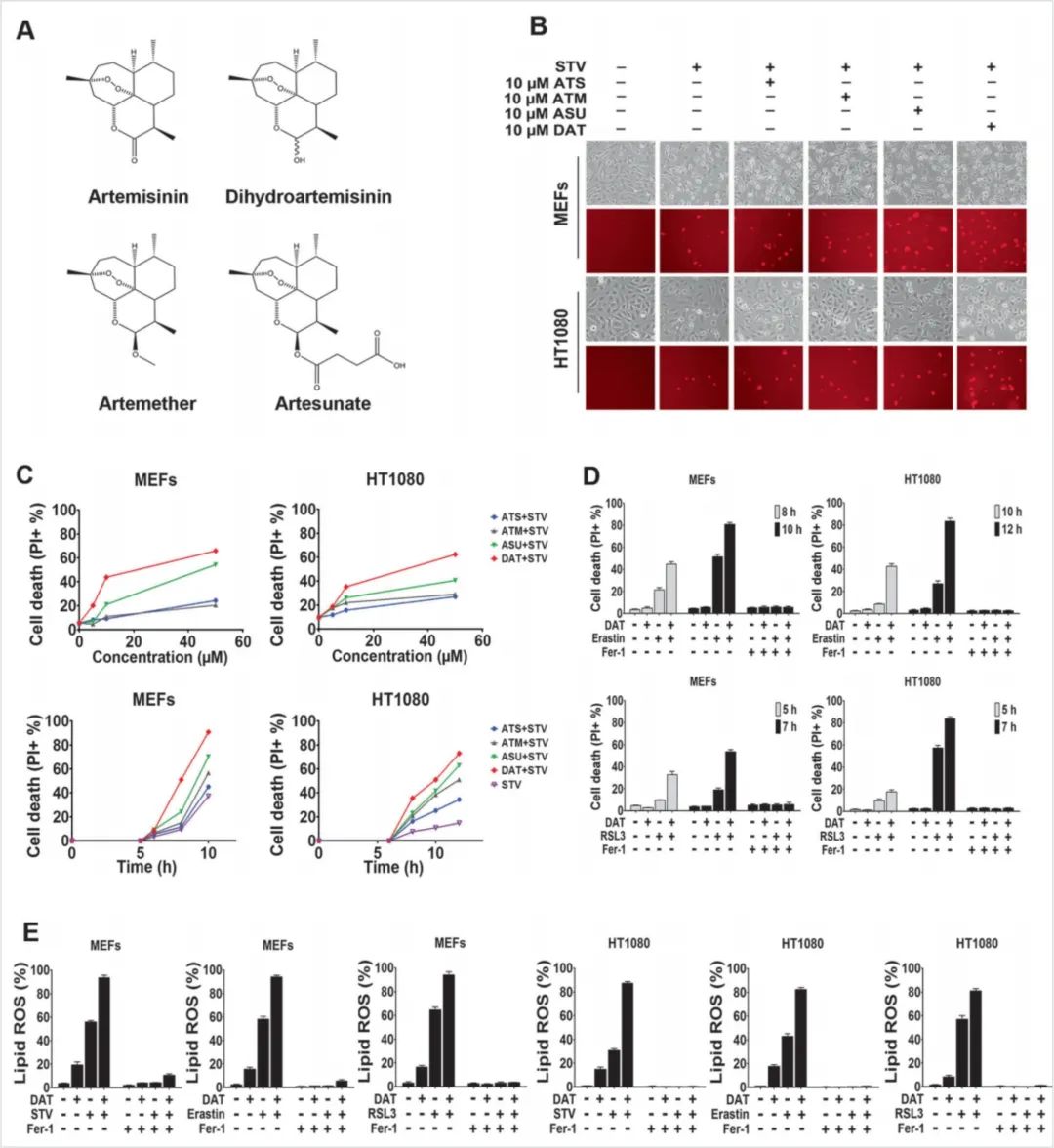
图11:青蒿素及其衍生物可增强细胞对铁死亡的敏感性。
△点击放大图片
(A)四种青蒿素化合物的化学结构。
(B.C)在b中,在有或没有指定浓度的ART化合物的情况下,半胱氨酸饥饿8和10 h分别诱导MEF和HT1080细胞发生铁死亡。上图为相衬图,下图为碘化丙啶(PI)染色。c流式细胞术定量PI阳性嗜铁MEF和HT1080细胞,分别用半胱氨酸饥饿培养基处理6和8小时(上图)或用10 μM青蒿素化合物处理(下图)。
(D)用erastin或RSL3处理后的PI阳性细胞,用流式细胞术定量。
(E)erastin阻断了DAT致敏的脂质ROS,使用BODITY - C11脂质探针流式细胞术对MEF和HT1080细胞进行量化。
在小鼠胚胎成纤维细胞(MEFs)和人骨肉瘤HT1080细胞中,作者发现在这四种ART化合物中,都以时间和剂量依赖的方式使细胞对半胱氨酸饥饿(STV)诱导的铁死亡敏感(图11b,c)。DAT最有效地使细胞对STV诱导的铁死亡敏感。
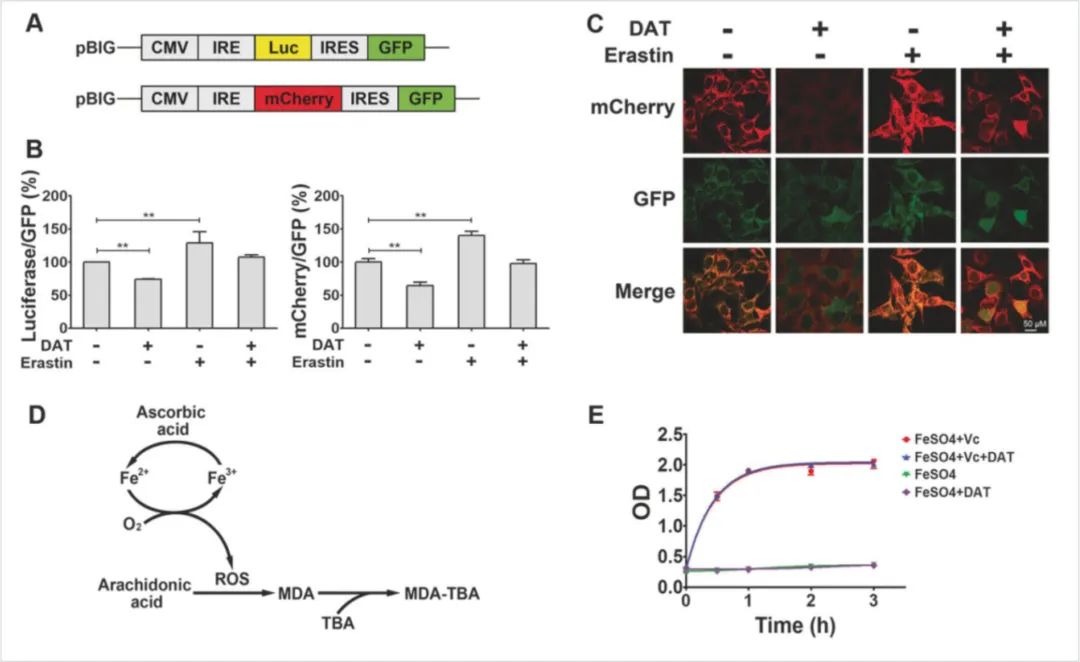
图12:DAT通过IRP-IRE信号调节细胞铁稳态
△点击放大图片
(A)基于铁蛋白的IRE-驱动荧光的结构。
(B)定量评估荧光素酶/GFP和mCherry/GFP在MEF细胞中由DAT和erastin联合调控6小时的百分比。
(C)mCherry和GFP在mCherry/GFP报告基因表达的MEFs细胞中,经DAT和/或erastin处理6小时的荧光显微镜图像。
(D)显示亚铁离子和抗坏血酸催化花生四烯酸氧化的示意图。
(E)在亚铁-抗坏血酸催化体系中,DAT不影响脂质过氧化。
双氢青蒿素(DAT)可以以一种不依赖自噬的方式诱导铁蛋白的溶酶体降解,增加细胞游离铁水平,并使细胞对铁死亡变得更加敏感。此外,通过与细胞游离铁结合,从而刺激铁调节蛋白(IRPs)与含有铁响应元件(IRE)序列的mRNA分子的结合,DAT作用于IRP/IRE控制的铁稳态,进一步增加细胞游离铁。
总结:DAT可以增加GPX4抑制诱导的铁死亡,该抑制诱导的铁死亡存在于对铁死亡具有高度抗性的癌细胞队列中。
意义:青蒿素化合物可以通过调节细胞铁稳态使细胞对铁缺乏敏感。这个发现可以在临床上用于增强未来铁死亡诱导癌症治疗的效果。
通过药物诱导铁死亡已被证明以Ras依赖和非依赖的方式抑制癌细胞生长,进一步定义癌症中铁死亡的基因型选择性活性及其相关机制对于指导基于铁死亡的治疗干预非常重要。铁死亡在无菌炎症条件下具有重要作用,如组织急性损伤、缺血再灌注损伤和神经毒性。对铁死亡在癌症和损伤相关疾病中的作用的进一步了解将为诊断和治疗干预创造新的机会。
经过研究者们对铁死亡的深入研究,无论是铁死亡的发生机制还是在疾病发生发展中的作用,均取得了诸多可喜的研究成果,然而对于铁死亡的发生过程仍然存在诸多亟待解决的关键问题:
1. 更好的区分各种死亡方式以及开发更为特异的检测指标和方法
2. 铁和脂氧合酶在触发或传播脂质过氧化,以及细胞器(如线粒体)的作用
3. 目前尚不清楚铁死亡是否是抑制其他死亡途径的一种特殊机制
4. 铁死亡是“主动的”还是“被动的”?
总之,有大量可预见的机会来阐明铁死亡的执行机制和自然利用这种细胞死亡的环境。这些研究将阐明铁死亡的生理和病理作用的广度。
我们还预测,在特定生物标志物的使用和对患者发病背景的精确评估的指导下,新的基于铁死亡的治疗方法将在不久的将来被开发并投入临床使用。
部分相关产品(更多请联系优宁维)
| 货号 | 产品名称 |
| 29650 | Ferroptosis Antibody Sampler Kit(检测指标:GPX4、NCOA4、KEAP1、NRF2、4F2hc/CD98、FTH1、xCT/SLC7A11、DMT1/SLC11A2) |
| 4577 | Phospho-FLT3 (Tyr842) (10A8) Rabbit mAb |
| 13113 | CD71 (D7G9X) XP® Rabbit mAb |
| 8661 | Axl (C89E7) Rabbit mAb |
| 67138 | DPP4/CD26 (D6D8K) Rabbit mAb |
| 8455 | IFN-γ (D3H2) XP® Rabbit mAb |
| 37909 | p53 Antibody Sampler Kit |
| 41896 | TGF-β Receptor II (E5M6F) Rabbit mAb |
| 4393 | FTH1 (D1D4) Rabbit mAb |
| abs50003-50ml(5000T) | CCK-8试剂盒 |
| abs50010-500T | MTT细胞增殖及细胞毒性检测试剂盒 |
| abs580105-96T | Iron Microplate Assay Kit |
| abs580219-96T | Total Iron-binding Capacity Microplate Assay Kit |
| 货号 | 产品名称 | 性能 |
| 701900-96wells | FSP1 Fluorescent Inhibitor Screening Assay Kit | 包括人重组蛋白FSP1、阳对抑制剂iFSP1,可以分析45个样品(一个复孔)或29个样品(两个复孔) |
| 701880-96wells | GPX4 Inhibitor Screening Assay Kit | 包括人重组蛋白GPX4、阳对抑制剂ML-162,可以分析45个样品(一个复孔)或29个样品(两个复孔) |
1. Dolma S, Lessnick SL, Hahn WC, Stockwell BR. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells. Cancer Cell. 2003 Mar;3(3):285-96.
2. Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, Patel DN, Bauer AJ, Cantley AM, Yang WS, Morrison B 3rd, Stockwell BR. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell. 2012 May 25;149(5):1060-72.
3. Yang WS, SriRamaratnam R, Welsch ME, Shimada K, Skouta R, Viswanathan VS, Cheah JH, Clemons PA, Shamji AF, Clish CB, Brown LM, Girotti AW, Cornish VW, Schreiber SL, Stockwell BR.
4. Regulation of ferroptotic cancer cell death by GPX4. Cell. 2014 Jan 16;156(1-2):317-331.
5. Jiang L, Kon N, Li T, Wang SJ, Su T, Hibshoosh H, Baer R, Gu W. Ferroptosis as a p53-mediated activity during tumour suppression. Nature. 2015 Apr 2;520(7545):57-62.
6. Krainz T, Gaschler MM, Lim C, Sacher JR, Stockwell BR, Wipf P. A Mitochondrial-Targeted Nitroxide Is a Potent Inhibitor of Ferroptosis. ACS Cent Sci. 2016 Sep 28;2(9):653-659.
7. Gao M, Monian P, Pan Q, Zhang W, Xiang J, Jiang X. Ferroptosis is an autophagic cell death process. Cell Res. 2016 Sep;26(9):1021-32.
8. Chen GQ, Benthani FA, Wu J, Liang D, Bian ZX, Jiang X. Artemisinin compounds sensitize cancer cells to ferroptosis by regulating iron homeostasis. Cell Death Differ. 2020 Jan;27(1):242-254.