Palmitoylation couples insulin hypersecretion with β cell failure in diabetes
文献求助- Cell Metab
- 2023
- 27.7
- 2023 Feb 7;35(2):332-344.e7.
- 10.1016/j.cmet.2022.12.012
- 糖尿病
- IF,IHC-P,FCM
- 代谢
- S-acylation; acyl-protein thioesterases; beta cell failure; lipotoxicity; type 2 diabetes.
- 其它细胞
Abstract
文献解析
31分文献揭示棕榈酰化与胰岛素分泌的相关性

Dong et al., 2023, Cell Metabolism 35, 332–344 February 7, 2023
https://doi.org/10.1016/j.cmet.2022.12.012 IF:31.373
棕榈酰化偶联胰岛素分泌亢进与糖尿病β细胞衰竭
作者简介:

本文亮点:
APT1在人胰岛中表达改变
APT1缺乏导致胰岛素分泌过多
APT1底物Scamp1缺乏导致胰岛素分泌过多
APT1缺乏促进高脂喂养小鼠和db/db小鼠的β细胞衰竭
背景部分介绍:
II型糖尿病(T2D)是一种致命的多系统疾病,以循环葡萄糖水平升高为特征。T2D的高血糖是由β细胞功能障碍引起的,通常在胰岛素耐受的情况下发生。高胰岛素血症常见于T2D,高血糖可能代表β细胞无法补偿外周胰岛素抵抗。T2D演变的机制尚不清楚,该疾病有一系列表现,包括糖尿病并发症和死亡的各种风险。其中一些表现的特点是胰岛素分泌过多,在没有胰岛素抵抗的情况下,循环葡萄糖水平远未达到糖尿病的诊断水平。这种高分泌的病因尚不清楚,及胰岛素分泌增加是否导致β细胞衰竭或胰岛素耐受和糖尿病表型的进展。营养过剩导致组织脂质积累在T2D中很常见,棕榈酸脂肪酸水平升高与高胰岛素血症和β细胞功能障碍有关。营养毒性,有时被称为糖脂毒性,了解甚少,脂肪酸在糖尿病发病机制中的作用是有争议的。
营养过剩导致组织脂质积累在T2D中很常见,棕榈酸脂肪酸水平升高与高胰岛素血症和β细胞功能障碍有关。营养毒性,有时被称为糖脂毒性,了解甚少,脂肪酸在糖尿病发病机制中的作用是有争议的。棕榈酰化,通过在棕榈酸酯部分和半胱氨酸残基上的巯基之间形成硫酯键来修饰蛋白质结构,影响至少4000种人类蛋白质,并且作为代谢疾病的潜在因素被忽视。
棕榈酰化由DHHC酰基转移酶大家族驱动,并由酰基蛋白硫酯酶(APTs)小家族逆转。葡萄糖增加了模拟胰腺细胞的细胞中棕榈酰化蛋白的数量,表明燃料流可能通过棕榈酰化协调代谢功能。APT1是去棕榈酰化的主要介质,从半胱氨酸残基中去除棕榈酸的过程。APT1酶活性在糖尿病内皮细胞中降低,正常内皮细胞暴露于高血糖会降低APT1酶活性,而遗传性APT1缺乏会模拟糖尿病血管疾病,这表明棕榈酰化/去棕榈酰化循环可能在糖尿病病理生理中起重要作用。
主要结果部分:
1. APT1在T2D小鼠中表达量增加,其活性降低

(A)APT1在T2D小鼠中表达量增加;
(B, C)两名尿病患者新分离的β细胞APT1酶活性下降了约30%;
(D)患有严重并发症的长期糖尿病患者的组织,男性糖尿病细胞的β细胞产量低,APT1酶活性增加了约25%。
2. APT1敲除小鼠分离的胰岛增加了葡萄糖刺激的胰岛素分泌

(A-E, G-I)APT1(整体/胰岛)敲除小鼠模型:
●Islet 组织形态未受影响
●β cell 面积无明显变化
(F, G)但经葡萄糖刺激后,APT1敲除小鼠胰岛素分泌增加较对照组增加
3. Scamp1可被棕榈酰化且部分定位于胰岛素分泌颗粒
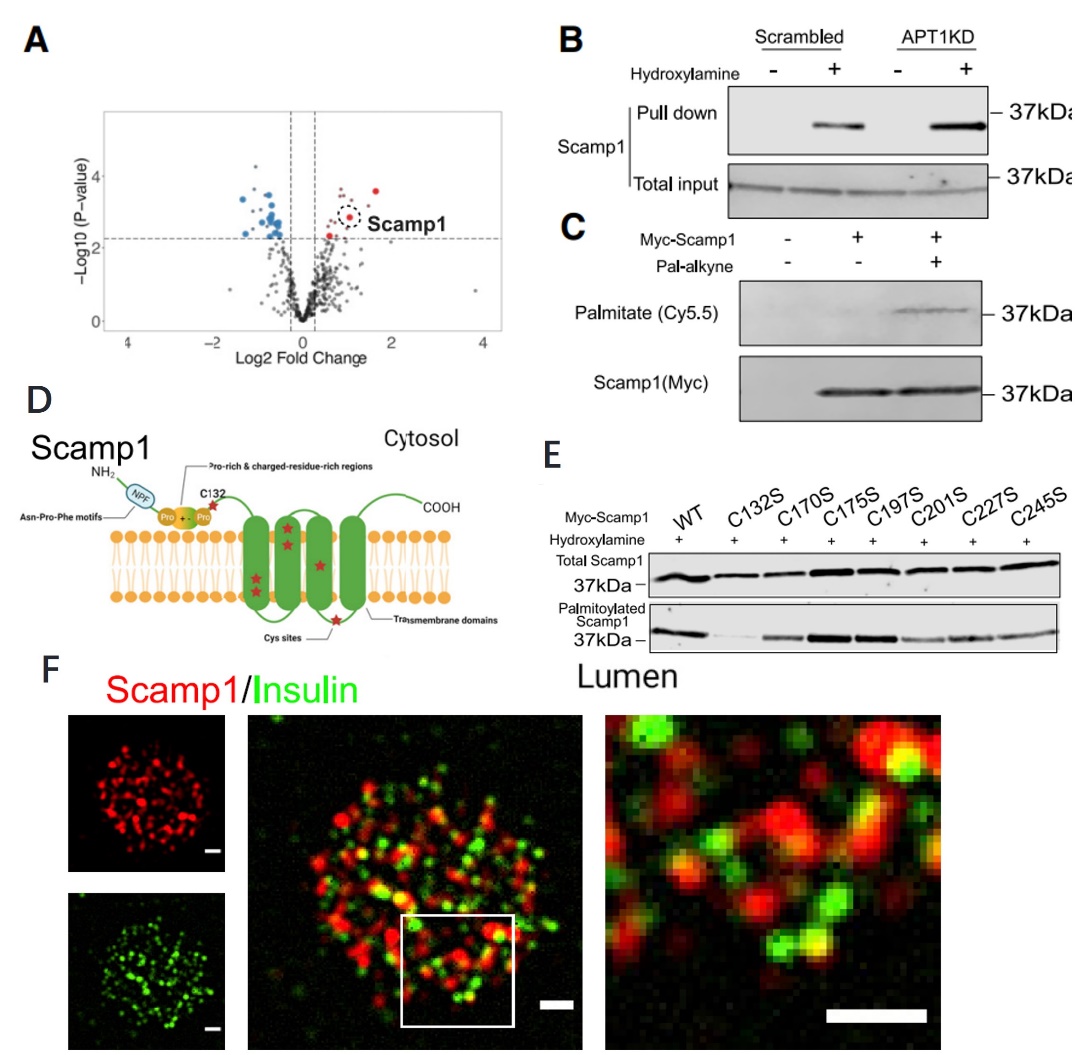
(A)通过使用棕榈酰化蛋白质组学来筛选并验证胰岛中潜在的APT1底物为Scamper1;
(B, C)通过RAC实验(B)和click化学(C)验证Scamp1是棕榈酰化蛋白和APT1的底物;
(D)Scamp1与半胱氨酸残基分布(红色星号)图;
(E)RAC实验测定Scamp1蛋白的132位半胱氨酸为棕榈酰化位点;
(F)TIRF显微镜观察分散于小鼠胰岛中的Scamp1(红色)和胰岛素(绿色)颗粒的共定位。
4. 胰岛特异性APT1缺失导致β细胞衰竭
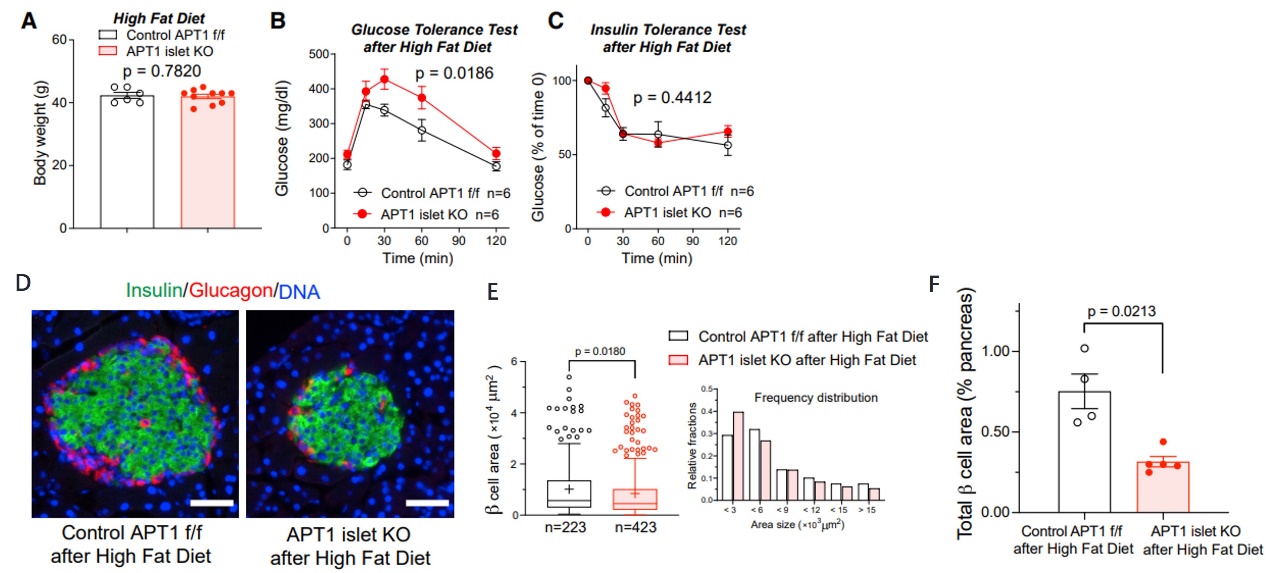
(A)高脂饮食12周后,发现APT1缺失小鼠和对照组的体重没有明显差异;
(B, C)但APT1缺失小鼠的葡萄糖耐受功能受损B,胰岛素耐受检测没有显著影响C;
(D-F)通过组织形态测量发现APT1缺失小鼠单个β细胞面积变化不大E,但APT1敲除小鼠总的β细胞面积占胰岛面积明显减少D和F,说明了APT1敲除小鼠的β细胞发生了衰竭。
5. Scamp1氨基酸突变(C132S)在APT1缺陷的细胞中拯救胰岛素高分泌和营养诱导的凋亡
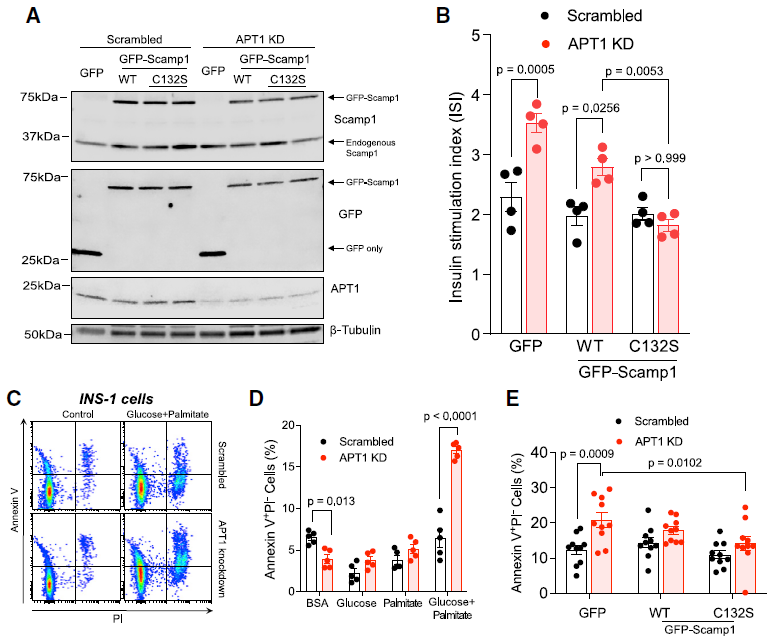
(A)在多个实验中滴定野生型和c132s型Scamp1的表达水平,以在具有APT1活性或没有APT1活性的INS-1细胞中达到等于或低于内源性Scamp1的水平;
(B)野生型Scamp1的表达并不能阻止APT1缺乏引起的胰岛素高分泌,而C132S型Scamp1则可以挽救APT1缺乏细胞的高分泌;
(C, D)在仅用牛血清白蛋白处理的细胞中,与APT1活性正常的细胞相比,APT1敲低不会诱导细胞死亡。与充满APT1的细胞相比,葡萄糖和棕榈酸酯联合处理显著增加了APT1敲低细胞的凋亡。这表明在糖脂中毒的情况下,APT1敲低容易导致胰岛素分泌细胞的衰竭;
(E)C132S Scamp1挽救了APT1 敲低细胞的凋亡,这表明APT1活性对Scamp1棕榈酰化状态的改变与营养诱导的细胞凋亡具有生理相关性。
最后,通过对本研究的理解,小优博士这里整理出总结图(如下),位于胰岛素颗粒上的Scamp1蛋白,在DHHC酰基转移酶的作用下可被棕榈酰化,也可被APTs酶去棕榈酰化,这一过程是可逆的。当APTs酶失能后,可导致胰岛素的过度分泌和胰岛中β细胞的衰竭。

部分产品推荐:
| No | Name |
| 210210 | QIAGEN OneStep RT-PCR Kit (25) |
| 4590 | Insulin Antibody |
| 2760 | Glucagon Antibody |
| 9449 | Ki-67 (8D5) Mouse mAb |
| 11684817910 | In Situ Cell Death Detection Kit, POD |
| abs510030 | Human / Porcine Insulin ELISA Kit |
| 6255 | Fluo-4 AM (1 MG) |
| abs42235791 | Phalloidin-iFluor 594 Conjugate |
| NBP1-79765 | Rabbit Polyclonal Scamp1 Antibody |
热点文献
文献求助我们会在48h内发您邮箱


