视频素材来源于YouTube https://www.youtube.com/watch?v=-MhIhJeLMwk
版权归原作者所有
肺上皮细胞来源于内胚层生殖层,它经历一系列复杂的内胚层-中胚层介导的信号传导事件,最终形成由传导气道(支气管、细支气管)和气体交换单元(肺泡)组成的树状网络。
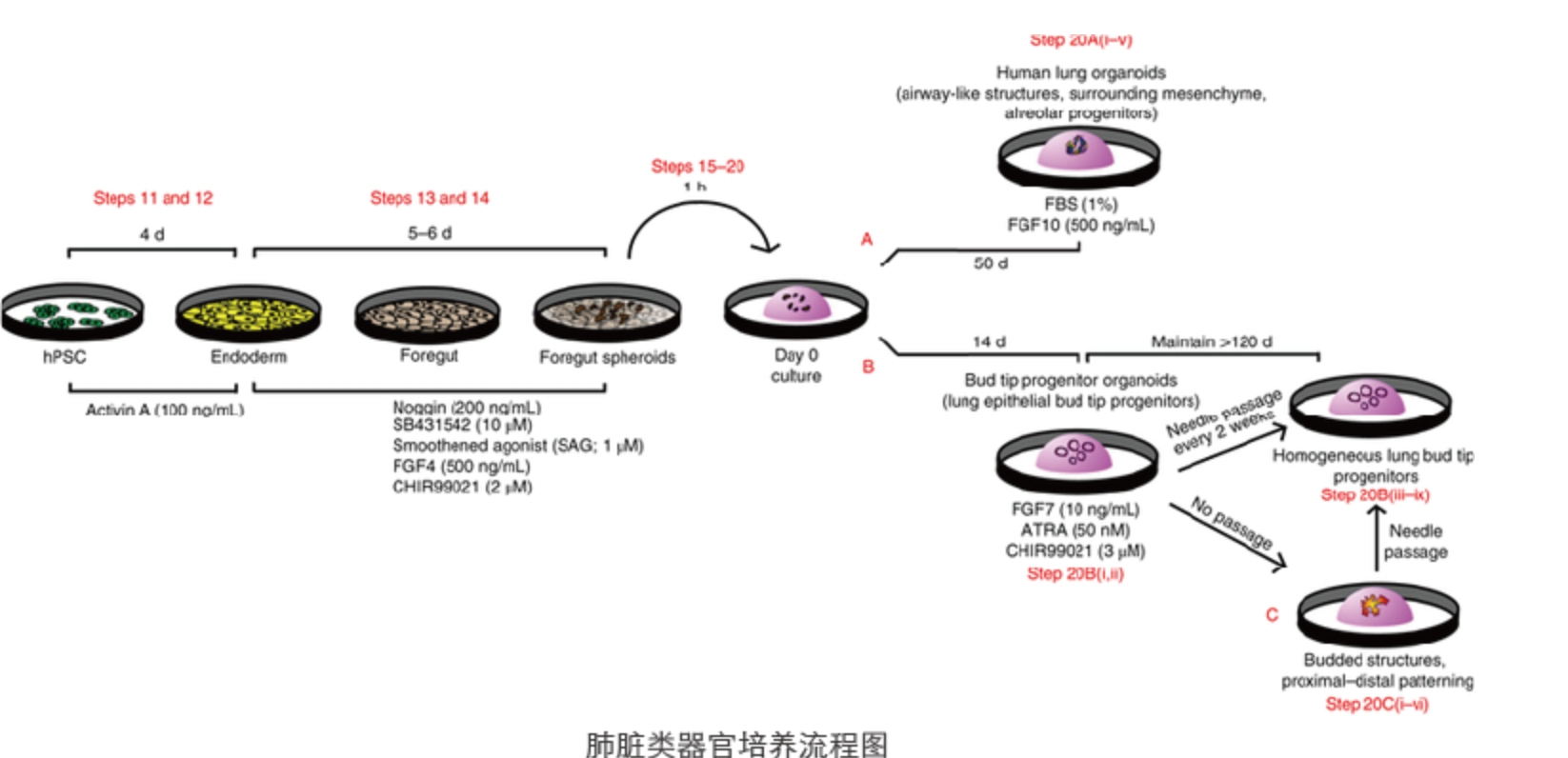
人类多能干细胞(hPSCs)可分化为腹侧前肠球体,并进一步分化为两种不同类型的器官:人肺器官和芽尖祖细胞器官。人肺器官样体不仅可用于发育生物学中的应用,还可用于再生医学、组织工程和药物安全性和有效性测试。
△点击放大图片
实验步骤
- 1
- 2
- 3
- 4
- 5
- 6
-
培养hPSCs
1. 小鼠胚胎成纤维细胞以2.5万个/cm2的密度进行培养。
2. hPSCs在DMEM/F12、20% knockout serum replacement、0.1 mM β-mercaptoethanol和 20 ng/ml FGF-2培养基中培养,且需每天更换培养基。
3. 细胞经accutase/EDTA 消化后,每4d进行1:24传代一次。此时细胞均为未分化状态。 -
诱导形成内胚层
4. 在DMEM/F12(3:1)培养基中添加N2、B27、ascorbic acid(50μg/ml)、Glutamax (2 mM)、monothioglycerol (0.4 μM)、0.05%BSA、 1% penicillin-streptomycin形成无血清分化培养基,hPSCS在其中培养3-4天可诱导形成内胚层。
5. hPSCs用Acutase处理(37°C,2分钟)后,进行1:2稀释,将稀释后的细胞加在包被了基质胶的10cm 培养皿中,处理12-24小时,以去除残留的小鼠胚胎成纤维细胞。
6. 用0.05%胰蛋白酶(37°C,1分钟)将细胞消化成3-10个小细胞团,并对其进行1:1稀释后铺在6孔板中,在无血清分化培养基中形成胚状体。
7. 然后收集胚状体,将其重悬于含有Y-27632(10μM)、BMP4(Human,0.5ng/ml)、bFGF(Human,2.5ng/ml)、activin A(Human, 100ng /ml)的内胚层诱导培养基中,并铺在低粘附板上处理72,84或96小时。每36-48小时(视密度而定)取出一半旧培养基,加入一半新鲜培养基。 -
诱导形成前肠内胚层
8. 在第4天、第4.5天或第5天,用0.05%胰蛋白酶/EDTA(2-4分钟)将胚状体消化成单个细胞。
9. 前肠内胚层诱导:将内胚层细胞重悬于含有1.5μM Dorsomorphin dihydrochloride和10μM SB431542的无血清分化培养基中,随后在48孔细胞培养板(约70000-100000个细胞/孔)中培养24小时,然后转入含有10μM SB431542和1μM IWP2的无血清分化培养基中培养24小时。 -
诱导形成肺祖细胞
10. 对于诱导形成6-15天肺祖细胞,可将前肠前内胚层细胞(AFE)重悬于含有CHRIR99021、3μM(WNT信号激动剂)、FGF10(Human, 10 ng/ml)、FGF7(Human,10 ng/ml)、BMP4(Human,10 ng/ml)、EGF(Mouse,20 ng/m(l 可选))和ATRA(0-1μM)的无血清分化培养基中培养8-10天。
-
诱导肺/气道上皮细胞成熟
11. 在第15/16天,用胰蛋白酶短暂消化后,以1:5的稀释度将肺细胞重新铺板到纤连蛋白包被的细胞培养板上
12. 细胞在用0.05%胰蛋白酶/EDTA(37°C)消化1分钟后,IMDM+5%FCS终止消化。接着用1ml移液枪头将细胞团轻轻地移离培养板, 转移至15ml试管中。
13. 随后将细胞团轻轻混合后,静置2分钟后去除上清液(含有单个细胞和小细胞团(<10个细胞/团)。
14. 对剩余的细胞团进行1:5稀释,将稀释后的细胞重悬于含有CHIR99021(3μM)、FGF10(Human、10 ng/ml)、FGF7(Human,10 ng/ml)、BMP4(Human,10 ng/ml)和ATRA(50 nm)的无血清分化培养基,并在纤连蛋白包被的细胞培养板上进行培养。 -
参考文献
P.S.以上实验步骤均来自文献总结,仅供参考
1. Alyssa J. Miller,1 Briana R. Dye. et al. Generation of lung organoids from human pluripotent stem cells in vitro. Nat Protoc. 2019 Feb; 14(2): 518‒540.
2. Hannan NRF et al. Generation of multipotent foregut stem cells from human pluripotent stem cells. Stem Cell Rep 1, 293‒306.
3. Dye BR et al. In vitro generation of human pluripotent stem cell derived lung organoids. Elife 4, e05098.
4. Chen YW, Huang SX et al. A Three-Dimensional Model of Human Lung Development and Disease From Pluripotent Stem Cells. Nat Cell Biol. 2017 May;19(5):542-549.
5. Nadkarni RR, Abed S, Draper JS. Organoids as a Model System for Studying Human Lung Development and Disease. Biochem Biophys Res Commun. 2016 May 6;473(3):675-82.

