视频素材来源于JOVE https://www.jove.com/v/53359/organoids-as-model-for-infectious-diseases-culture-human-murine
版权归原作者所有
胃干细胞是存在于胃组织中的成体干细胞,具有自我更新和高度增殖能力,它有多向分化潜能,能分化形成各种胃黏膜上皮细胞。
随着对干细胞研究的不断深入,胃干细胞的应用为胃生理与疾病的研究提供了新的手段。
自2010年报道胃类器官模型的构建方法以来,胃类器官迅速成为胃相关疾病研究领域的热点。
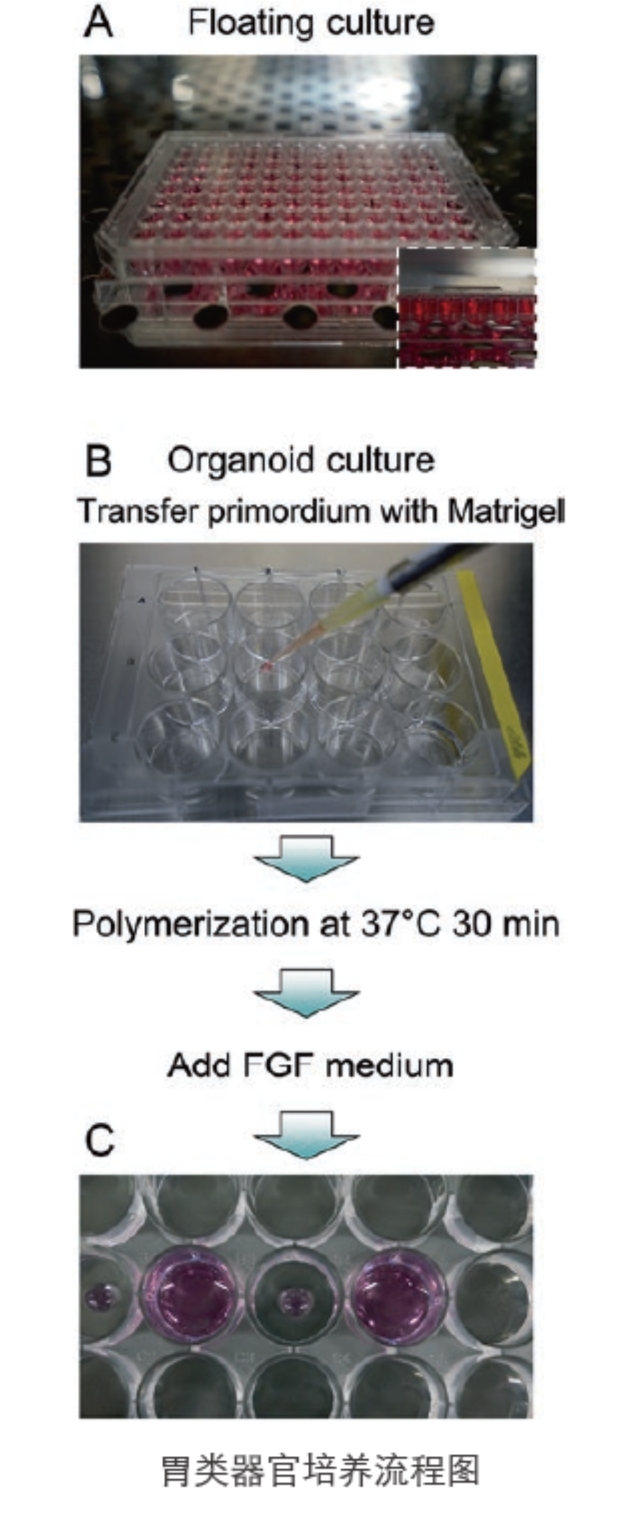
△点击放大图片
实验步骤
- 1
- 2
- 3
- 4
-
组织的分离
1. 准备好实验所需的手术器械(酒精浸泡消毒)、耗材及试剂。将基质胶置于冰上,24孔板在37℃ CO2培养箱中预热30min以上。将离心机预冷为4℃。实验于无菌超净台中进行操作。
2. 先用异氟烷麻醉小鼠,后采取颈椎脱臼方法处死小鼠。
3. 将小鼠浸泡在75%酒精中消毒5min。
4. 打开小鼠腹腔,剪断食管-胃连接部和幽门之间的胃部组织,沿着大弯侧剖开。放置于冰冷无钙镁PBS中,用1ml移液管反复冲洗,洗去胃内容物。剔除胃周边的系膜。
5. 将胃组织用剪刀剪为2-3mm的碎片,并将胃碎片组织置入含有15ml的无钙镁PBS溶液的50ml锥形管中,用移液管反复吸入并吹打20次,待胃组织碎片沉底后,更换无钙镁PBS溶液再用移液管反复吸入及吹打20次。
6. 重复步骤5,反复10-15次,直至液体澄清。
7. 将胃组织碎片先后加入50ml 2mmol/L EDTA、5mmol/L EDTA,于滚轴摇床上分别消化30min。
8. 倒掉5mmol/L EDTA溶液,加入含0.1%BSA的无钙镁PBS 20ml中和反应,移液管反复吹吸10次,待组织碎片沉底后,吸取上清过70μm滤网,将其标记为第1管。再向胃组织碎片中加入含0.1% BSA的无钙镁PBS 20ml,吹打10-15次,待组织碎片沉底后,吸取上清过70μm滤网,将其标记为第2管,同上步骤,分别标记为第3、4、5管。
9. 将第1、2、3、4、5管内液体分别吸取1ml放入24孔板中,倒置显微镜观察所分离上皮和腺管情况,选取1管-2管腺体较多者,置入4℃离心机,290G转速离心5min。
10. 倒去上清,将沉淀重悬于DMEM-F12溶液中,再次置入4℃离心机,290G转速离心5min。
11. 弃上清,根据沉淀量多少,加入1:1比例混合的培养液:基质胶,注意要冰上操作,防止基质胶凝固,用1ml移液枪轻轻混匀。
12. 将50μl悬有胃腺的基质胶加入预热的24孔板中,动作要轻柔,避免枪尖触碰到24孔板的底部。
13. 将种好基质胶的24孔板置于37℃的CO2培养箱孵育10min,使得基质胶完全聚合。
14. 再将每个孔板中加入750μl的完全培养基,置于37°C的5% CO2培养箱中培养。
15. 每隔2天,进行半量换液,一般5-6天,根据胃类器官生长情况,进行传代。 -
胃器官的培养、传代
16. 根据所观察的胃类器官生长状况,选择传代时机,如果胃类器官较大、较密,中间发黑,可以进行传代,选择的传代比例可为1:2-4。
17. 准备好传代所需的物品,将基质胶提前放入4°C冰箱融化。按照24孔板中每孔25μl的用量计算所需的基质胶用量。将培养液及生长因子从-80°C冰箱取出提前融化,放置于常温15°C-25°C。按照24孔板每个孔加入750μl培养液,计算培养液用量。预先在37°C孵箱加热24孔板2h。
18. 将含胃类器官的24孔板放置于冰板上操作,吸掉半量培养液,用1ml枪尖将基质胶从孔板上刮下来。
19. 用29G胰岛素注射器,将含有胃类器官的培养液吸入,使得所有的培养液都通过针头进入注射器,再注入置于冰里的50ml含有DMEM-F12的Corning管里,通过机械力量将胃类器官进行切割、分散。
20. 290G,4°C离心分散的胃类器官5min,倒去DMEM-F12,根据沉淀量多少,加入1:1比例混合DMEM-F12:基质胶(冰上操作),用1ml移液枪吹打混匀,接种于24孔板内。
21. 再将每个孔板中加入750μl的完全培养基,置于37°C的5% CO2培养箱中培养。
22. 每隔2-3天,进行半量换液,根据胃类器官生长情况,可考虑安排进一步实验或传代、冻存。 -
类器官的冻存
23. 选择传代后第3或4天,生长状态比较好的胃类器官进行冻存。
24. 将24孔板置于冰板上操作,吸去培养液,每孔加入0.5ml无血清冻存液,用枪尖将含有胃类器官的基质胶刮下来。
25. 将含胃类器官的冻存液转入2.5ml冻存管,后置于液氮中冻存。 -
参考文献
P.S.以上实验步骤均来自文献总结,仅供参考
1. Takahito Katano , Akifumi Ootani, et al.Establishment of a Long-Term Three-Dimensional Primary Culture of Mouse Glandu- lar Stomach Epithelial Cells Within the Stem Cell Niche.Biochem Biophys Res Commun. 2013 Mar 22;432(4):558-63.
2. do Nascimento Santos CA, Borojevic R,et al.Characterization of Gastrospheres Using 3D Coculture System. Methods Mol Biol. 2018;1842:105-121
3. Carlos Antônio do Nascimento Santos , Radovan Borojevic , et.al Characterization of Gastrospheres Using 3D Coculture System. Methods Mol Biol. 2018;1842:105-121.
4. Karam SM (1995) New insights into the stem cells and the precursors of the gastric epithelium. Nutrition 11:607‒613
5. Santos CA, Andrade LR, Costa MH, Souza HS, Granjeiro JM, Takiya CM et al (2016) Gastrospheres of human gastric mucosa cells: an in vitro model of stromal and epithelial stem cell niche reconstruction. Histol Histopathol 31:879‒895


