下方实验步骤:以XPack系列为例

图 14 实验流程
△点击放大图片
实验步骤
- 1
- 2
- 3
-
转染外泌体供体细胞
在培养皿进行外泌体供体细胞铺板,使用与细胞兼容的培养基,24小时后达到70-80%的融合度,并确保使用无外泌体胎牛血清培养基,将细胞放回培养箱进行培养。
24小时后,将XPack载体与所选择的转染试剂混合,按照适当的方案实现细胞的转染。
具体步骤如下(以SBI的转染试剂PureFection 货号LV750A-1为例)
a. 将5 uL转染试剂、2.5 ug XPack慢病毒载体和200 uL无血清培养基混合在1.5 mL离心管中
b. 短暂的漩涡,并在室温下孵育15分钟
c. 将全部体积加入到6孔板中,每个孔总体积为2-3 mL的培养基
24小时后换液
在转染后48-96小时内分离纯化外泌体XPack外泌体的分离及添加到目的细胞中
1. 取出细胞培养基,转移到15 mL或50 mL的离心管中
2. 在1:5体积的细胞培养基中加入ExoQuick-TC
3. 倒置混合,在4°C下孵育过夜
4. 在室温或4°C下,以3000xg旋转离心管30分钟(温度不影响外泌体产量)。弃上清液,在100 uL PBS中重悬含外泌体
5. 在Nanodrop上使用A280测量外泌体的产率。调整浓度至1 μg/μL
6. 将外泌体加入到含有目标细胞的细胞培养皿中 -
将XPack蛋白克隆到XPack MCS中
1. XPack MCS有以下序列,限制性内切酶位点(XhoI、BamHI、NotI、EcoRI、NheI和PstI)以粗体和下划线表示:
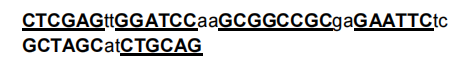
△点击放大图片
2、XPack标签在DNA序列水平上长32个的核苷酸,因此需要在ORF的5‘端添加1个核苷酸来生成frame fusion。然后,计算从MCS中初始密码子的第一个核苷酸到插入ORF结束的核苷酸的数量,并根据需要添加尽可能多的核苷酸,使数量为3的倍数。在这个数字上加1个核苷酸(生成一个in frame XPack标签),并将核苷酸的数量添加到5‘酶位点引物和ORF序列之间
3.确保任何添加的核苷酸都不会产生一个过早的终止密码子
以EcoRI 为例
从MCS开始到EcoRI位点的核苷酸数量:32
添加1个核苷酸:33个核苷酸,3的倍数
添加1个核苷酸使XPack fusion in frame
添加两个核苷酸(X)到上游PCR引物,位于EcoRI 位点和ORF priming 序列之间:5’-GAATTC-XX-ORF site -
XPack慢病毒粒子生产
1. 将XPack质粒转染到HEK293T(或等效的)产生细胞中
a) 转染前18 - 24小时,在每150mm细胞培养板中,细胞铺板(7.0-8.0x106 293T细胞),放置在培养基中,不加抗生素。到第二天,细胞的~应为80%的融合
b) 在转染当天,通过移液将LentiStarter 2.0 Kit 试剂盒中提供的45µl pPACKH1包装质粒和4.5µg XPack慢载体混合在1.6 ml无血清DMEM中
c) 在同一试管中加入55µL纯液。涡旋10秒
d) 在室温下孵育混合物15分钟。
e) 将混合物滴加入培养皿中,旋转均匀地分散在整个培养皿中
f) 转染后12小时(或第二天)换液
g) 在转染后48小时和72小时,将培养基(现在含有假病毒颗粒)收集到一个50ml无菌的、带盖的锥形离心管中。在室温下以3000 x g离心15分钟,使细胞碎片成颗粒。将病毒上清液转移到一个新的试管中
h) 浓缩假病毒颗粒

图 15 产生高滴度慢病毒颗粒的工作流程
△点击放大图片


