控制线粒体通透性来调节细胞凋亡
- 1
-
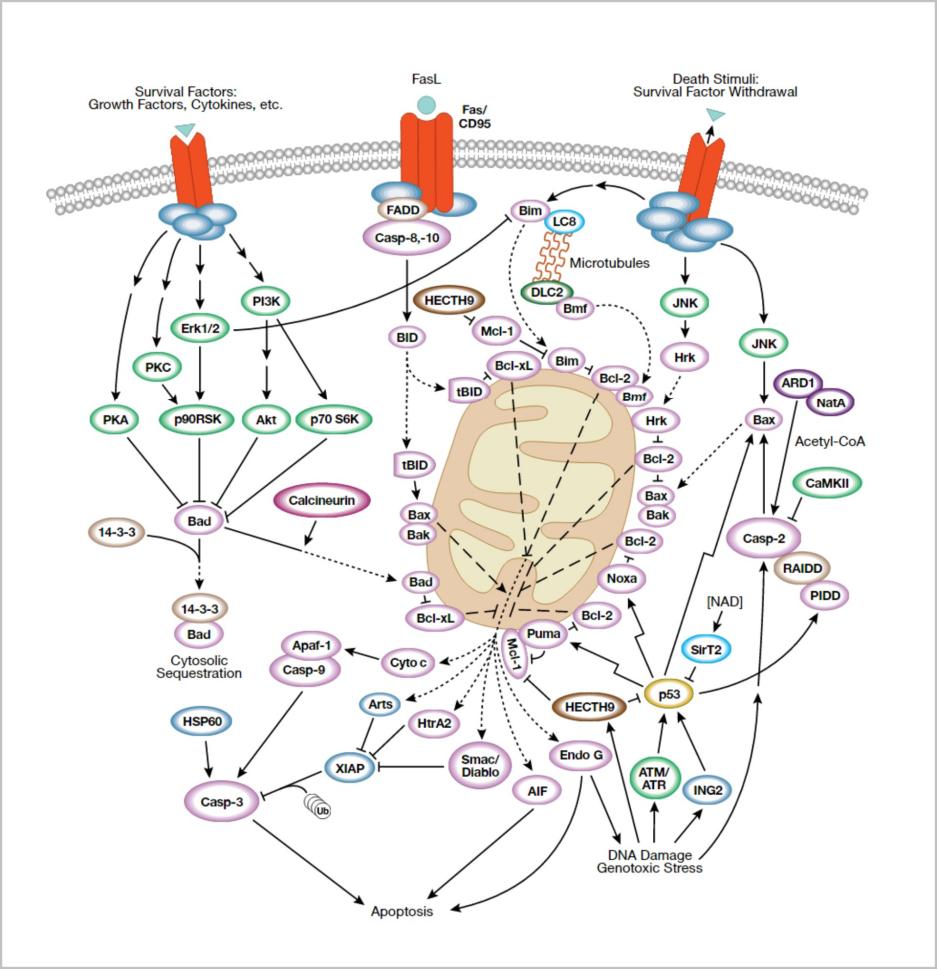
Bcl-2 蛋白家族通过控制线粒体通透性来调节细胞凋亡
抗凋亡蛋白Bcl-2和Bcl-xL驻留在线粒体外膜中,抑制cytochromec释放。
促凋亡的Bcl-2蛋白Bad、Bid、Bax和Bim可驻留在细胞质中,在接受死亡信号转导后转位到线粒体中,并在此处促进cytochromeC释放。
Bad易位到线粒体,并与Bcl-xL形成一个凋亡前复合体。
这种转位会被存活因子所抑制,该因子会诱导Bad磷酸化、导致其胞质汇集。
Caspase-8接受Fas信号转导后,剪切胞质Bid;
其活性片段(tBid)转位到线粒体中。
Bax和Bim响应死亡刺激,转位到线粒体中,存活因子也会离开。
DNA损伤后,激活的p53诱导Bax、Noxa和Puma转录。
从线粒体中释放出来后,cytochromeC与APAF-1结合,并与caspase-9形成激活复合体。
虽然线粒体膜通透性和凋亡过程中cytochromeC释放的调节机制尚未完全清楚,但已知Bcl-xL、Bcl-2和Bax可影响电压依赖性阴离子通道(VDAC),这可能对调节cytochromeC释放有一定的作用。
Mule/ARF-BP1是因DNA损伤而被激活的针对p53的E3泛素连接酶,MCL-1是BCL-2家族中的抗凋亡成员。