视频素材来源于YouTube https://www.youtube.com/watch?v=pP8oCOSp0JU
版权归原作者所有
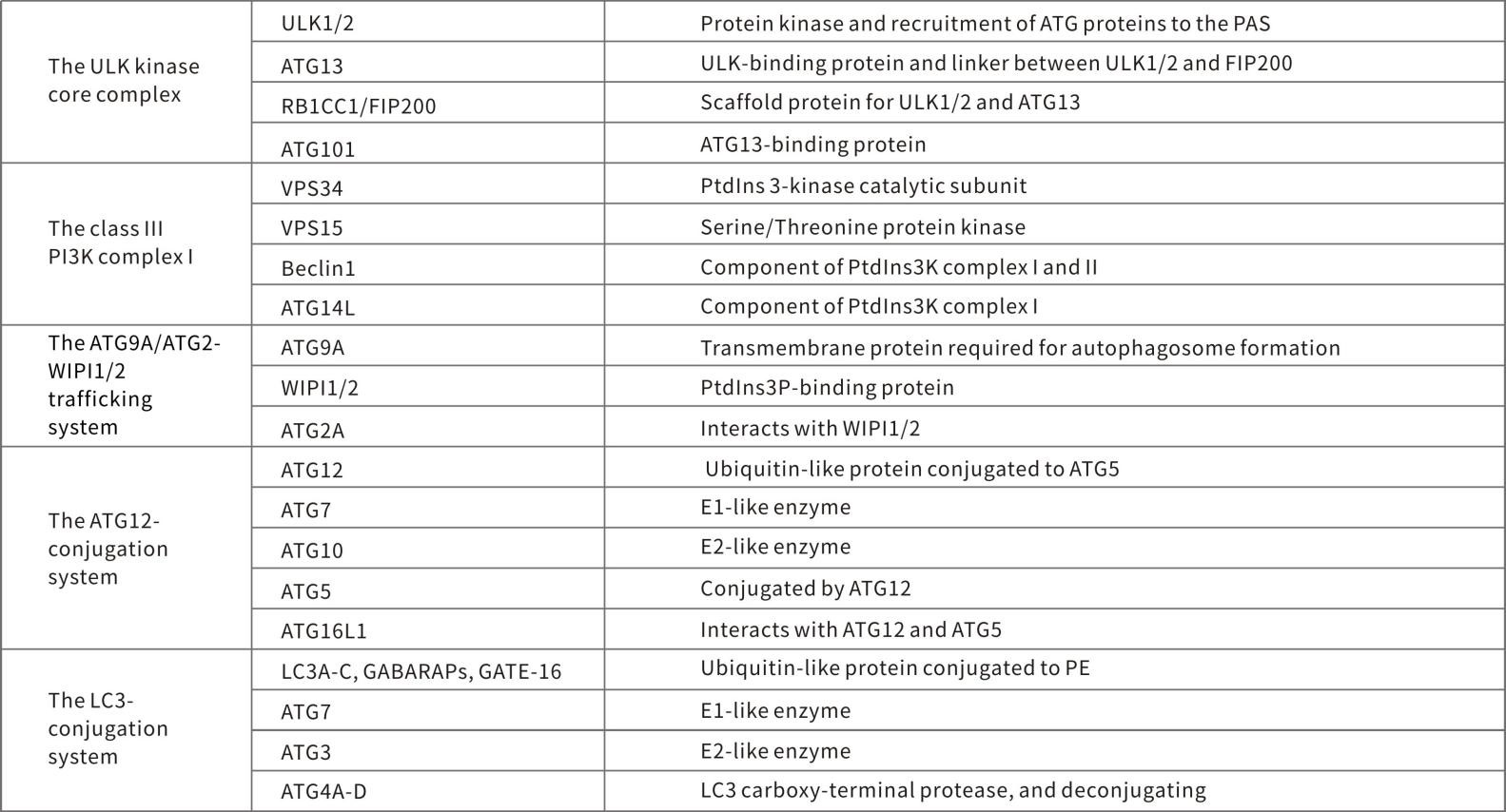
Atg 基因通过 Atg12-Atg5 以及 LC3-II (Atg8-II) 复合体,控制自噬体的形成。
Atg12 通过一个需要 Atg7 和 Atg10(分别对应 E1 和 E2 样酶)参与的泛素样反应,结合到 Atg5,Atg12-Atg5 接合后,与 Atg16 通过非共价相互作用形成一个大复合体。
LC3/Atg8被Atg4 蛋白酶在羧基端剪切后产生胞质 LC3-I。
LC3-I 也是通过一个需要 Atg7 和 Atg3(分别对应 E1 和 E2 样酶)参与的泛素样反应,结合到磷脂酰乙醇胺 (PE)。
脂质化形式的 LC3,也称作 LC3-II,附着到自噬体的膜上。
自噬与凋亡可以正向也可以负向连接,两种过程之间存在大量的交互作用。
营养缺乏时,自噬功能可看作促生存的机制;
然而,过度自噬可导致细胞死亡,这与凋亡的形态不一样。
几种促凋亡信号,如 TNF、TRAIL 和 FADD 也可以诱导自噬。
另外,Bcl-2 抑制 Beclin-1依赖性自噬,因此同时具备促生存和抗自噬调节分子的功能。

△点击放大图片

△点击放大图片
△点击放大图片
实验步骤
- 1
-
细胞自噬重要基因: Beclin-1/BCL-2
Bcl-2 和 Beclin-1 在细胞凋亡和自噬的过程中起着至关重要的调节作用。
Beclin 1是自噬关键调控蛋白之一,参与自噬体膜形成。大量研究结果指出, Beclin 1是caspase家族蛋白酶的全新底物,可被caspase剪切。剪切后的Beclin 1失去自噬调节功能,转而加剧凋亡进程。因而,Beclin 1对细胞凋亡和自噬起着重要的调控作用。
Beclin-1 最初被认为可以和 Bcl-2 家族相互作用的蛋白质,其引发自噬的作用可以被 Bcl-2 和 Bcl-XL 所抑 制。JNK1 使 Bcl-2 磷酸化,结果导致 Bcl-2 与 Beclin-1 分离诱导自噬的发生。但在长期的饥饿中,细胞不能靠启动自噬提营养物质再循环的方式促进细胞存活,同时磷酸化的 Bcl-2不能与凋亡蛋白 Bax 相互作用,从而导致细胞凋亡的发生。
只有当 Bcl-2 位于内质网中,才能抑制自噬。 Beclin-1 有一个 BH3-only 家族蛋白结合域,Bcl-2 家族中 BH3-only 蛋白都可以与之结合,导致 Beclin-1 不能诱导细胞自噬。Beclin-1 的 BH3 结构域的 119 位苏氨酸残基上有一个磷酸化位点,当 Beclin-1 磷酸化后,与 Bcl-2 的结合能力下调。凋亡相关蛋白激酶(Death-Associated Protein Kinase, DAPK)将 Beclin-1 磷酸化后,使其与 Bcl-2 解离,进而启动自噬。在某些情 况下,DAPK 可以通过与细胞骨架作用,诱导凋亡小体的产生,从而促进细胞凋亡。
在生长因子缺乏等条件下,自噬会先于凋亡发生,自噬的活化可以拮抗细胞凋亡。细胞凋亡发生后,caspase-3 的活化可以水解 Beclin-1,抑制自噬从而促进凋亡。Beclin-1 产生的N 末端片段和 C 末端片段会转移到线粒体和细胞核内。C 末端片段会导致线粒体释放细胞色素 c 以及其他促凋亡蛋白,诱导细胞凋亡进一步发生,N 末端片段的核转位的作用目前还没有阐明。因此,caspase-3 水解产生的 Beclin-1 的片段会促进细胞凋亡。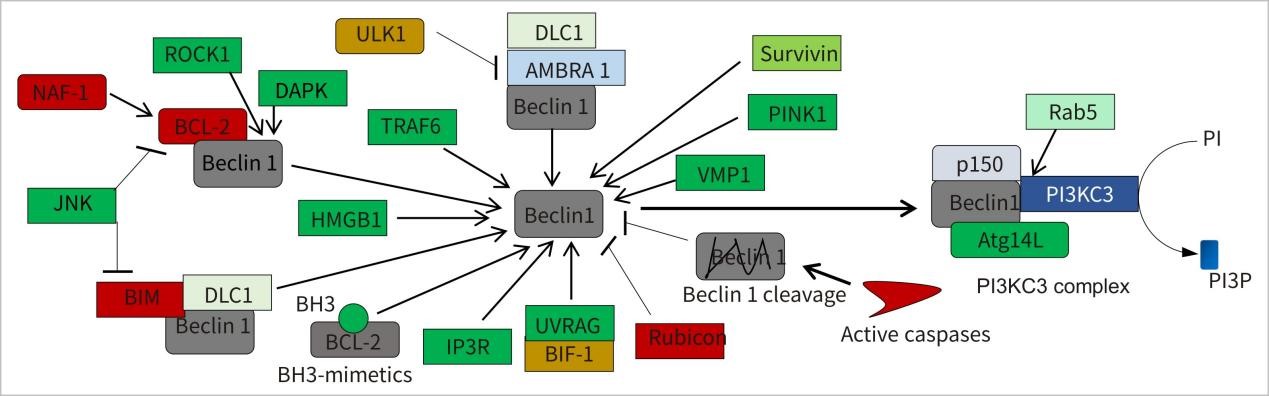
△点击放大图片



