视频素材来源于YouTube https://www.youtube.com/watch?v=YzN2WSPnvHY
版权归原作者所有
焦亡途径
- 1
- 2
- 3
-
经典焦亡途径Caspsae-1+非经典焦亡之途径Caspase-4/5/11
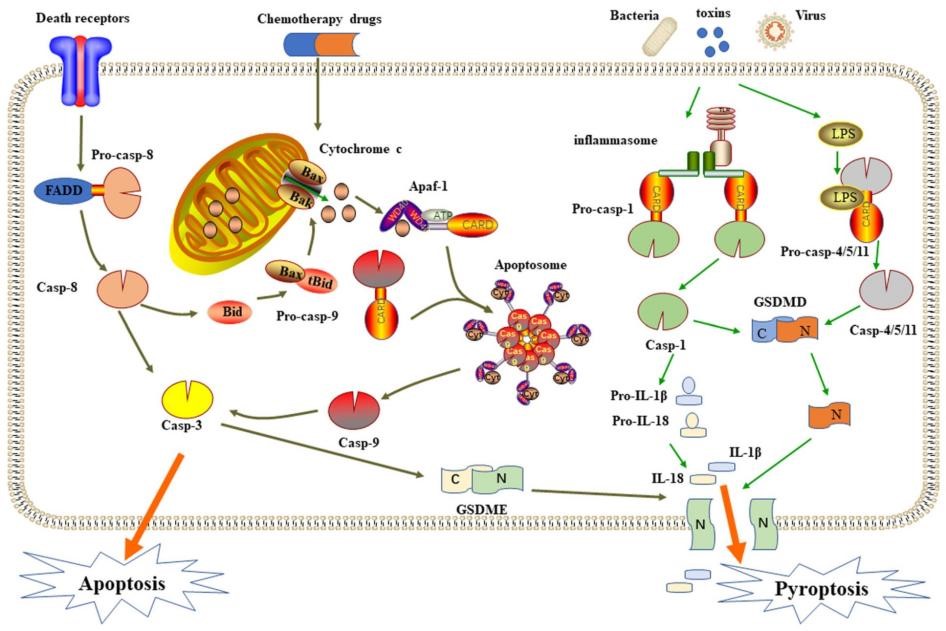
Caspase-1的激活是经典的细胞焦亡途径的核心,是抵抗病原微生物感染的一种防御机制,是天然免疫系统的重要组成部分。
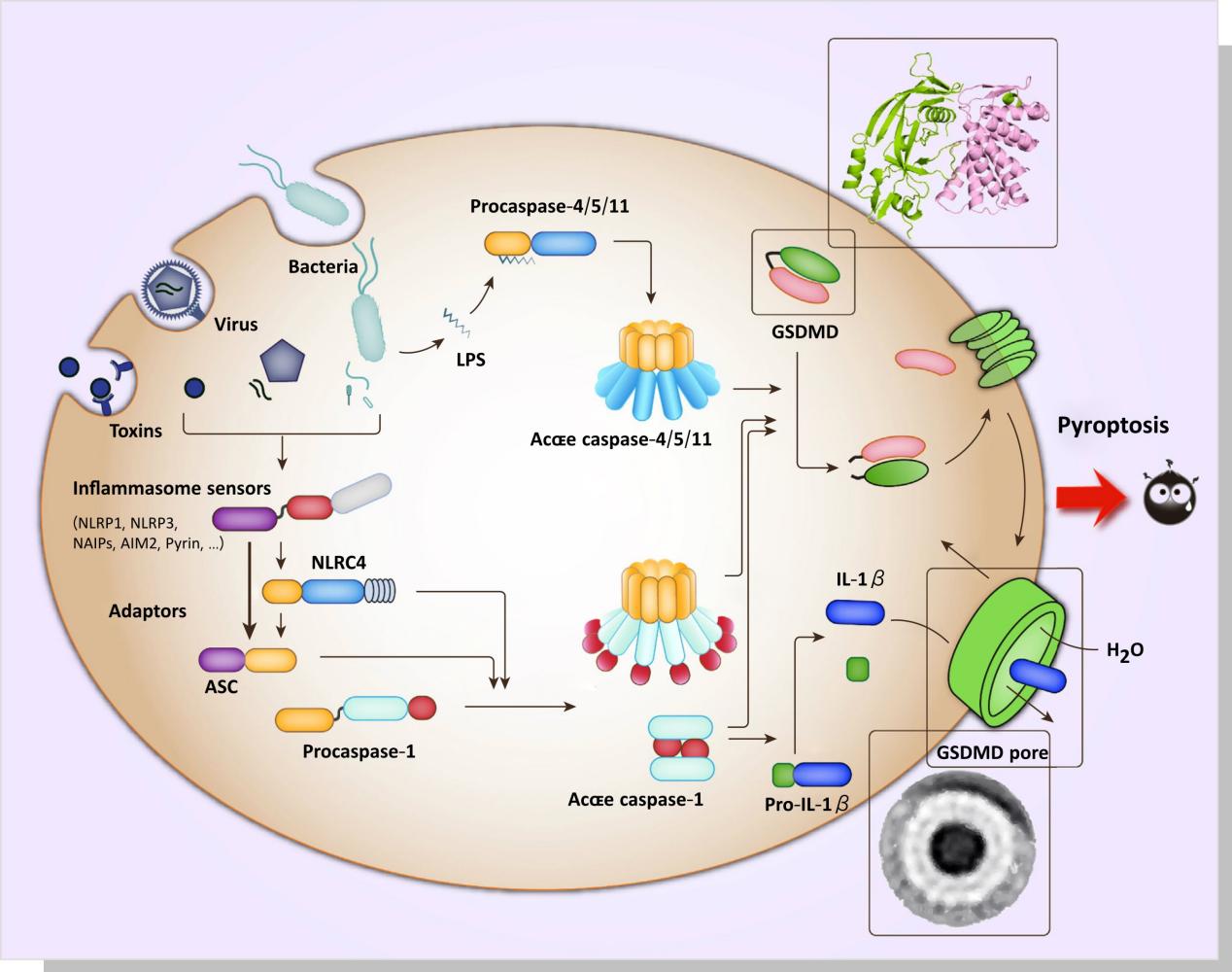
在经典的细胞焦亡途径中,细胞内PRR接受信号刺激,随后炎性小体聚集,细胞内形成大分子蛋白复合体,炎性小体的形成激活caspase-1前体。一方面,Caspase-1的激活促进了失活的IL-1β和IL-18前体的裂解,产生成熟的IL-1β和IL-18;另一方面,激活的Caspase-1作用于胃泌-D(GSDMD),并将其裂解为反应性氨基(N)端和羧基(C)端。N末端结构域具有脂质选择性,它可以与真核细胞膜特有的磷脂酰肌醇和原核细胞膜特有的果磷脂结合,后者包含磷脂酰肌肉和心脏磷脂脂质体,并在膜形成时聚合形成直径为10−20 nm的中空环状低聚物。微腔导致细胞内外失衡,导致细胞裂解死亡。同时,IL-1β和IL-18等小分子通过毛孔分泌到细胞外。此外,更多的免疫细胞被招募来触发炎症反应,最终导致细胞焦亡。

△点击放大图片
非经典的焦亡途径,通常是细胞质脂多糖(lipopoly-saccharide,LPS)直接激活Caspase-4、Caspase-5和Caspase-11介导焦亡,Caspase-4、Caspase-5和Caspase-11可以直接被细胞内革兰阴性细菌LPS刺激,以激活和水解自身的蛋白酶活性。活化的Caspase-4、Caspase-5和Caspase-11也可以作用于GSDMD并产生与Caspase-1相同的裂解作用,从而导致细胞膜穿孔。激活的Caspase-4、Caspase-5和Caspase-11在NLRP3和ASC存在下可以与Caspase-1相互作用,从而促进其激活。同样的,Caspase-1裂解IL-1β和IL-18的前体以形成活性IL-1β和IL-18,通过GSDMD-NT形成的膜通道释放并引起焦亡。与经典途径不同的是,在非经典的细胞焦亡中,仅IL-1β和IL-18前体的裂解取决于Caspase-1,GSDMD的切割则是由其他已激活的炎症性Caspases完成的。
-
Caspase-3引发的细胞焦亡
△点击放大图片
Caspase-3有多种激活机制。最常见的是在化疗药物的刺激下,线粒体通过DNA损伤释放与凋亡相关的因子,启动内源性和外源性的凋亡信号通路,导致caspase-3的激活。由于GSDME的N端和C端结构域中存在一个天然的caspase-3裂解位点,激活的caspase-3能够裂解GSDME的特定位点,释放活性的N-末端结构域,并穿透质膜诱导细胞焦亡。
-
焦亡中的重要蛋白GSDMD
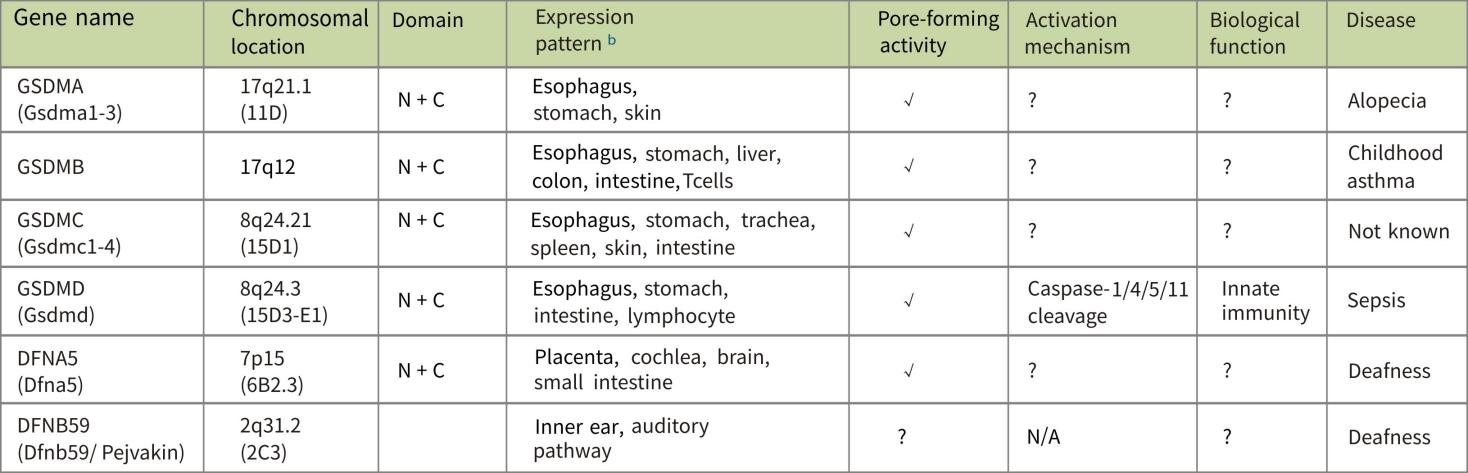
GSDMD是细胞焦亡治疗中不可缺少的物质。GSDMD在食道、胃和皮肤中表达。在人类,GSDMD由氨基末端的242个氨基酸(AA)组成,通过43-AA接头与199-AA的羧基末端相连。2015年,研究人员利用基因组筛选技术发现,GSDMD作为炎性半胱氨酸酶的底物,当被切割时会产生一个活性区域,导致膜孔形成,最终导致细胞焦亡。进一步的研究表明,炎性半胱氨酸蛋白酶激活GSDMD,并将其切割成C端抑制域和N端效应域。后者与细胞膜内侧的膜脂、细菌膜内外的磷脂酰肌醇和心磷脂特异性结合。这种脂质体选择性,使其能够诱发细胞焦亡并杀死细胞内的细菌。当N-末端结构域从细胞中释放出来时,它可以被胞外细菌激活,而不会对其他真核细胞造成损害。这种选择性活性可防止组织损伤和控制细菌感染。它是所有炎症性半胱氨酸酶的共同底物分子。
Summary of the Gasdermin Family Properties and Functions
△点击放大图片
在细胞焦亡过程中,炎症半胱氨酸蛋白酶将GSDMD裂解成GSDMD-N末端结构域和GSDMD-C末端结构域,使GSDMD-N从GSDMD-C结构域中释放出来,并与细胞膜结合。它会形成引发细胞焦亡的通道。2015年,邵峰老师实验室利用人类基因组的全基因组编辑筛选,发现了导致细胞焦亡的关键分子GSDMD。该团队进一步研究发现,GSDMD是一种代表GSDMS的家族蛋白,并宣布它已将细胞焦亡重新定义为“一种由Gasdermin家族蛋白介导的程序性细胞死亡模式”。由此可见GSDMD是细胞焦亡的关键分子。
△点击放大图片



