视频素材来源于YouTube https://www.youtube.com/watch?v=Fz_sSV-wo5I
版权归原作者所有
铁死亡的信号通路与调控
- 1
- 2
- 3
- 4
- 5
-
铁死亡的发生涉及的主要信号通路
作为新兴的死亡方式,越来越多的研究者致力于对铁死亡机制的研究。多不饱和脂肪酸是细胞膜的组成部分,并且参与调节多种生物学功能,包括炎症、免疫、突触可塑性和细胞生长。但是多不饱脂肪酸双烯丙基处的C-H键极易被氧化攻击,因此其也是铁死亡过程中的重要底物,大量积累的脂质过氧化物以及其毒性代谢物会导致细胞的死亡。在此过程中,ACSL4、脂氧合酶、芬顿反应、活性氧等的存在都会促进铁死亡的进一步发展。
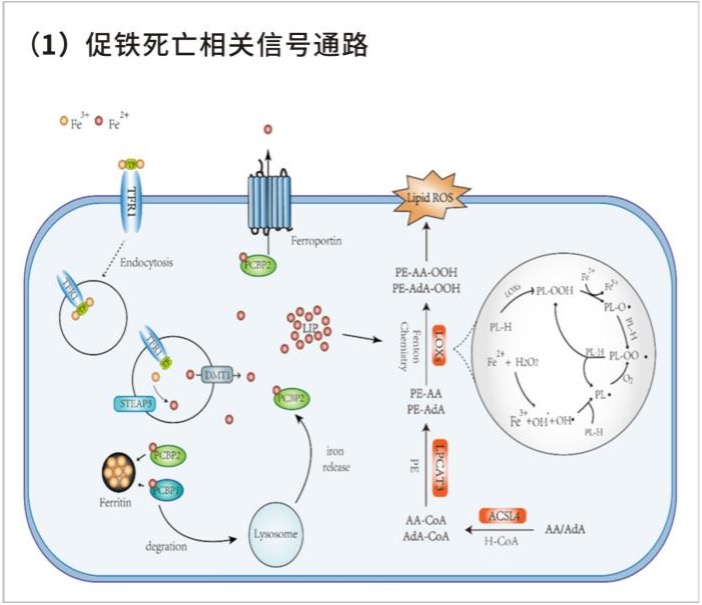
△点击放大图片
细胞存在着高效的抗氧化机制将脂质过氧化物降解形成脂质醇,以维持细胞内的氧化稳态。这个平衡是由多种氧化还原活性酶参与,涉及脂质代谢,铁代谢以及氨基酸代谢等。其中,GSH-GPX4和FSP1-CoQ10是抗铁死亡的两条主要通路。此外,机体内还存在着NRF2调控的抗氧化通路以及维他命E等内源性抗氧化物。

△点击放大图片
-
铁死亡的调控

△点击放大图片
(1)抑制GPX4诱导铁死亡:GPX4 能降解小分子过氧化物和某些脂质过氧化物,抑制脂质过氧化。研究发现,若细胞中 GPX4 表达下调则会对铁死亡更敏感;相反,若上调 GPX4 的表达,则会产生对铁死亡的耐受。因此,将GPX4抑制后将诱导细胞发生铁死亡。
(2)抑制胱氨酸谷氨酸转运受体 (systemXC-)诱导铁死亡:通过systemXC-,谷氨酸与胱氨酸以1:1比例交换,因此,谷氨酸的水平会影响到systemXC- 的功能。细胞外高浓度的谷氨酸会抑制systemXC-从而诱导铁死亡。敲除systemXC-的小鼠由于细胞外谷氨酸水平减少,可以防止神经毒性损伤。
△点击放大图片
(3)p53介导铁死亡:p53是一种抑癌基因,通过下调systemXC-组分SLC7A11的表达抑制细胞对胱氨酸的摄取,导致谷胱甘肽过氧化物酶活性降低,削减细胞抗氧化能力,增强细胞对铁死亡的敏感性。同时,研究发现,在人肿瘤细胞中SLC7A11过度表达,这种过表达能够抑制活性氧诱导的“铁死亡”,同时削弱p53KR介导的对肿瘤生长的抑制作用。

△点击放大图片
(4)ROS调控:诱导铁死亡发生均会导致细胞内脂质ROS升高,从而引起细胞死亡,这也是脂质抗氧化剂可抑制铁死亡的原因。线粒体作为含铁丰富(铁是线粒体氧化呼吸链必需离子)、ROS产生为主的细胞器,被认为是铁死亡发生的重要场所。它既是细胞内产生ROS的重要场所,其脂肪酸代谢又为细胞铁死亡提供特定的脂质前体。p53也能够通过ROS应答和"铁死亡"抑制肿瘤生长。
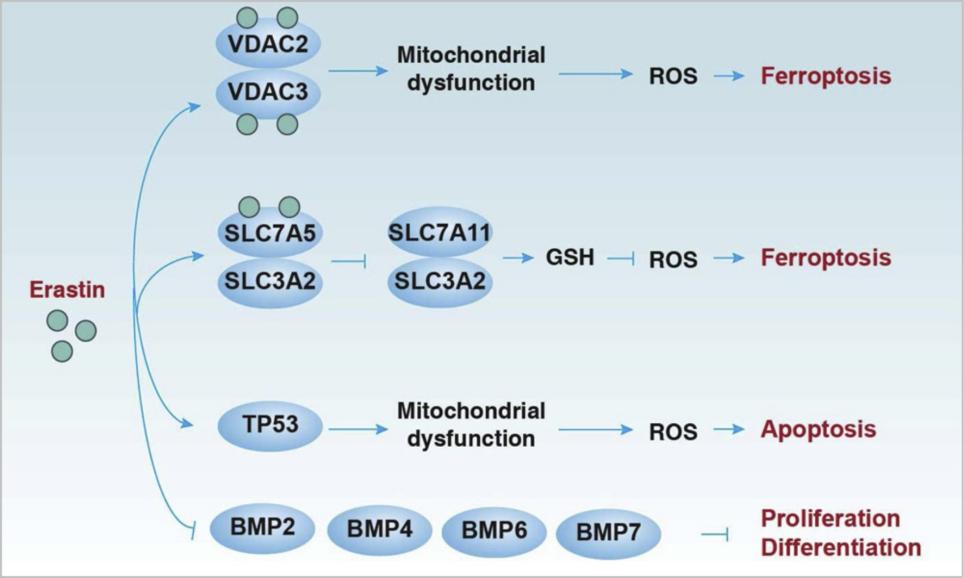
△点击放大图片
(5)Erastin在铁下垂、细胞凋亡、增殖和分化中的作用。Erastin可通过直接与VDAC2或VDAC3结合引起线粒体氧化损伤,或通过与SLC7A5结合引起谷胱GSH缺失而诱导铁下垂。在某些情况下,erastin介导的TP53上调可诱导线粒体凋亡通路。Erastin也被证明通过抑制BMP2、BMP4、BMP6和BMP7的表达,促进人外周血单个核细胞向B细胞和NK细胞的增殖和分化。
-
铁死亡的相关检测方法
特征 方法学 说明 细胞活性 CCK-8 细胞活力检测 铁水平 PGSK探针 流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料,结果表明,在铁死亡的细胞中,PGSK的绿色荧光会减弱 检测 活性 C11-BODIPY 其中COX2、ACSL4、PTGS2、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调 氧水平 铁死亡相关的蛋白 qRT-PCR/WB检测TGS2、NOX1、FTH1、COX2、GPX4、ACSL4 通过电镜或者流式细胞术,在铁死亡细胞中,探针会由红色转化为绿色 -
实验结果案例说明

△点击放大图片
Representative flow cytometry analysis of the4,4-difluoro-5-(4-phenyl-1,3-butadienyl) -4-bora-3a,4a-diaza-s-indacene-3-undecanoic acid (C11-BODIPY) fluorescence intensity (A–F) and the percentage of the relative mean fluorescence intensity of C11-BODIPY of bmMSCs.
-
WB案例
KRAS突变CRC细胞经过β-elemene和西妥昔单抗联合治疗处理,观察铁死亡相关蛋白的变化。The expression ofpositive regulatory proteins for ferroptosis (HO-1 and transferrin) and the negative regulatory proteins for ferroptosis (GPX4, SLC7A11, FTH1, glutaminase, and SLC40A1)were detected by western blotting after the treatment (β-elemene 125 µg/ml, cetuximab 25 µg/ml) for 24 h.
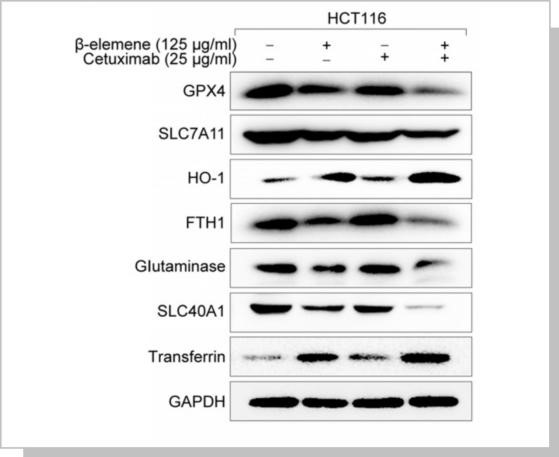
△点击放大图片

