实验步骤
- 1
- 2
- 3
-
所需试剂和耗材
· DNase stock at(12,500 U/ml)in Media199培养基 = (100X)
· 制作100μl等份的100xDNase解离液,可以直接稀释成10ml储存在-20℃。(避免反复冻融)
· 1X解离溶液
· 所需容量为每1755mm3肿瘤组织/10ml(Final 1X)
· 8.9ml of Media199培养基+ 1ml 10X胶原酶/透明质杆菌 + 100μl 100X DNase1(来自Worthington)(Final 125 U/ml)
· 培养基
· 2%胎牛血清 + 1%青霉素/链霉素 -
步骤总览
1.将患者肿瘤切成5-10块(2mm x 2mm)。在每只NSG小鼠左腹侧皮下植入肿瘤。
2.将PDX肿瘤提取、切碎并酶解成单细胞悬浮液,将单细胞悬液进行皮下注射(每只小鼠100000至250000个细胞)。
3.当PDX肿瘤约成长为80至120mm3时,每天给药。每4天测量一次。 -
具体步骤
1、 肿瘤片植入及单细胞悬液制备
a.收集患者肿瘤组织。(应在1–4小时内处理样品,以保持细胞活力)
b.在层流罩中,将患者肿瘤于培养皿中切成2 x 2mm的小块(收集5至10)。每只小鼠植入一块。向培养皿中加入无菌PBS以防止组织干燥,用石蜡膜密封培养皿并置于冰上。
c.小鼠侧卧,将泪液凝胶放在眼睛、打耳洞的老鼠身上,以便识别,使用电动剪子刮除左(或右)侧面的毛以进行植入。
d.在与中线成45度角的情况下,用剪刀在膝盖和脊柱中间做一个0.5厘米的切口。
e.单手用弯曲标本钳将切开的皮肤向上拉起,用直标本钳将皮肤从腹壁向腿部钝剥,形成一个口袋。
f.使用同样的直钳将肿瘤碎片放入袋中。确保肿瘤进入口袋。用弯曲的镊子把切开的皮肤缝合起来。
g.缝合伤口将小鼠放回。
h.第二天观察老鼠确保缝合效果。
i.2周至6个月后触诊肿瘤生长,如果没有肿瘤可触及或移植瘤达到允许的最大尺寸(直径15mm或1755mm3),终止实验,取出肿瘤。
△点击放大图片
2、 PDX肿瘤的提取和分离成单细胞悬浮液(消化步骤)
a.将取出的肿瘤置于含有无菌PBS的15毫升锥形离心管中,置于冰上。(样本量不应大于1755mm3/10ml,若需要更多细胞量可将获得同一患者肿瘤的5-10小鼠的组织混合)
b.图4将肿瘤组织切碎加入1X解离液10ml。与解离液充分混匀。放置在组织培养箱(37℃,5%CO2)中15min。
c.用25毫升的吸管轻柔地上下抽吸混合物几次,然后用10ml血清移液管,以帮助分离过程,并将其放回培养箱。
d.每15分钟抽吸一次,持续3小时,直到获得均匀的溶液。(不要将组织孵育超过3小时,因为细胞活力会随着分离时间的延长而降低)
e.分离完成后,将70mm的滤网放入50ml的锥形管中,将10ml的细胞悬液通过滤网。
f.加入10毫升IMDM(+ 10%FBS)清洗过滤器。
g.将收集到的细胞悬300g离心5分钟。 加入1ml预冷的ACK裂解缓冲液(用于裂解血细胞),并在冰上孵育不超过5分钟。(不要用ACK溶解缓冲液将细胞孵育超过5分钟)
h.加入10ml PBS洗净,再次离心300g 5分钟。
i.在10ml PBS中重悬细胞,并使用台盼蓝计数活细胞的数量。
j.这些细胞现在可以注射到小鼠体内或进行低温保存。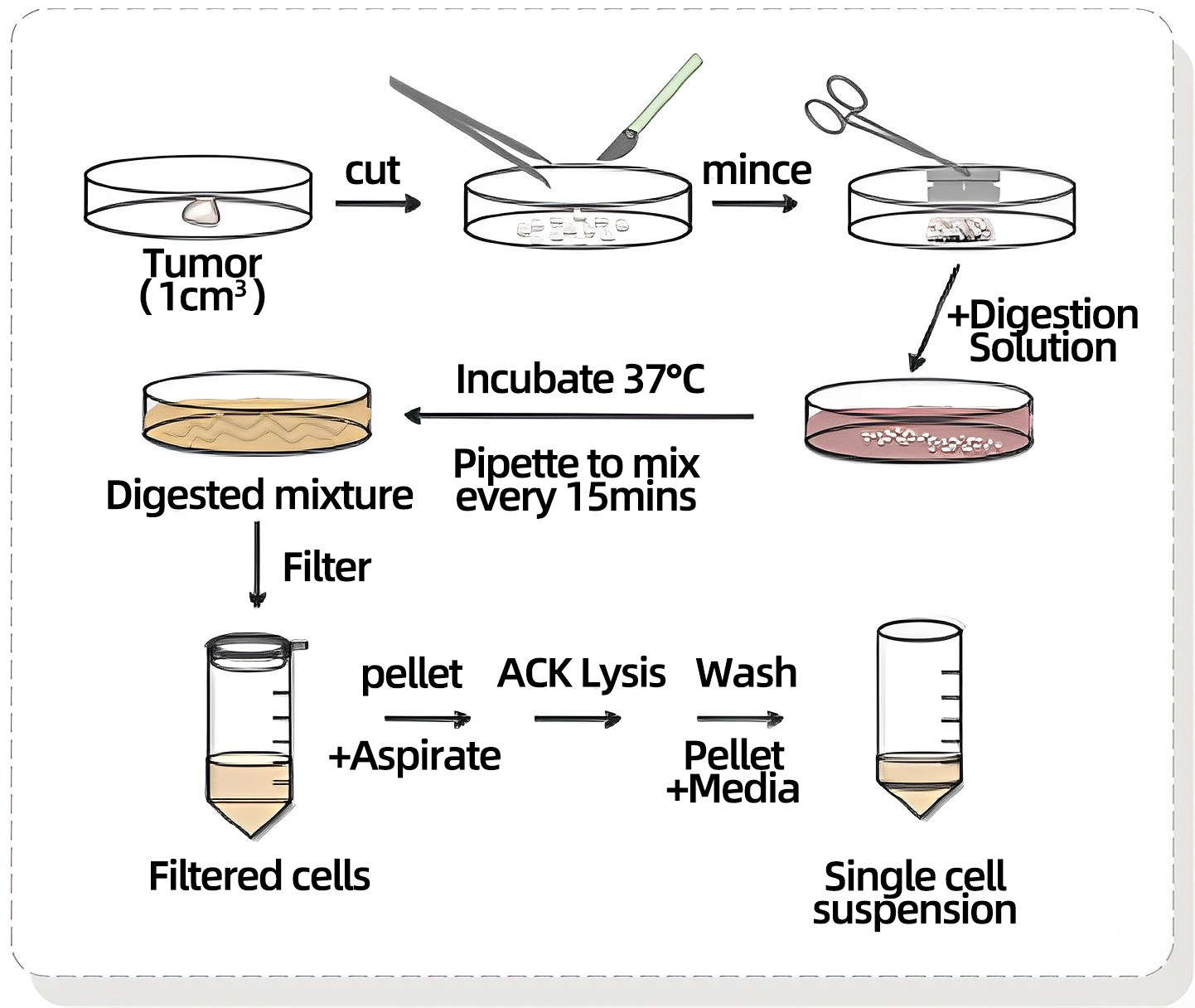
△点击放大图片
3、 肿瘤单细胞悬液注入NSG小鼠
a.准备大量新鲜的肿瘤细胞悬浮液或解冻一小瓶以前冷冻保存的细胞。
b.计算在PBS中悬浮的细胞总数,并确定至少10只小鼠每只小鼠注射的细胞数量至少10万到25万个细胞以确保所有小鼠的移植,并达到均匀的生长速度。(一些肿瘤可能需要更高的细胞数量(即40万到50万)。
c.预冷的基底胶与细胞悬液在冷PBS中以1:1的比例混合。
d.每只小鼠注射100ml注射液(50ml注射液 + 50ml细胞悬液)。
e.为了减少差异,准备细胞和基底胶在一个试管中进行所有10次注射。
f.每只小鼠左侧皮下注射100毫升。


