视频素材来源于YouTube https://www.youtube.com/watch?v=RDrbqGL0HjQ
版权归原作者所有
以下部分内容引用自 BD
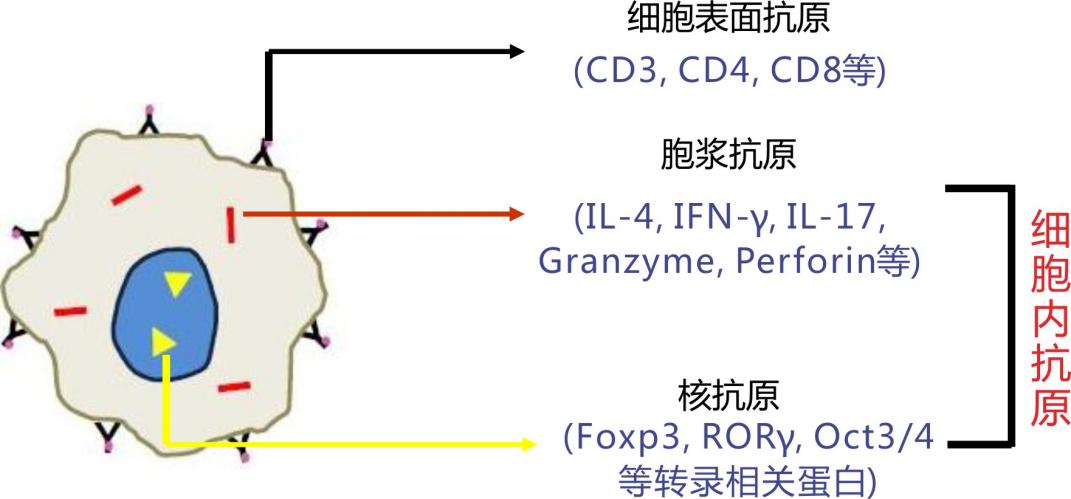
细胞内抗原/细胞因子染色
△点击放大图片
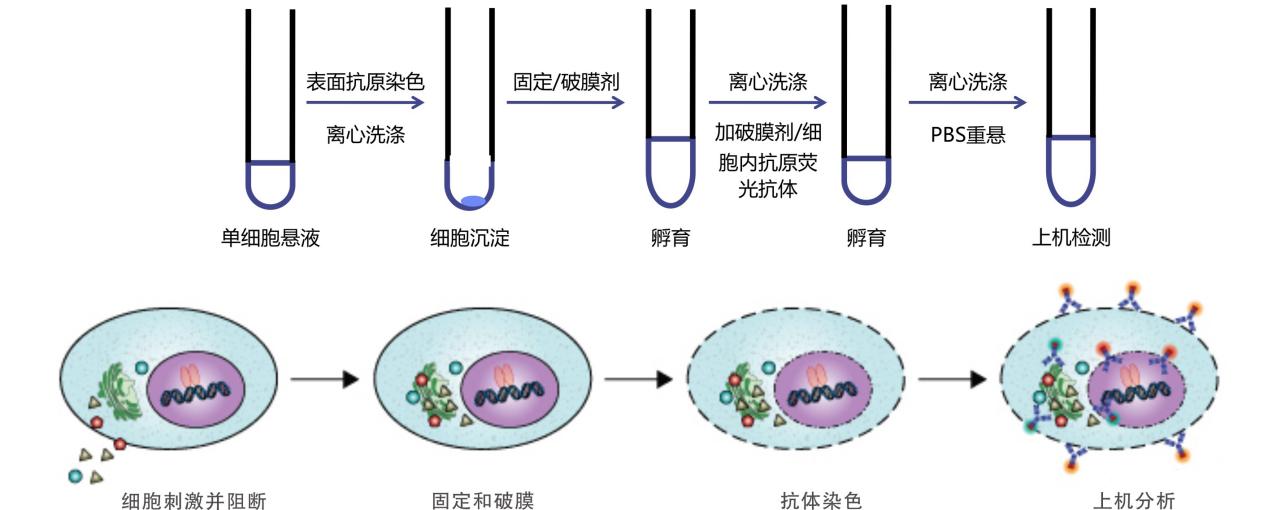
△点击放大图片
实验流程Protocol
- 1
- 2
-
刺激细胞
体外刺激细胞因子的产生有很多种方法。多克隆抗体激活剂在诱导细胞因子产生过程中尤为重要。此类激活剂主要包括以下物质:佛波酯加钙离子载体或离子霉素,植物凝血酶,葡萄球菌肠毒素B,以及直接针对TCR/CD3复合物的单克隆抗体(加或不加针对共刺激受体如CD28 的抗体)。
注意:已报道单独的PMA刺激会导致小鼠T细胞表面CD4的表达降低。PMA与钙离子载体共同刺激则使CD4表达降低更多,同时也会导致小鼠CD8胸腺细胞及小鼠和人外周血T淋巴细胞减少。
1.)使用BD GolgiStop™蛋白转运抑制剂(含莫奈霉素)的操作步骤。
每6ml细胞培养基中加入4μl BD GolgiStop™并充分混匀。 BD GolgiStop™在培养基中不应超过12小时。
2.)使用BD GolgiPlug™(含布雷菲德菌素A) 蛋白转运抑制剂(含BSA)的操作步骤。
每1ml细胞培养基中加入1 μl BD GolgiPlug并充分混匀。BD GolgiPlug在培养基中不应超过12小时。BD GolgiPlug™中含有 DMSO,4°C时会结晶为固体。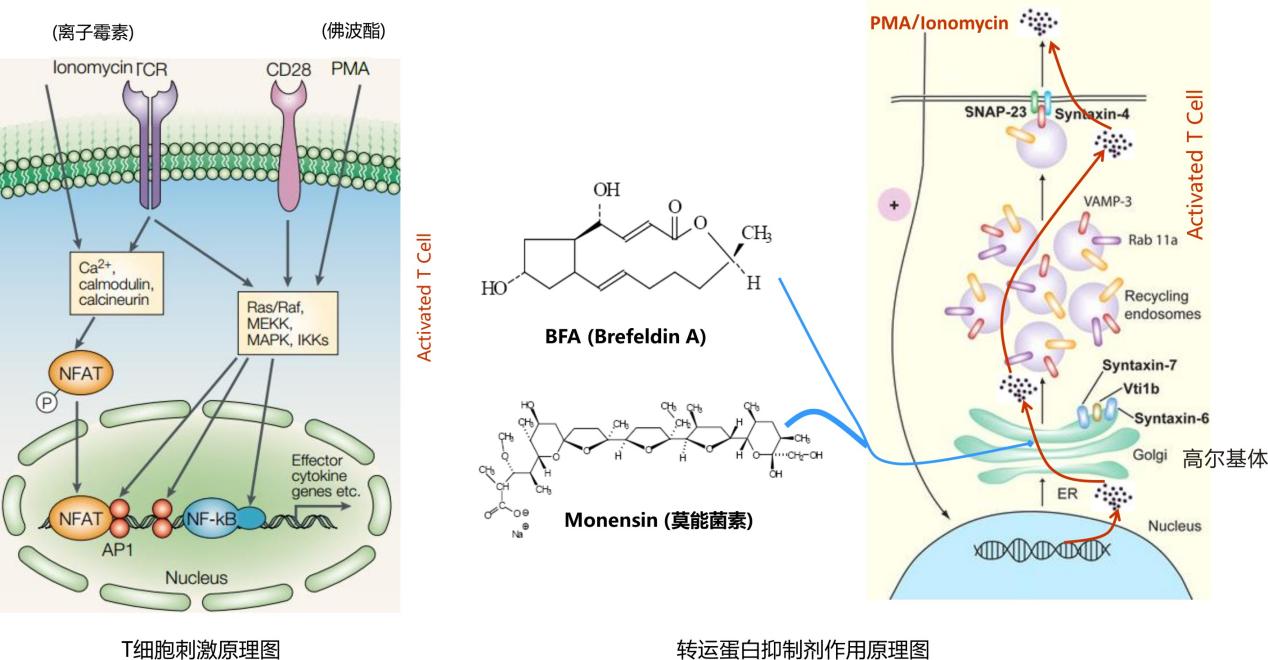
△点击放大图片
不同细胞因子对应的阻断方式:Species Cytokines Transport Inhibitor Human IL-1α, IL-6, IL-8, TNF-α Monensin Human IFN-γ, IL-2, IL-10, IL-12, MCP-1, MCP-3, MIG, MIP-1α, RANTES Monensin or Brefeldin A Mouse IL-6, IL-12, TNF-α Brefeldin A Mouse GM-CSF, IL-3, IL-4, IL-5, IL-10 Monensin Mouse IFN-γ, IL-2 Monensin or Brefeldin A -
样本处理:细胞表面及胞内因子的多色染色
1. 细胞培养
用蛋白转运抑制剂体内刺激组织样本或者体外刺激培养基细胞以制备活的细胞群。细胞分离后重悬于染色培养基中,计数并转移至免疫荧光染色的塑料管或微孔板中。在染色及储存过程中细胞需避光保存。
2.阻断Fc受体:阻断Fc受体的试剂可降低非特异性免疫荧光染色。a.小鼠中,用特异性针对FcγII/III受体的2.4G2纯化抗体(BD FcBlock™,货号:553142)封闭荧光抗体Fc受体引起的非特异性染色。在100μl Staining Buffer(货号:554656)中加入1 μg BD Fc Block/10^6细胞,4°C孵育15分钟。随后清洗细胞,加入细胞表面抗原的特异性荧光抗体(提前用stain buffer 适当稀释)。
b. 对于人类细胞,可提前将细胞与人血清或过量的同种属不相关纯化Ig共同孵育,并加入同型对照以阻断Fc受体。
c. 大鼠中,用特异性针对FcgII 受体的D34-485纯化抗体(BD Fc Block™,货号:550270或550271)阻断荧光抗体Fc受体介导的非特异性结合。10^6细胞重悬于100μl Staining Buffer(货号:554656)中,加入1 μg BD FcBlock,4°C孵育15分钟。随后清洗细胞,加入细胞表面抗原的特异性荧光抗体(提前用stain buffer适当稀释)。
3. 细胞表面染色a.用50μl Staining Buffer重悬10^6细胞,加入适量的特异性单克隆荧光抗体,如CD3、CD4,CD4,CD14,CD19等,4°C孵育30分钟。
b. 加入适量Staining Buffer清洗细胞2次 (微孔板 250 μl/次,试管1ml/次),250g离心细胞。
c. 对于人类细胞,可提前将细胞与人血清或过量的同种属不相关纯化Ig共同孵育,并加入同型对照以阻断Fc受体。
4. 细胞固定、破膜a. 充分重悬细胞,加入适量(微孔板100μl/孔,试管250μl/管)Fixation/Permeabilization solution,4°C孵育20分钟。
注意:加入Fixation/Permeabilization solution 之前vertex振荡混匀以避免细胞聚集b. 用1× BD Perm/Wash™ buffer清洗细胞2次 (微孔板 250 μl/次,试管1ml/次)。
5.(选择性)细胞固定、破膜,细胞固定后可保存一段时间继续染色a. 细胞固定与保存
1.) 100μl 4%多聚甲醛(或1 ml/10^7 细胞)重悬细胞,4°C孵育10-20分钟。
2.) Staining Buffer清洗细胞2次。
3.) Staining Buffer 重悬细胞, 4°C 保存72 小时;或用90% FCS/10% DMSO重悬细胞, -80°C长久保存。b.对已固定的细胞进行破膜
1.)对于冻存细胞,清洗2次去除DMSO。对于4°C保存的细胞,离心后去除staining buffer。
2.)将细胞重悬于BD Perm/Wash™ buffer ,孵育15 分钟。
3.)离心去上清。
4.)胞内因子染色。
6. 胞内因子染色a. 取适量细胞因子荧光抗体或阴性对照,用BDPerm/Wash™ buffer稀释至50 μl。用此抗体稀释液充分重悬已固定破膜的细胞,4°C避光孵育30分钟。
b. 1× BD Perm/Wash™ buffer (微孔板 250 μl/次,试管1ml/次)清洗细胞2次,然后用Staining Buffer重悬,上流式细胞仪检测。



