如下操作步骤以产品货号333502的步骤为例,产品列表详见右下方推荐产品
实验步骤
- 1
- 2
- 3
- 4
-
碎片、末端修复和A-addition
开始前的要点
· 该方案涵盖了从“标准 DNA ”(即细胞或组织)、 FFPE DNA 和 cfDNA 制备 Illumina 测序仪文库所需的所有程序。
· 在建立反应之前,准确测定输入 DNA 的量至关重要(标准 DNA 或 cfDNA 为 10-80 ng ;如果使用了 QIAseq QuantiMIZE 试剂盒,则最多可以使用 250 ng FFPE DNA 。如果使用替代方法测定 FFPE DNA 的浓度,则最多可以使用 100 ng DNA )。可以降低输入量;然而,这将导致更少的测序UMI和降低变体检测灵敏度。
· 在冰上设置反应。
· 不要涡旋任何试剂或反应。
程序: 碎片、末端修复和 A- 添加
1. 在冰上解冻核酸样品。轻轻混合,短暂离心以收集管侧的残余液体,然后放回冰中。
2. 制备碎片、末端修复和 A- 添加所需的试剂。
2a:解冻碎片缓冲液, 10倍 ; FERA 溶液;和 FG 溶液(如果需要)在室温下,但在解冻后放在冰上。
2b:轻弹试管进行混合,然后短暂离心。
注意: 碎裂酶混合物应在使用前从冰箱中取出,并放置在冰上。使用后,立即将酶放回冰箱。
3. 在冰上,根据 表6 制备碎裂、末端修复和 A 加成混合物。短暂离心,上下吹打 7-8 次 混合,然后再次短暂离心。注意: 一般而言,增加 DNA 输入量将提高变异检测灵敏度——尤其是对于 FFPE DNA 。有关详细信息,请参见 ( QIAGEN 官网货号为 333502 的产品完整说明书进行了解)
Component Volume/reaction (standard, FFPE or pure cfDNA) Volume/reaction (cfDNA contaminated with cellular DNA) DNA* Variable Variable Fragmentation Buffer, lOx 2.5 μl 2.5 μl FERA Solution 0.75 μl 0.75 μl FG Solution - 1.25 μl Nuclease-free Water Variable Variable Total 20 μl 20 μl 表6:碎片、末端修复和A-添加的反应混合物
*标准 DNA 或 cfDNA 为 10-80 ng 。如果使用 QIAseq QuantiMIZE 试剂盒,则使用高达 250 ng 的 FFPE DNA ;如果使用替代方法,则使用高达 100 ng 的 FFPE DNA
4. 向每个反应中添加 5µl 裂解酶混合物。短暂离心,通过上下移液管混合 7-8次 (不要涡流),然后再次短暂离心。重要事项: 在整个反应过程中,将反应管/板置于冰上。
5. 根据 表7对热循环器进行编程。使用仪器的加热盖。Step Incubation temperature Incubation time (standard DNA) Incubation time (FFPE DNA) Incubation time (dDNA) 1 4℃ 1 min 1 min 1 min 2 32℃* 24 min 14 min 14 min 3 72℃ 30 min 30 min 30 min 4 4℃ Hold Hold Hold
表7.碎裂、末端修复和A-加成的循环条件*
*对于 Human Mitochondria Panel ,标准 DNA 和 FFPE DNA 均在 32°C 孵育 8 分钟
6. 在将管/板添加到热循环器之前,启动程序。当热循环器达到 4°C 时,暂停程序。重要事项: 热循环器必须预冷,并在 4°C 时暂停。
7. 将 步骤 2 中准备的管/板转移到预冷的热循环仪并恢复循环程序。
8. 完成后,让热循环仪恢复到 4°C 。
9. 将样品放在冰上,立即执行“方案:适配器连接”。 -
适配器连接
开始前的要点
· 碎片、末端修复和 A- 添加”中的 25µl 产品是本方案的起始材料。
· 在冰上设置反应。
· 不要涡旋任何试剂或反应。
· 重要提示:QIAseq 96 Unique Dual Index Set 转接板( UDIN-96#A ):转接连接反应中使用的 A 或 B 必须与匹配的 QIAseq 96 Unique Dual Index Set ( UDIS-96#K )引物板配对:通用 PCR 扩增反应中使用的 A 或 B 。
程序: 适配器连接
1. 准备 DNA 连接所需的试剂。
1a:在室温下解冻连接缓冲液 5x 和连接溶液,但解冻后放在冰上。
1b:通过轻弹试管混合,然后短暂离心。
注意:DNA 连接酶 应在使用前从冰箱中取出并放在冰上。使用后,立即将酶放回冰箱。
2. 根据 表8 制备适配器连接混合物。短暂离心,上下移液混合 10-12次 ,再次短暂离心。重要提示: 每个连接反应只能使用一个单索引衔接子。 图4 中描述了 QIASEQ 96-UNIQUE 双索引集适配器布局;在使用多通道移液管吸取适当数量的适配器之前,使用多通道移液管刺穿箔片。如果使用 QIASEQ 12Index I 适配器,则一次打开一根适配器管,避免交叉污染。对于平板中提供的 QIASEQ 96-Index I 适配器(布局如 图7 所示)。
重要提示: 缓慢吸取以混合。反应混合物非常粘稠。不要涡旋。注意: 如果设置一个以上的反应,则制备比反应总数所需的体积大 20% 的主混合物。
Component Volume/reaction Standard DNA FFPE DNA cfDNA Frogmentation, end-repair, and A-addition reaction (already in tube) 25 μl 25 μl 25 μl Ligation Buffer, 5x 10 μl 10 μl 10 μl UDIN-96#A or IL-N7## or IL-7##NJ or UDIN-8#A adapter* 2.8 μl 2.8 μl 0.5 μl DNA Ligase 5 μl 5 μl 5 μl Ligation Solution' 7.2 μl 7.2 μl 7.2 μl Nuclease-free Water - - 2.3 μl Total 50 μl 50 μl 50 μl 表 8. 适配器连接的反应混合物
↑: 适用于 QIAseq 96-Unique Dual Index Set A 或 B 或 IL-N7## 组件的 UDIN-96#A 适用于 QIAseq 12-Index I 最多 12 个 样本索引的适配器;或带有 QIAseq 96-Index I A、B、C 或 D 组 ( CDI ) 的 IL-7##NJ 适配器;或 UDIN-8#A 用于 QIAseq 8-Unique Dual Index Set A 或 B 。注: 连接溶液非常粘稠。它应该单独添加到每个反应中,而不是与其他组分预混合作为主混合物。不要用连接溶液涂在移液器吸头的外部,否则可能会添加过多的体积。

图 4. 可刺穿的 QIAseq 96-Unique Dual Index Set Adapter Plate 布局。 QIAseq 96-Unique Dual Index Set A (96) 布局 (NQDIB001-NQDIB096) 和 QIAseq 96-Unique Dual Index Set B (96) 布局 (NQDIB097NQDIB192)。△点击放大图片
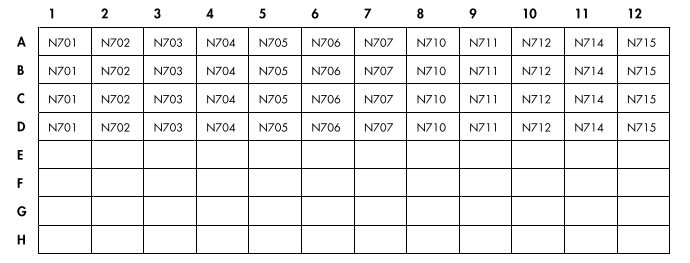
QIAseq 96索引I集合A或C集合中的IL-701NJ转接板△点击放大图片
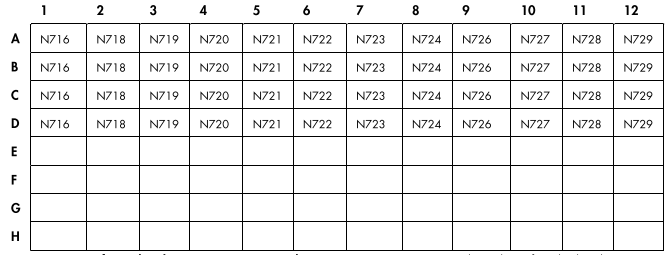
QIASEQ 96-索引I套件B或D套件中的IL-716NJ转接板△点击放大图片
图 5. QIAseq 96-Index I Set A、B、C 或 D 中样品接头的布局。每个板的 A 到 D 行都有接头。 E 到 H 行是空的。 每行每个孔包含一个样品接头,每个孔中的接头数量足以容纳 8 个样品。
3. 根据 表9 在热循环器中孵化反应。重要提示: 不要使用加热盖。
Step Incubation temperature Incubation time 1 4℃ 1 min 2 20℃ 15 min 3 4℃ Hold
表 9. DNA 连接的孵育条件
4. 运行完成后,对于标准 /FFPE 样品,添加 50 µl 无核酸酶水使每个样品达到 100 µl 。 对于 cfDNA 样本,添加 30 µl 无核酸酶水,使每个样本达到 80 µl 。
5. 对于标准 /FFPE 样品,添加 100µL Qiaseq 微珠。对于 cfDNA 样品,添加 112µL Qiaseq 珠子。用移液管上下移动几次,充分混合。
6. 在室温下孵育 5分钟 。
7. 将管/板放在磁架上 10 分钟 。溶液清除后,磁珠仍在磁架上,小心取出并丢弃上清液。重要提示: 不要丢弃珠子,因为它们含有感兴趣的 DNA 。
8. 将珠子仍放在磁性支架上,添加 200µl 80% 乙醇。小心地取出并丢弃清洗液。
9. 重复乙醇清洗。重要提示: 第二次清洗后完全清除所有微量乙醇。首先用 200µl 移液管除去乙醇,然后用 10µl 移液管除去任何残留的乙醇。
10. 磁珠仍在磁力架上,在室温下风干 10 分钟 。注意: 目视检查颗粒是否完全干燥。
11. 从磁性支架上取下珠子,并通过添加 52µl 无核酸酶水从珠子中洗脱 DNA 。通过移液管充分混合。
12. 将试管/板放回磁性支架,直到溶液清除为止。13. 将 50µL 上清液转移到干净的试管/板中。
14. 对于标准 /FFPE 样品,添加 50 µl QIAseq Beads (对于 Human Mitochondria Panel ,使用 35 µl )。对于 cfDNA 样本,添加 70 µl QIAseq Beads 。通过上下吹打数次充分混合。15. 在室温下孵育 5分钟 。
16. 将试管/板放置在磁架上 5分钟 (试管)或 10分钟 (板)。溶液澄清后,磁珠仍在磁性支架上,小心取出并丢弃上清液。重要提示: 不要丢弃珠子,因为它们含有感兴趣的 DNA 。
17. 将珠子仍放在磁性支架上,添加 200µl 80% 乙醇。小心地取出并丢弃清洗液。
18. 重复乙醇清洗。 重要提示: 第二次清洗后完全清除所有微量乙醇。首先用 200µl 移液管除去乙醇,然后用 10µl 吸液管除去任何残留的乙 醇。
19. 将小球仍放在磁性支架上,在室温下风干 15分钟 。 注意: 目视检查小球是否完全干燥。乙醇携带到目标富集 PCR 步骤将影响富集 PCR 效率。从磁性支架上取下珠子,并通过添加 12µl 无核酸酶水从珠子中洗脱 DNA 。通过移液管充分混合。
20. 将试管/板放回磁架,直到溶液清除。
21. 将 9.4µl 上清液转移到干净的管或板中。
22. 继续执行“方案:目标浓缩”。或者,样品可在 −30至−15°C 的恒温冰箱中储存最多 3天 。 -
目标富集
1. 准备目标富集所需的试剂。
1a: 解冻 TEPCR 缓冲液, 5x ; QIAseq 靶向 DNA 面板;和 IL-Forward Primer 在室温下,解冻后放在冰上。
1b: 轻弹试管混合,然后短暂离心。注意: HotStarTaq DNA 聚合酶应在使用前从冰箱中取出并置于冰上。使用后,立即将酶放回冰箱。根据 表 10 制备目标富集混合物。短暂离心,上下吹打 7-8 次 混合,然后再次短暂离心。
Component Volume/readion Sample (from wProtocol: Adapter Ligation") 9.4μl TEPCR buffer, 5x 5μl QIAseq Targeted DNA Panel 5μl IL-Forward primer 0.8μl HotStarTaq DNA Polymerase 0.8μl Total 20μl
表10.目标浓缩的反应混合物
2. 使用 表11 (底漆/管 <1500 的面板)或 表12 (底漆/管 <1500 的面板)中的循环条件编程热循环器 ≥1500 个底漆/管)。Step Time Temperature Initial denaturation 13 min 95℃ 2 min 98℃ 8 cycles 15 s 98℃ 10 min 68℃ 1 cycle 5 min 72℃ Hold ∞ 4℃
表11.如果引物数量<1500/管,则目标富集的循环条件Step Time (1500-12,000 primers/tube) Time (>12,000 primers/tube) Temperature Initial denaturation 13 min 2 min 13 min 2 min 95℃ 98℃ 6 cycles 15s 15 min 15s 30 min 98℃ 65℃ 1 cycle 5 min 5 min 72℃ Hold 8 8 4℃
表12.如果引物数量增加,目标富集的循环条件≥1500/管
3. 将目标富集反应置于热循环仪中,并开始运行。
4. 运行完成后,对于标准 /FFPE 样品,添加 80µl 无核酸酶水,使每个样品达到 100µl 。对于 cfDNA 样品,添加 7 0µl 无核酸酶水,使每个样品达到 90µl 。
5. 对于标准 /FFPE 样品,添加 100µl QIAseq 珠子(对于人线粒体面板,使用 70µl )。对于 cfDNA 样本,添加 108µl QIAseq 珠子。用移液管上下数次搅拌均匀。
6. 在室温下孵育 5分钟 。
7. 将管/板放在磁架上 5 分钟 (用于管)或 10 分钟 (用于板)。溶液澄清后,磁珠仍在磁架上,小心取出并丢弃上清液。重要提示: 不要丢弃珠子,因为它们含有感兴趣的 DNA 。
8. 将珠子仍放在磁性支架上,添加 200µl 80% 乙醇。小心地取出并丢弃清洗液。
9. 重复乙醇清洗。重要提示: 第二次清洗后完全清除所有微量乙醇。首先用 200µl 移液管除去乙醇,然后用 10µl 吸液管除去任何残留的乙醇。
10. 将小球仍放在磁性支架上,在室温下风干 10分钟 。注意: 目视检查小球是否完全干燥。乙醇带入下一个通用 PCR 步骤将影响 PCR 效率。
11. 从磁性支架上取下珠子,并通过添加 16µl 无核酸酶水从珠子中洗脱 DNA 。通过移液管充分混合
12. 将管/板放回磁性支架,直到溶液清除为止。
13. 将 13.4µL 上清液转移至干净的试管/板中。
14. 继续执行第 41页 的“方案:通用 PCR ”。或者,样品可在 −30至−15°C 的恒温冰箱中储存最多 3天 。 -
用于 Illumina® NGS 系统的 DNA 超灵敏靶向二代测序 (NGS)
开始前的要点
· 在 Illumina 平台上进行测序时,必须使用 QIAseq A Read1 Primer I ( Custom Read 1 Sequencing Primer )。
· Illumina 平台上的 QIAseq Targeted DNA Panel 应使用双末端测序。
· 为了使测序准备更加方便,请从 www.qiagen.com 的 QIAseq Targeted DNA Panel 的 Product Resources 选项卡中下载适用于不同测序仪器的 Illumina 兼容样品表。
使用 QIAseq 96-Unique Dual Index Sets 对 MiSeq 进行测序准备1. 使用 QIAseq Targeted DNA Panel 定制 QIAseq 96-Unique Dual Index Sets 时,使用仪器上的 Local Run Manager (LRM) v2 上传样品表并继续测序: Read 1 为 149 bp , Read 2 为 149 bp ,每个 Index Read 为 10 bp 。
2. 样品稀释和汇集:将文库稀释至 2 或 4 nM ,用于 MiSeq 。 然后,如果每个库需要相似的测序深度,则以等摩尔量将具有不同样本索引的库组合起来。
注意: 文库稀释浓度建议基于 QIAseq Library Quant System 。
如果将具有相同数量引物的库组合在一起,则将等量的单个库以 4 nM 汇集在一起。如果文库有不同的引物编号,则根据它们的引物数量以体积比组合文库。 例如,文库 A 有 5000 个 4 nM 的引物,文库 B 有 600 个 4 nM 的引物; 将 50 µl 文库 A 与 6 µl 文库 B 结合起来,在同一次测序运行中,文库 A 和 B 的覆盖深度相似。
3. 文库准备和加载:根据 MiSeq 系统变性和稀释文库指南准备文库并将其加载到 MiSeq 。 MiSeq 上的最终文库浓度为 10–12 pM 。注意: 关于文库加载浓度的建议基于 QIAseq Library Quant System 。
4. 用于 Read 1 制备和加载的定制测序引物:使用 597 µl HT1 (杂交缓冲液)稀释 3 µl QIAseq A Read 1 Custom Primer I ,以获得 0.5 µM 的最终浓度。 将 600 µl 稀释的 QIAseq A Read 1 Primer I 加载到 MiSeq 试剂盒的位置 18 ( 图 1 )。
图1. MiSeq试剂盒。A: 读取1自定义底漆的位置18,B和C:不相关。△点击放大图片
5. 完成测序运行后,继续执行附录。(附录可从 QIAGEN 官网上下载货号为 333502 的全部说明书)
使用 QIAseq 12-Index I、QIAseq 96 Index I Sets 和 QIAseq 8-Unique Index Sets 对 MiSeq 进行测序准备1. 使用 QIAseq Targeted DNA Panel 定制 QIAseq 12-Index I、QIAseq 96-Index I Sets 和 QIAseq 8-Unique Index Sets 时,使用仪器上的 LRM v2 上传样品表(参见 QIAseq 的产品资源选项卡 Targeted DNA Panel 并下载适当的模板)并继续测序: Read 1 为 151 bp , Read 2 为 151 bp ,每个 Index Read 为 8 bp 。 或 使用 Illumina Experiment Manager v1.2 或更高版本设置带有 Custom Sequencing Read 1 引物的样品表( 图 11 )。 QIAseq Targeted DNA Panel 的样本索引与 Illumina Nextera XT v2 适配器样本索引系统兼容。 设置参数详情可在 QIAGEN 官网下载货号为 333502 的产品完整说明书。

△点击放大图片
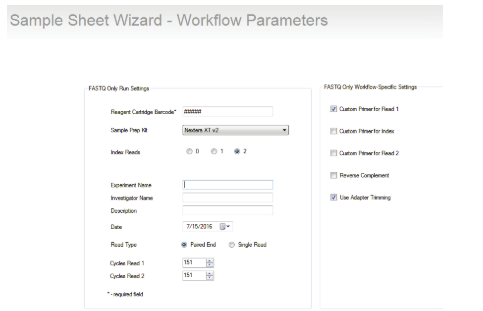
图11.使用Illumina实验管理器的样本表。△点击放大图片
2. 按照“使用 QIASEQ 96- 唯一双索引集对 MISEQ 进行测序准备”中的步骤 2–5 进行操作。
使用QIAseq 96唯一索引集对NextSeq 500/550进行测序准备1. 使用 QIAseq Targeted DNA Panel 定制 QIAseq 96-Unique Dual Index Sets 时,使用仪器上的 LRM v2 上传样品表(参见 QIAseq Targeted DNA Panel 的产品资源选项卡并下载适当的模板)并继续测序 : Read 1 为 149 bp , Read 2 为 149 bp ,每个 Index Read 为 10 bp 。
2. 样品稀释和汇集:将文库稀释至 0.5、1、2 或 4 nM ,用于 NextSeq 。 然后,如果每个库需要相似的测序深度,则以等摩尔量将具有不同样本索引的库组合起来。
3. 文库准备和加载:根据 NextSeq 系统变性和稀释文库指南准备文库并将其加载到 NextSeq 500/550。 NextSeq 500/550 上的最终文库浓度为 1.0–1.2 pM 。
4. 用于 Read 1 制备和加载的定制测序引物:使用 1994 µl HT1 (杂交缓冲液)稀释 6 µl QIAseq A Read 1 Primer I (已提供)以获得 0.3 µM 的最终浓度。 将 2 ml 稀释的 QIAseq A Read 1 Primer I 加载到 NextSeq 试剂盒的位置 7 ( 图 12 )。
图12.NextSeq试剂盒△点击放大图片
5. 完成测序运行后,继续执行“附录 D ”。(附录内容可从凯杰官网下载货号为: 333502 的完整产品说明书)。
NextSeq 500/550 与 QIAseq 12-Index I、QIAseq 96-Index I Sets 和 QIAseq 8-Unique Index Sets 的测序准备工作1. 当使用 QIASEQ Targeted DNA Panel Custom QIASEQ 12-Index I、QIAS-EQ 96-Index I Sets 和 QIAS-EQ 8-Unique Index Sets 时,请使用仪器上的 LRM V2 上传样本表(请参阅 QISASEQ Targeted DNA Panel 的“产品资源”选项卡并下载相应的模板)并继续测序:读取 1 为 151 BP ,读取 2 为 151 BP ,读取的每个索引均为 8 BP 。
2. 按照“使用 QIAseq 96Unique Index Sets 对 NextSeq 500/550 进行测序准备”中的步骤 2-5 。
使用 QIAseq 96-Unique Index Sets 进行 MiniSeq 的测序准备
1. 使用 QIASEQ Targeted DNA Panel Custom QIASEQ 96-Unique Dual Index Sets 时,请使用仪器上的 LRM V2 上传样本表(请参阅 QISAEQ Targeted DNA Panel 的“产品资源”选项卡并下载相应的模板)并继续进行测序:读取 1 为 149 BP ,读取 2 为 149 BP ,读取的每个索引均为 10 BP 。
2. 样品稀释和合并:对于 MiniSeq ,将文库稀释至 0.5、1、2 或 4nM 。然后,如果每个文库需要相似的测序深度,则以等摩尔量组合具有不同样品索引的文库。
注: 文库稀释浓度的建议基于 QIASEQ 文库定量系统。
3. 文库制备和加载:根据 MiniSeq 系统变性和稀释文库指南,制备文库并将其加载到 MiniSeq 上。 MiniSeq 上的最终文库浓度为 1.0–1.2pM 。
注: 库加载浓度的建议基于 QIASeq Library Quant 系统。
4. 用于 Read 1 制备和加载的定制测序引物:使用 997 µl HT1 (杂交缓冲液)稀释 3 µl QIAseq A Read 1 Primer I (已提供)以获得 0.3 µM 的最终浓度。 将 1 ml 稀释的 QIAseq A Read 1 Primer I 加载到 MiniSeq 试剂盒的位置 15 ( 图 12 )。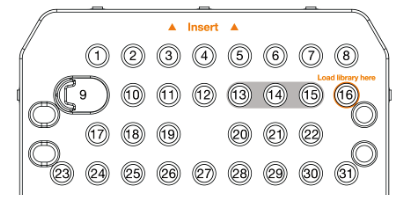
图 13. MiniSeq 试剂盒。△点击放大图片
5. 完成测序运行后,继续执行附录(附录可从 QIAGEN 官网上下载货号为 333502 的全部说明书)”。
使用QIAseq 12-索引I,QIAseq 96-索引I集和QIAseq 8-唯一索引集进行MiniSeq的测序准备1. 当使用 QIAseq 目标 DNA 面板自定义 QIAseq 1 2 -索引 I , QIAseq 96- 索引 I 集和 QIAseq 8- 唯一索引集时,使用仪器上的 LRM v2 上传样品表 (请参阅 QIAseq 靶向 DNA 面板的产品资源选项卡并下载相应的模板) 并进行测序: 读取 1 为 151 bp ,读取 2 为 151 bp ,每个索引读取为 8 bp 。
2. 按照“使用 QIASEQ 96 唯一索引集对 NextSeq 500/550 进行测序准备”中的步骤 2–5 进行操作。
使用QIASEQ 96-唯一索引集对NovaSeq制剂进行测序1. 使用 QIAseq Targeted DNA Panel 定制 QIAseq 96-Unique Dual Index Sets 时,上传样品表(参见 QIAseq Targeted DNA Panel 的产品资源选项卡并下载适当的模板)并继续测序:读取 1 为 149 bp , Read 2 为 149 bp ,每个 Index Read 为 10 bp 。
2. 样品稀释和汇集:将 NovaSeq 的文库稀释至 10 nM 。然后,如果每个库需要相似的测序深度,则以等摩尔量将具有不同样本索引的库组合起来。
3. 文库制备和加载:根据 NovaSeq 6000 测序系统指南( Part#1000000019358 )制备文库并将其加载到 NovaSeq 上。最终合并的文库浓度建议在 1.0 和 1.5pM 之间,在 NovaSeq 上产生 200 和 300pM 之间的最终加载浓度。
注: 文库加载浓度的建议基于 QIASeq Library Quant 系统。
4. 用于 Read 1 的定制测序引物制备和加载: S4 模式: 使用 3489.5 µl HT 1 (杂交缓冲液) 稀释 10.5 µl QIAseq A Read 1 引物 I (提供) 以获得 0.3 µm 的终浓度。将稀释的 QIAseq A 读取 1 引物 I 的 3.5毫升 加载到 NovaSeq 试剂盒的位置 5 ( 图14 )。
SP/S1/S2 模式:使用 1994µL HT1 (杂交缓冲液)稀释 6µL Qiaseq A Read 1 引物 I (提供),以获得 0.3µM 的最终浓度。将 2 mL 稀释的 QIASeq A Read 1 Primer I 加载到 NovaSeq 试剂盒的位置 5 ( 图14 )。
图 14. NovaSeq 试剂盒。△点击放大图片


