如下操作步骤以产品货号180492的步骤为例,产品列表详见右下方推荐产品
实验步骤
- 1
- 2
- 3
-
末端抛光和超低输入连接
该操作步骤描述了末端修复、 A 加法、适配器连接和库清理。它生成的库可以在 Illumina 的仪器上进行量化和用于 NGS 。
开始前要做的事情· 在开始样本操作步骤之前,使用酶法或物理方法对高分子量 DNA 进行片段化。
· 样品 DNA 应在开始前溶解 EB/Tris 缓冲液 或水。
· 在冰上解冻冷冻试剂。解冻后,应通过快速涡旋彻底混合缓冲液,以避免任何局部浓度。使用前短暂旋转涡旋试剂。不要涡旋酶。
· 准备新鲜的 80% 乙醇
程序1. 根据表1对热循环仪进行编程。
步骤 时间 温度 附加评论 端面抛光 30分钟 25ºC 结束修复 15 分钟 65ºC 末端修复酶失活; A-加法 ∞ 4°C Hold 结扎 10 分钟 25ºC 将接头连接到准备好的 DNA 片段 ∞ 4ºC Hold
2. 根据 表 2 制备末端抛光反应混合物,将组分添加到含有 DNA 片段 的 PCR 管 或板中。
注意: 反应混合物应在冰上制备。
3. 上下吹打数次混合组分,然后转移到热循环仪中,在 25°C 下进行末端抛光,然后在 65°C 下孵育以灭活末端抛光酶混合物。表 2. 10 pg – 100 ng 输入 DNA 的 End-Polishing Reaction Mix 设置(每个样品)
零件 体积/反应(微升) 10 pg – 100 ng 样品 DNA(片段化) 变量 末端补平缓冲液,10x 5 末端补平酶混合物 2 无核酸酶水 多变的 总反应体积 50
4. 在末端抛光步骤中,根据 附录 D(第53) 或 附录 E(第56) 和 表3 中的说明准备和稀释接头,具体可从 QIAGEN 官网下载货号为 180492 的完整实验说明。表 3. 适配器稀释因子
样本 DNA 量 QIAseq 或 GeneRead 适配器(板或组) 10–99 皮克 1:1000 稀释 100–999 皮克 1:100 稀释 1–9 纳克 1:10 稀释 10– 100 纳克 无稀释
5. 结束抛光步骤完成后,从热循环仪中取出反应管并将其放在冰上。
6. 立即进行超低输入适配器连接。根据 表 4 ,将适配器连接反应的组件添加到最终抛光的样品中。表 4. 末端抛光 DNA 的接头连接设置(每个样品)
零件 体积/反应(微升) 末端补平 DNA 50 超低输入连接缓冲液,4X 25 超低输入连接酶 5 QIAseq 或 GeneRead 适配器,制备和稀释的适配器;见表 3 和附录 D 或附录 E 2 无DNA酶水 18 总反应体积 100
7. 将反应转移到热循环仪上,在 25°C 下孵育 10 分钟 。不要使用加热的盖子。
重要提示: 请勿多次尝试使用稀释的适配器,因为存在条形码交叉污染的风险,以及低于预期的适配器浓度。
8. 连接完成后,将反应物置于冰上并使用 Agencourt AMPure XP 微珠 进行纯化。
9. 向每个样品中加入 80 µl 重悬的 Agencourt AMPure XP 微珠 ,并通过移液器充分混合。
10. 将混合物在室温 (15–25°C) 下孵育 5 分钟 。
11. 将磁珠放在磁性支架(例如 DynaMag )上 2 分钟 ,然后小心丢弃上清液。
12. 通过向每个颗粒中加入 200 µl 新鲜的 80% 乙醇来清洗磁珠。将磁珠放在磁力架上,小心弃去上清液。
13. 重复 步骤13 总共 2 次 乙醇洗涤。尽可能多地去除多余的乙醇。
14. 在磁力架上孵育 5-10 分钟 或直到珠子变干。磁珠过度干燥可能会导致 DNA 回收率降低。从磁性支架上取下。
15. 通过重悬于 52.5 µl QIAGEN Buffer EB 或 10 mM Tris·Cl,pH 8.0 中进行洗脱。磁力架上的颗粒珠。小心地将 50 µl 上清液转移到新的板或管中。
16. 使用 1x AMPure 珠子 进行第二次纯化:向每个样品中加入 50 µl 重悬的 Agencourt AMPure XP 珠子 ,并通过移液器充分混合。
17. 重复 步骤11–15 . 通过重悬于 26 µl QIAGEN Buffer EB 或 10 mM Tris·Cl ,pH 8.0 中进行洗脱。将磁珠放在磁力架上。小心地将 23.5 µl 上清液转移到新的 PCR 板 或试管中,用于 QC 和储存或扩增。
18. 使用毛细管电泳设备或类似方法评估库的质量。检查文库片段的大小分布是否正确以及是否缺少接头或接头二聚体。
19. 如果文库不会被扩增,则将 DNA 储存在 –20°C 的 DNA LoBind 管 中,直到准备好进行测序。如果扩增文库,请继续执行“文库 DNA 扩增”操作步骤)。
注意: 从 <10 ng 输入 DNA 生成的文库可能在文库扩增前通过毛细管电泳不可见。 -
文库 DNA 扩增
如果基因组 DNA 的输入 DNA 量 <100 ng 或 cfDNA 的输入量 <10 ng,通常需要基于 PCR 的文库扩增。该方案适用于使用套件中包含的 QIAseq HiFi PCR Master Mix 对 DNA 文库进行可选的高保真扩增。
开始前要做的事情· 使用“End-Polishing and Ultralow Input Ligation”操作步骤制备文库 DNA,具体可从QIAGEN官网下载货号为180492的完整实验说明的页面16.
· 在冰上解冻冷冻试剂。解冻后,应通过快速涡旋彻底混合缓冲液,以避免任何局部浓度。使用前短暂旋转涡旋试剂。不要涡旋酶。
程序
1. 根据表5对热循环仪进行编程。
注意:使用产生足够库良率所需的最少循环数。我们建议从 10 pg DNA 创建的文库以 16 个循环为起点,100 pg 14 个循环,1 ng 输入 10 个循环,10 ng 8 个循环。表 5. 循环条件
时间 温度 循环次数 2 分钟 98°C 1 20 s 98°C 30 s 60°C 多变的 30 s 72°C 1分钟 72°C 1 ∞ 4°C 抓住
2. 根据表6在冰上制备文库扩增反应混合物。表 6. 文库扩增的反应混合物
零件 体积/反应(微升) 高保真 PCR 预混液,2x 25 底漆混合物(每个 10 µM) 1. 5 文库 DNA(来自第 19 步,第19) 23. 5 总反应体积 50
3. 将 PCR 板转移到热循环仪并启动程序。
4. 程序完成后,将 50 µl 重悬的 Agencourt AMPure XP 微珠添加到每个 50 µl PCR 样品中。通过上下吹打数次充分混合。
5. 在室温下孵育混合物 5 分钟。
6. 将磁珠放在磁性支架(例如 DynaMag)上 2 分钟,然后小心丢弃上清液。
7. 通过向每个颗粒中加入 200 µl 新鲜的 80% 乙醇来清洗磁珠。将磁珠放在磁力架上,小心弃去上清液。
8. 重复步骤27 总共 2 次乙醇洗涤。尽可能多地去除多余的乙醇。
9. 在磁力架上孵育 5-10 分钟或直到珠子变干。磁珠过度干燥可能会导致 DNA 回收率降低。从磁性支架上取下。
10. 通过重悬于 25 µl 无核酸酶水或 QIAGEN Buffer EB 中进行洗脱。将珠子放在磁性支架上。小心地将 23 µl 上清液转移到新的 LoBind 管中。
11. 将文库在 –20°C 下储存在 DNA Lo-bind 管中,直到准备好进行 QC、文库量化和测序。 -
文库 QC 和量化
1. 使用毛细管电泳设备或类似方法评估库的质量。检查文库片段的大小分布是否正确以及是否缺少接头或接头二聚体。
注意:DNA 片段的中值大小应根据与库片段连接的接头的大小进行移动(例如,对于 QIAGEN 接头,添加 120 bp)。对于无 PCR 文库,请注意以下事项:
· 在 PCR 扩增之前,接头包含非互补区域。这使得 DNA 文库在毛细管电泳中的迁移速度比完全互补的 dsDNA 慢。
· 除了两端带有接头的插入分子外,连接产物还可能包含未连接的 DNA 片段以及仅与一个接头连接的 DNA 片段。
注意:中间片段大小可用于后续基于 qPCR 的量化方法。
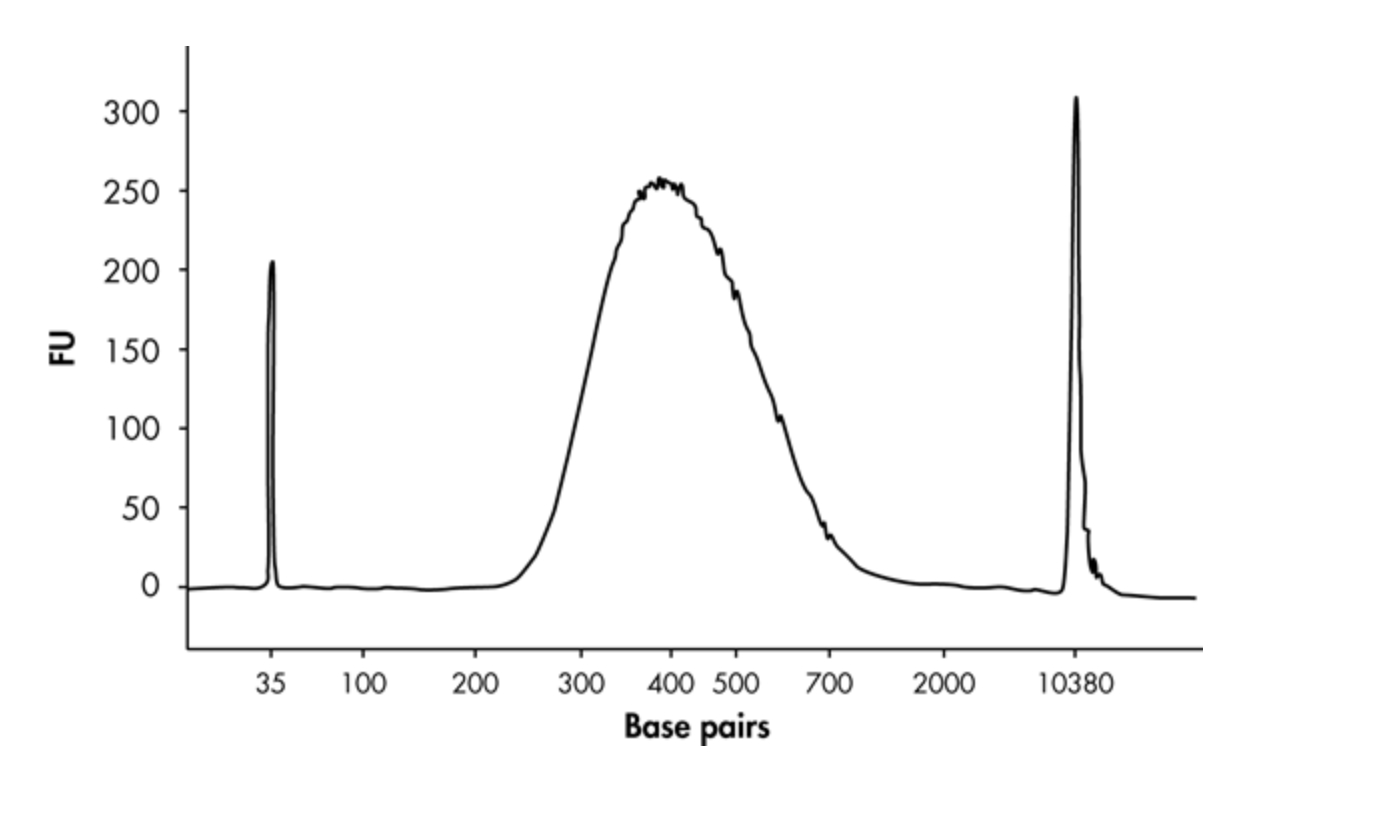
图 2. 显示文库片段大小分布正确且不存在接头或接头二聚体的毛细管电泳设备跟踪数据。△点击放大图片
2. 使用 QIAseq Library Quant Array Kit 或类似的基于 qPCR 的方法对库进行量化。
3. 纯化的文库可以安全地储存在 –20°C 的 DNA LoBind 管中,直到下游杂交捕获或测序。


