• 实时 (Real time):Biacore是首个将表面等离子共振 (SPR) 原理应用到生物领域的检测技术,可以实时地记录分子间的结合和解离的全过程,得到亲和力的同时还能得到实时动力学(结合速率、解离速率)的数据。
• 无标记 (Label free):基于SPR原理,Biacore不需要给分子做任何标记即可检测分子间的相互作用,在省去样品预处理步骤的同时,还可避免标记对生物分子产生的影响。
• 高灵敏度:自1990年,第一代Biacore问世以来,历经多代升级,灵敏度已达业界最高 (<0.01RU (RMS) ) ,即使微小的结合信号也能得到最真实的反映。
• 可检测样品类型多:Biacore可检测几乎所有的生物分子类型且无分子量检测下限。小到几十道尔顿的离子、蛋白质、核酸或核酸适配体、脂质、多糖、多肽、化药小分子、大到病毒或整个细胞,甚至是细胞上清液、血清、中药提取物、腹水等复杂样品Biacore均可检测。
• 应用范围广:Biacore能够提供信息丰富、高可信度的结合数据:靶点结合验证、分子库筛选及排序、特异性、选择性、结合动力学、结合亲和力、功能复合体形成机制、药物在靶时间评估、结合表位、抗体亚型鉴定、ADME、药物代谢浓度 (PK) 、生物标志物浓度、EC50/PLA等诸多方面数据,满足生物药物开发各个阶段的不同要求,从基础科研至药物发现和开发领域均具有广泛的应用。

△点击放大图片
• 全自动、高通量:Biacore分子互作实验中各步骤均由仪器全自动完成,高通量型号可以满足一次高达四千多个样品的检测。
• 药典法规认可:SPR在2016年被收录进美国、日本药典,2020年被收录进中国药典,是唯一被三国药典所收录的无标记分子互作检测技术。多款Biacore设备符合GxP认证和遵从21 CFR Part 11要求的软件和认证服务。
视频素材来源于Bilibili https://www.bilibili.com/video/BV1o34y187xE/?spm_id_from=333.337.search-card.all.click&vd_source=57df7722e01bf0e8bd98ba96f0d9b4c5
版权归原作者所有
实验步骤
- 1
- 2
- 3
- 4
- 5
-
试剂准备
芯片:S系列CM5芯片
氨基偶联试剂盒:包含EDC,NHS和乙醇胺
偶联缓冲液:醋酸钠,用于稀释配体蛋白。PH4.0,PH4.5,PH5.0,PH5.5
缓冲液:10x HBS-EP
去离子水
配体蛋白A:如果为商业化蛋白粉末,用水稀释到 200 μg/mL,分装在 -20℃ 保存。需要确定蛋白的活性, 在进行溶解时,确保溶解液不含 Tris 等带有伯氨基团的成分,准备20μg。
分析物蛋白B:母液浓度为 1mM,样品体积在 200 μL 以上,纯度>90%。,准备20ug。
再生溶液:使用盐酸甘氨酸。PH1.5, PH2.0, PH2.5, PH3.0 -
仪器准备
(1)开机操作
1)打开 Biacore T200 系统和电脑的电源开关。 Biacore T200 的电源开关位于系统背面的左下角。开机后,需等待检测单元的温度达到预设温度(用户自设,通常为25℃)。待温度稳定后,面板上的温度指示灯(黄色)会停止闪烁,该过程可能需要30-60分钟。
2)打开 Biacore T200 控制软件( Start→Program→Biacore→Biacore T200 Control Software),运行后软件程序会自动和主机系统建立连接。
3)准备运行缓冲液。量取 50 mL 10 x HBS-EP+ buffer、 450mL去离子水(已经 0.22 μm 膜过滤),混匀后放入 500 mL缓冲液瓶。
(2)缓冲液的放置
1)将已经配制好的缓冲液放在 T200 系统左侧的缓冲液托架上,换上黑色的单孔盖。
2)将缓冲液进液管 A(注意软管上的蓝色标签)插入至缓冲液瓶底部。其余三根进液管( B、 C和D)放在左侧的舱门后。
3)将 2L 的废液瓶放置在 T200 系统右侧的缓冲液托架上,连接上专用的盖子。
4)取 500mL 去离子水装入 500mL 缓冲液瓶,放置在右侧缓冲液托架上用于清洗进样针。
(3)芯片的放置
1)点击工具条中的 按钮或选择 Tools 菜单中的 Insert Chip 选项,打开芯片舱门。
2)如果已经有芯片在芯片舱内,点击工具条中的弹出芯片按钮或选择Tools菜单中的 Eject Chip 选项。

△点击放大图片
3)如果使用的是新芯片,选择 New Chip。在 Chip Type 的下拉菜单中选择对应的芯片种类(此实验为 CM5 芯片),在 Chip Id 中填入和芯片相关的实验信息, Chip lot No. 中可填入芯片批号(选填)。如果是已经使用过的芯片,请选择 Reuse Chip,并在 Chip Id 下拉菜单中找到与之相对应的芯片信息。

△点击放大图片
4)手持芯片,有字的一面朝上。按照芯片上的箭头方向,将芯片轻轻推入卡槽,最后合上芯片舱的舱门。

△点击放大图片
5)点击 Dock Chip 按钮,芯片置入后系统将自动转入待机( Standby)状态。
6)选择 Tools→Prime 命令,点击 Start。缓冲液会以较高的流速冲洗整个内部的流路系统,整个过程耗时6-7分钟。结束后,点击 Close,系统自动转入待机( Standby)状态。注意:当系统更换缓冲液或者芯片后,必须运行Prime程序。 Prime 时缓冲液会冲洗整个流路系统,为下一步的实验做好准备。
(4)放置试管架
本次实验中使用 Sample and Reagent Rack1。
1)点击工具栏打开舱门按钮,样品舱舱门会自动打开。
2)用手指将试管架下方的金属按键向里侧按(见下图中白色箭头),试管架将会解除锁定并弹出,然后可以轻轻抽出试管架。
△点击放大图片
3)按住试管架右侧的黑色按钮,向左侧打开金属盖。放入相应的试管后,轻轻合上金属盖。听到“咔”声,表明金属盖已经处于锁定状态。
4)将试管架沿着卡槽轻轻推入样品舱,听到“咔”声,表明试管架已经处于正确位置并锁定。
5)点击 Eject Rack Tray 对话框中的 OK,试管架会被自动送入样品舱,舱门也会自动合上。注意:样品舱舱门打开后会有时间限制,打开60秒后舱门将自动合上。最后15秒时,对话框中的倒数计时会显示为红色字体并闪烁。此时请不要强行将试管架放入,以免夹到手。可以等待舱门合上后,重新打开即可。 -
配体偶联
(1)根据以下公式可计算目标偶联量

△点击放大图片
其中, Rmax 为芯片表面最大结合容量,在蛋白测试中通常代入 100RU。 analyte MW 和 ligand MW 分别为蛋白B 和蛋白 A 的分子量, Sm 为化学计量比,未知时选择1。 Rl 为配体偶联水平。实验时实际偶联量为1.5倍的 Rl。所以经计算, Rl 为 114RU,蛋白 A 的目标偶联量为 171RU。
注:本实验选用了偶联蛋白 A 流过蛋白 B,客户也可以选择偶联蛋白 B 流过蛋白 A,多数情况下均可。部分情况下只能选用一种实验设计方式,如蛋白等电点过低等情况。
配体偶联量也可以参考以下表格:

△点击放大图片
(2)配体预富集
蛋白A用醋酸钠 pH5.0, 4.5, 4.0 分别稀释到 10 μg/mL (至少10倍稀释比),各准备 100μL,通过预富集实验,确定pH4.5作为最佳偶联条件。故用 pH4.5 的醋酸钠将配体溶液稀释至 10 μg/mL, 200 μL 进行正式的偶联操作。
(3)配体偶联
1)打开 Biacore T200 Control Software , 点击 File 下面的 Open/New wizard template,选择 immobilization。对话框中,在 Chip type 中选 CM5,在 Flow cells per cycle 选1。勾选 Flow cell 2, method 选用 amine 氨基偶联,ligand 输入配体名称,该实验选用 aim for immobilized level, target level 输入计算出的 171RU。在 Flow path 中选择 Flow path 2(如芯片2通道已用,可选择4通道)。接着按 Next,勾选 prime,选择实验温度,一般默认 25℃。

△点击放大图片

△点击放大图片
2)在左侧下拉菜单中选用 Sample and Reagent Rack 1,系统会自动排好样品放置位置(可以通过鼠标拖拽重新安排)。根据样品架位置表,准备足够体积的样品(如果使用的是带盖的EP管,所有盖子必须剪去)。 100 μl的EDC 放入 R1D3, 100μL 的 NHS 放入 R1D4,空管放入 R1D5, 140 μL 乙醇胺放入 R1D6, 166μl 10μg/mL 配体蛋白放入 R1D1。盖上试管架盖子,将样品架送回样品舱。

△点击放大图片
3)点击Next,弹出 Prepare Run Protocol 对话框,确认运行缓冲液体积大于表中的最低要求,点击 start。

△点击放大图片
4)保存 method与result 文件到文件夹。系统正式自动运行偶联程序,整个过程耗时约 30min。
5)软件自动生成偶联结果,本次实验偶联量为 230RU。 -
样品检测(以检测亲和力为例)
(1)打开文件:在打开的 Biacore T200 Control Software 里点开 file 中的 Open/New Wizard Template。
△点击放大图片
(2)选择实验:在 Open/New Wizard Template 的左边目标栏里点中 Kinetics/Affinity 后双击。

△点击放大图片
(3)选择通道:在 Kinetics/Affinity 界面中,将 Flow path 点为2-1或4-3, Chip type 选择CM5。接着点 NEXT

△点击放大图片
(4)设置运行缓冲液:在 Setup 界面里, Startup 底下的 Solution 一栏中填写 HBS-EP,并将 Number of cycles 改为3,接着点 Next。

△点击放大图片
(5)设置时间:在 Kinetics/Affinity-injection Parameter 界面下:在 Sample 一栏中 Contact time 为120s, Flow rate 为30 μl/min,Dissociation time 为120s,再生条件为 Glycine 2.0,再生时间30s

△点击放大图片
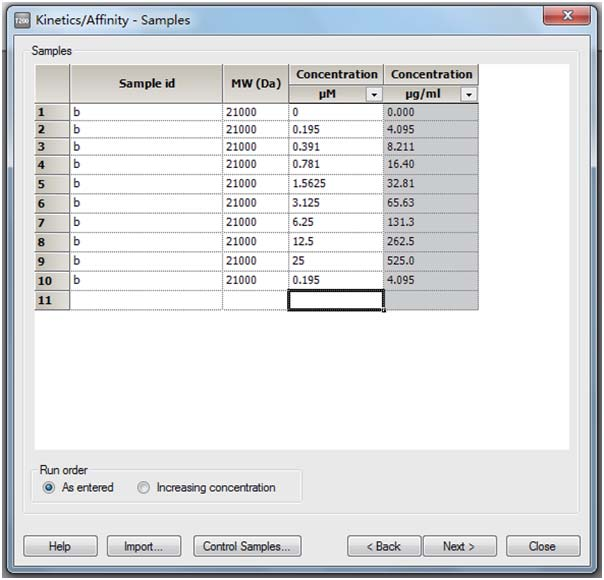
(6)填写分析物信息:在 Kinetics/Affinity-Sample 界面中: Sample id 填写样品名称, MW(Da) 填写分子量,第一个Concentration 为摩尔浓度将其调为 μM,第二个为质量浓度,摩尔浓度填完后质量浓度会自动计算(每个样品请选择一个浓度进行重复进样,样品浓度由低到高填写)。接着点 Next。以 b 为例进行填写如下:
△点击放大图片
(7)进样位置设置:在 Kinetics/Affinity-System Preparations 界面下,直接点 Next 进入 Rack Position 界面,将 Reagent Rack 改为 Sample and Reagent Rack1,点开 Menu 后选 Automatic Positioning

△点击放大图片
(8)进样管设置:进入下面界面后,将 Pooling 一栏全部改为 Yes, Vial Size 根据需求进行调整, 1.5 mL EP管请选择 medium。

△点击放大图片
(9)根据样品所在位置进行样品准备和放置:蛋白B 母液先用左托盘中的运行缓冲液 1x HBS-EP+ 稀释至 100μM,再用 1x HBS-EP+ 进行 5 倍稀释。点击左下方 Eject Rack,取出样品架。根据图示样品位置进行放置,盖上试管架盖子,将样品架送回样品舱。 ( 注:所有 EP 管的盖子务必剪去 )。点击 Next,对方法进行保存,再对数据路径 ( 可使用系统 默认的,也可自行指定,注意所保存的文件名及指定文件夹名均不能有中文字符 ) 进行保存,仪器便会开始自动运行。 -
实验结果分析
(1)打开软件:打开数据分析软件 Biacore T200 Evaluation Software,点 file 中的 open 找到刚才保存的文件。 点击左侧 Plot 中的 Binding to reference,检查各个点是否趋于一致或小于 binding level 中对应响应值的 20%,再检查 binding level 各个点的响应值是否存在明显的浓度依赖。如是,直接跳到下一步。注:若 Binding to reference 各个点的响应值也存在浓度依赖且大于 binding level 中对应响应值的 20%,即存在非特异性结合。此时可尝试提高运行缓冲液中盐离子浓度或提高 P20 浓度不超过 1%,或者调换配体与分析物,将 B偶联在芯片上,将 A 作为分析物。若 baseline 中各个点的响应值上飘,可适当延长 glycine 1.5 溶液的进样时间。

△点击放大图片
(2)选择数据:接着点 Kinetics/Affinity,在下拉栏里点开 Surface bound,在跳出的窗口中选择不同的浓度进行拟合。选择标准为:如果最高浓度响应值大于 500 RU,选最低的 5 个浓度分析,如果最高浓度响应值小于 50 RU,选最高的 5 个浓度进行数据分析,介于两者中间,随意选 5 个连续的浓度进行分析。不需要的浓度,可在样品浓度表格中将此浓度前的对号去掉即可。
(3)选择拟合模式:接着点 Next,在接下来的界面中点 Affinity(如结合曲线有动力学性质则选择 kinetics 进行拟合,分析步骤可参考核酸蛋白或抗原抗体 SOP )。 Model 选择1: 1 Binding,接着点击Fit进行数据的拟合。拟合结束后,显示如下界面,蛋白A与蛋白B结合的KD值为1.2×10-5 M。亲和力拟合KD值需落在样品浓度范围内。

△点击放大图片
(4)拟合数据:点击右下角 Next,再点击右下角 Kinetics ( 当传感图为 “ 快上快下 ” 时,选 Affinity ),点击左上角 Fit 进行数据拟合,点击右下角 Finish 完成。
(5)导出数据:在下方数据显示栏里, Quality Control 的前三项都亮绿灯表示检测数据好;如果亮黄灯,表示数据能接受;如果亮红灯,表示数据不能接受,需要优化实验。数据显示栏的 Report 中显示具体的分析数据,包括动力学数据 ka、 kd,亲和力数据 KD 等。将鼠标放在图上,点击右键可以直接 copy graph ( small, medium, large ) 用于文章发表,也可以右键点击 export curve,导出 txt 文本后用第三方软件作图。

△点击放大图片



