生物学背景
针对样本的全免疫微环境的画像刻画往往都是比较复杂的过程,在以往的常规方式中,我们通过对一个样本进行多组不同荧光染色的方案来分别完成各个细胞亚群的比例监测和蛋白表达评估的工作。但是伴随着流式细胞术的发展,尤其是多色流式细胞术的可检测通道量大幅度提升,在同一个样本中进行单组多荧光抗体标记的方法已经逐渐成熟。本方案即是使用全光谱流式细胞仪对人外周血/PBMC中的淋巴(T,B,NK,NKT,ILCs)单核,粒细胞进行全面的评估,并且发现一些既往的biomarker会在一些细胞群中呈现不同的新分群。
panel&结果展示
- 1
- 2
- 3
-
实验信息
样本类型
Human whole blood ;Human PBMC
方案类型
Multicolor panel
实验方案
Blood isolation Surface marker staining
使用的仪器
Sony ID7000 全光谱流式细胞仪
-
PanelDesign&抗体用量&克隆号选择:
激光 标志物 荧光染料 克隆 体积/测试 货号 Violet 405 nm CD8 V500 SK1 5 ul 561618 CCR7 BV786 3D12 5 ul 563710 HLA-ABC BV711 G46-2.6 5 ul 565333 CD45RO BV650 UCHL1 5 ul 563750 CD45RA BV605 HI100 5 ul 562886 CD11b BV510 M1/70 5 ul 562950 CD19 BV480 SJ25C1 5 ul 566103 CD4 BV421 L200 5 ul 562842 Blue 488 nm CD56 Percp-Cy5.5 B159 5 ul 560842 CD25 BB515 2A3 5 ul 564468 CD28 FITC CD28.2 20 ul 555728 YG 561nm CD16 PE-CY7 3G8 5 ul 557744 CD34 PE-CY5 581 20 ul 555823 CD127 PE HIL-7R-M21 5 ul 557938 Red 640 nm CD69 APC-R700 FN50 5 ul 565154 CD3 APC-CY7 SK7 5 ul 557832 CD38 APC HIT2 20 ul 555462 -
逻辑设门图&数据结果说明:
1.逻辑设门方案
△点击放大图片
2.使用降维分析对样本信息进行降维,生成T-sne后将常规多色数据分析代入观察整体亚群关系:
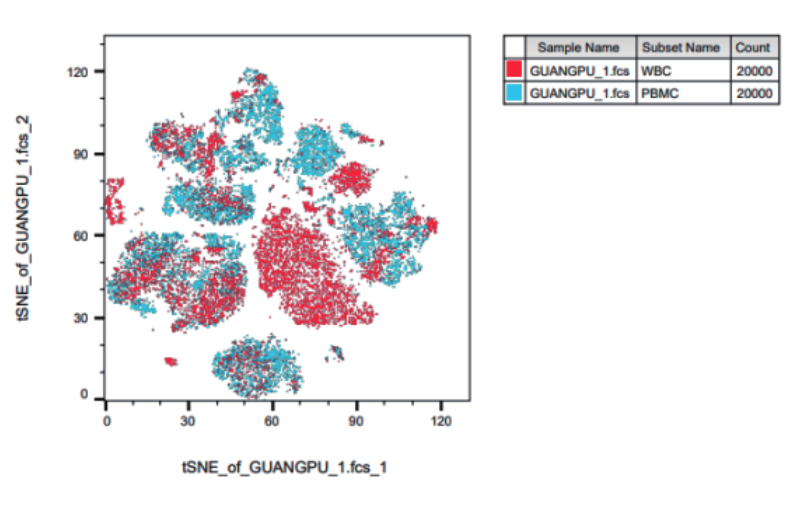
对PBMC和WBC样本进行对比
△点击放大图片
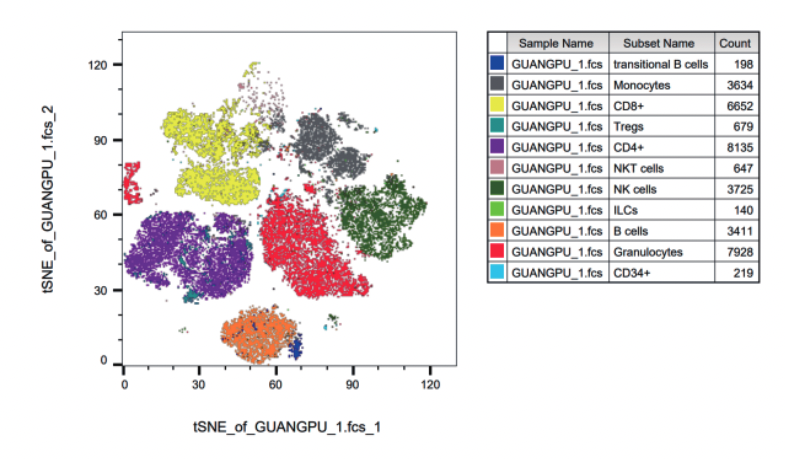
将常规多色数据分析代入观察整体亚群关系
△点击放大图片
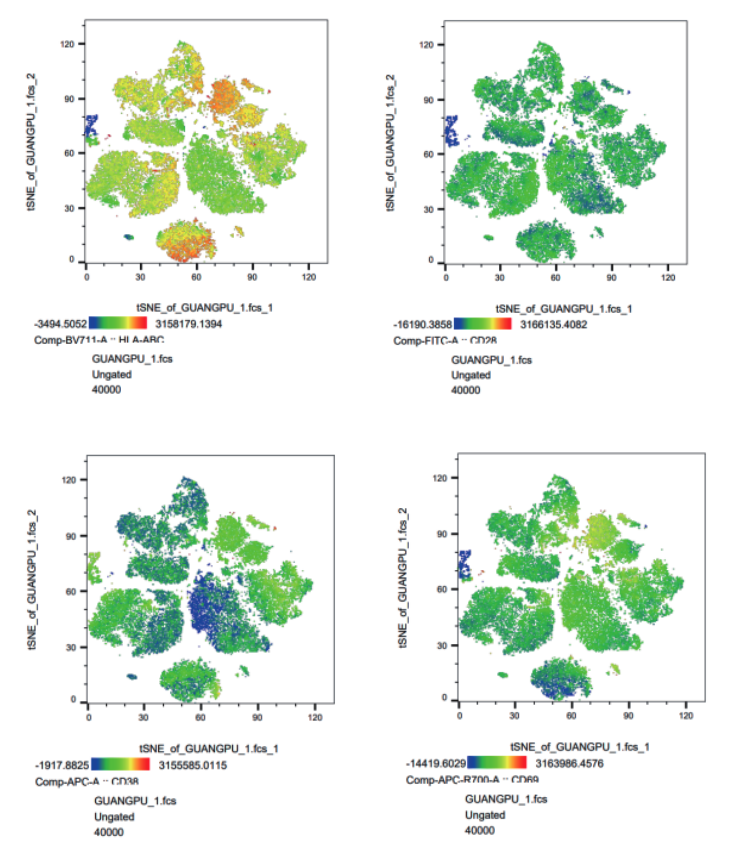
观察关键蛋白在整体细胞亚群上的表达情况
△点击放大图片
3.为了进一步探究细胞亚群的相互关系:
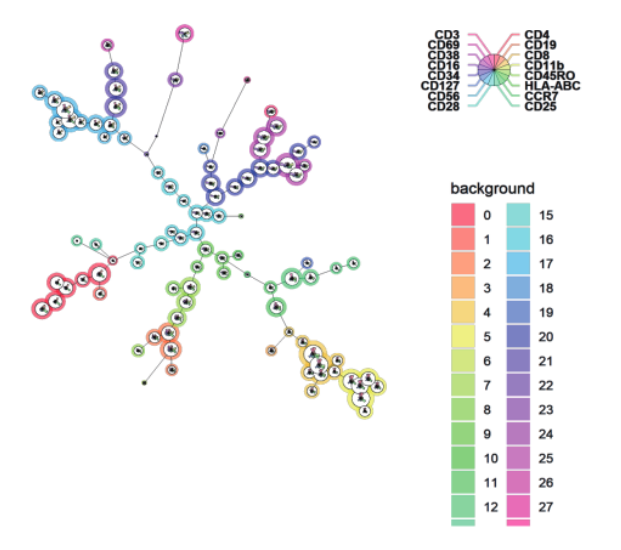
使用Flowsom进行全自动聚类分析
△点击放大图片
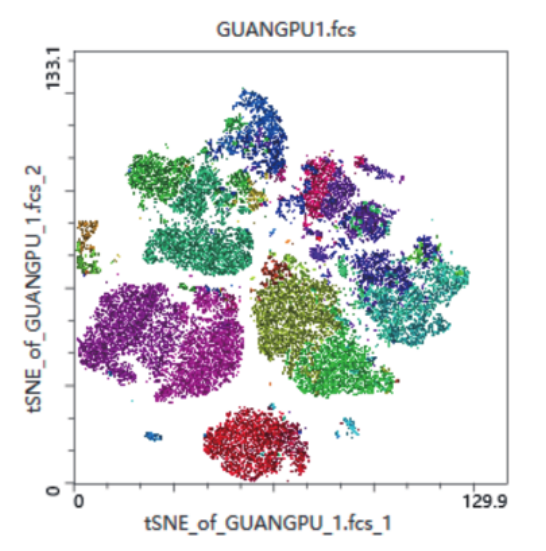
分析后代入T-sne可以看到最终生成29个亚群
△点击放大图片
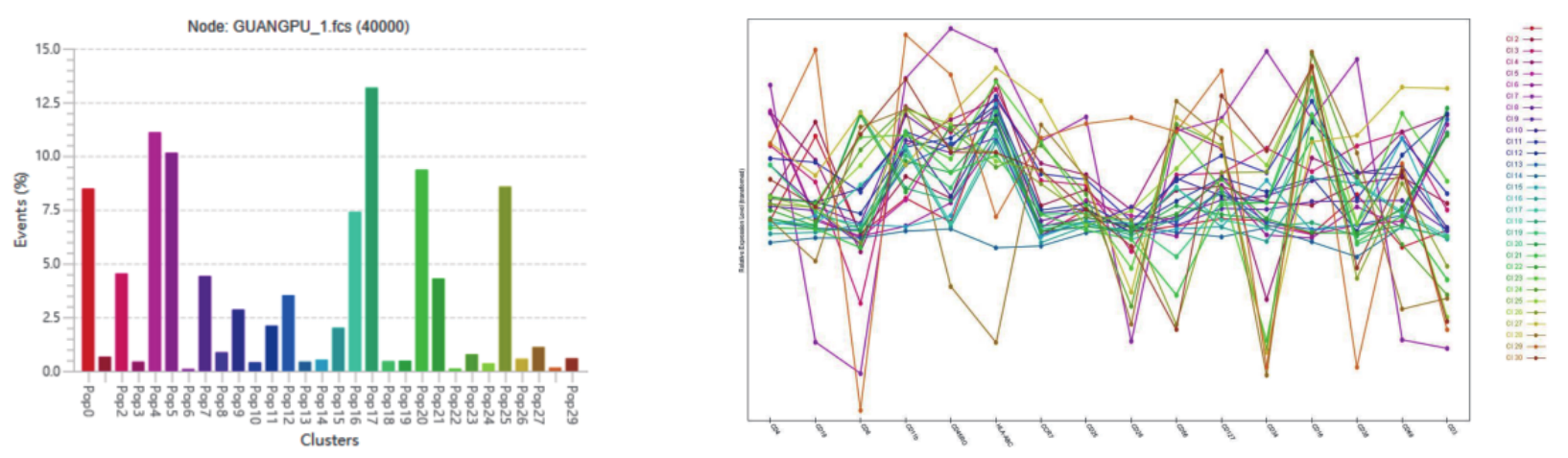
29个亚群的细胞比例和蛋白表达情况
△点击放大图片
使用18色的多色方案对人全血中免疫细胞进行研究
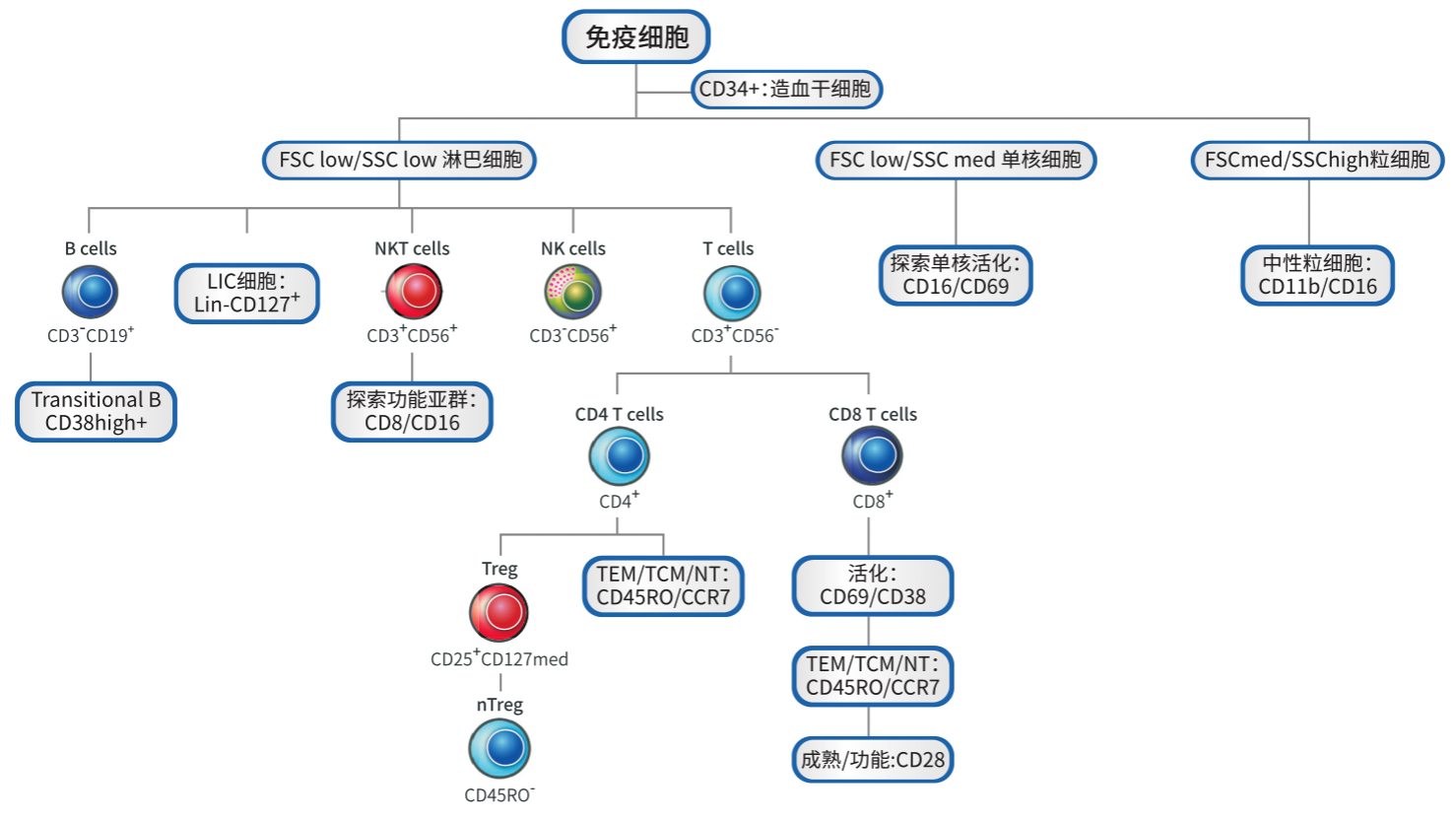
来自健康人全血进行代表性分析。通过FSC和SSC圈取待分析细胞群,从中观察Time/SSC,确保样本数据质量稳定;通过CD34标记HSC细胞。
在CD34-细胞中,通过FSC/SSC结合形态学圈取淋巴/单核/粒细胞区域门;在单核细胞中,通过CD16和CD69评估其活化水平;在粒细胞中,通过CD11b和CD16确定中性粒细胞亚群比例。
在淋巴细胞中,通过CD3/CD19获得B细胞门,在非B细胞中,通过CD3/CD56获得NK,NKT,T细胞门以及3阴细胞门,在3阴细胞门中通过CD127获得ILCs细胞门,在B细胞中通过CD38获得Transitional B cells。
在NK细胞中,通过CD16/CD8获得探究性细胞亚群。
在T细胞中,通过CD4和CD8获得Th细胞和Tc细胞亚群;在Th细胞中,通过CD45RO和CCR7获得TEM.TCM,NT细胞亚群;在Th细胞中,通过CD25和CD127获得Tregs细胞亚群;在Treg细胞中,通过CD45RO进行分群;在Tc细胞中,通过CD45RO和CCR7获得TEM.TCM,NT细胞亚群;在Tc细胞中,通过CD69,CD38,CD28分别评估其活化程度和成熟水平。
在Sony ID7000 全光谱流式细胞仪上采集样本。使用Flowio v10软件进行数据分析。降维图和聚类图等使用Flowjo v10软件上的T-SNE、FlOWSOM以及Violin插件创建。



