实验步骤
- 1
- 2
-
所需试剂&耗材准备
DNase I (LS002139 )
To prepare the 10 mg/mL stock solution, deoxyribonuclease I (DNase I) was dissolved in 100 mL of 5 mM calcium chloride(CaCl2). Sterile fifilter the solution through a sterile 0.22 μm Stericup and store aliquots at −20°C.Collagenase D (Roche,11088858001)
The 40 mg/mL stock solution is prepared by dissolving 500 mg collagenase D in 12.5 mL Hank’s balanced salt solution (with Ca2+ and Mg2+). Sterile fifilter the solution through a sterile 0.22 μm membrane and store aliquots at −20°C.10% BSA/PBS
Dissolve 50 g of bovine serum albumin (BSA) in 500 mL PBS (can also be heated up to 40°C while stirring) and fifilter it through a 0.22 μm StericupAccutase (BD,561327)
FCR blocking (553141)
7-AAD (559925)
100um细胞筛网(黄色)(Absin, abs7233)
肿瘤样本收集(1h)
· 需要新鲜的肿瘤,必须在收到样本后立即或至少在收到样本后12小时后准备处理样本。
· 将肿瘤样本放入充满无血清RPMI培养基的无菌管中,4℃保存。样品必须完全浸在介质中。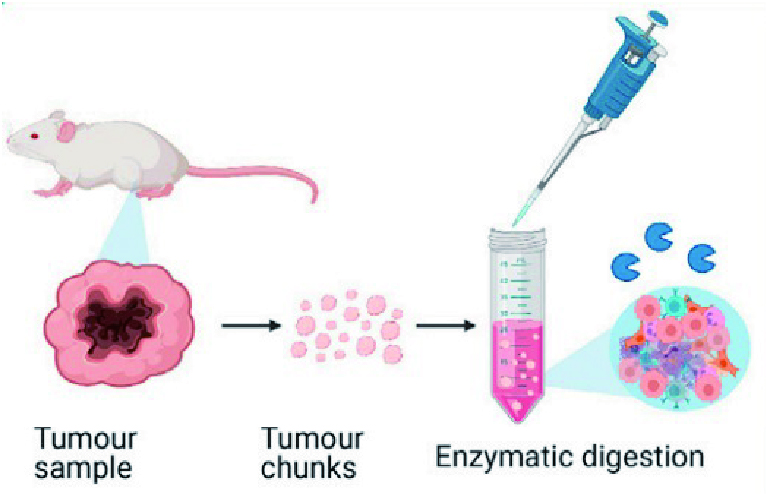
△点击放大图片
-
详细步骤——单细胞悬液制备 肿瘤分离(3h)及染色
1.在开始之前,用70%的酒精对工作空间和设备(剪刀和镊子)进行消毒
2.在15ml管中准备酶消化混合物:
a.加入4.7ml不含血清和任何其他补充剂的RPMI培养基b. 在试管中加入200μl酶H、100μl酶R, 25μl酶A
c.涡旋混匀
3.将肿瘤切成大约2mm3的小块,直接放入酶混合物中
4.将样品放入37 ℃培养箱连续旋转40min
(注:通常取4~12cm3肿瘤样本。该方案适用于约6cm3的肿瘤样本体积,如果肿瘤大于6cm3,我们建议将肿瘤分成两个混合酶管)
5.将100μm的细胞滤网放在50ml试管上,用1ml培养基冲洗细胞滤网
6.用酶消化培养基将消化的肿瘤块转移到细胞滤网上
7.用1ml注射器柱塞的扁端轻轻粉碎肿瘤(将柱塞从注射器中取出)
a.粉碎肿瘤时,定期用培养基清洗细胞滤网b.继续粉碎,直到肿瘤组织的最大解离
c.清洗细胞过滤器,直到在50ml试管中达到48ml细胞悬浮体积
8.将细胞悬液以400-500xg离心10分钟
9.离心过程中,准备1X5ml红细胞裂解液
10.弃上清,在试管中保留少量培养基(约500μl)
11.轻拍试管将颗粒轻轻分离
12.用5ml移液管将颗粒与5ml红细胞裂解液缓慢重悬,使之5X上下。
13.在20℃-25℃孵育3分钟
14.将细胞悬液以400-500xg离心5分钟
15.弃上清,重悬于20ml培养基中
16.用台盼蓝液计数细胞数和活力
17.用400-500xg离心细胞悬液5分钟,弃上清,在10ml培养基中重悬颗粒
a.分离总细胞约50-100万,在5ml试管中进行流式染色
18.将细胞悬液以400-500xg离心5分钟,弃上清,进行柱状细胞分离(注意:在以下步骤中,必须用铝箔保护避光)
c.在旋转过程中,用100μl的PBS稀释0.1μl的浓缩原液,制备死活染料d.用100μl稀释的死活染料重悬细胞,在20℃- 25℃下孵育25分钟
19.流式细胞术染色时,细胞悬液(总细胞数的50-100万)以400-500xg离心5分钟,丢弃上清液
a.将细胞颗粒重悬于200μl的PBS中
b.细胞悬液400-500xg离心5分钟,弃上清(注意:在以下步骤中,必须用铝箔避光。)
c.在旋转过程中,用100μl的PBS稀释0.1μl的浓缩原液,制备活/死固定蓝活力染色
d.用100ml稀释的活/死固定蓝液重悬细胞颗粒,在20℃-25℃下孵育25分钟
e.在孵育期间,制备抗体混合物
f.加入100μl FACS缓冲液,以400-500xg离心5分钟,弃上清
g.用25μl Fc block(用FACS缓冲液稀释10倍)重悬细胞颗粒。在20℃-25℃孵育10分钟
h.直接在细胞悬液上加入25μl抗体混合物1(concentrated 2x)。冰上孵育25min
i.在试管中加入300μl的FACS缓冲液进行清洗。离心5分钟,400-500xg,弃上清液
j.在使用流式细胞仪分析之前,将细胞重悬于200μl FACS缓冲液中,并在50μm细胞过滤器上过滤细胞悬液
k.使用Flowjo软件进行分析


