实验步骤
- 1
- 2
- 3
- 4
- 5
- 6
-
选择合适的实验模型
下面的例子展示了使用Bioauxilium 提供的Toolbox试剂(表1)进行实验的可能方案,蛋白质A和蛋白质B之间的相互作用实验的不同的实验组合。举例说明,蛋白质A带有Tag-a标签,蛋白质B可以是天然的(图1A),或者将蛋白质B进行生物素化(图1B),或带有Tag-b(图1C),或者将蛋白质B直接进行受体或供体标记(图1D)。这几种示例中,两种蛋白的标签或标记都可以互换使用。
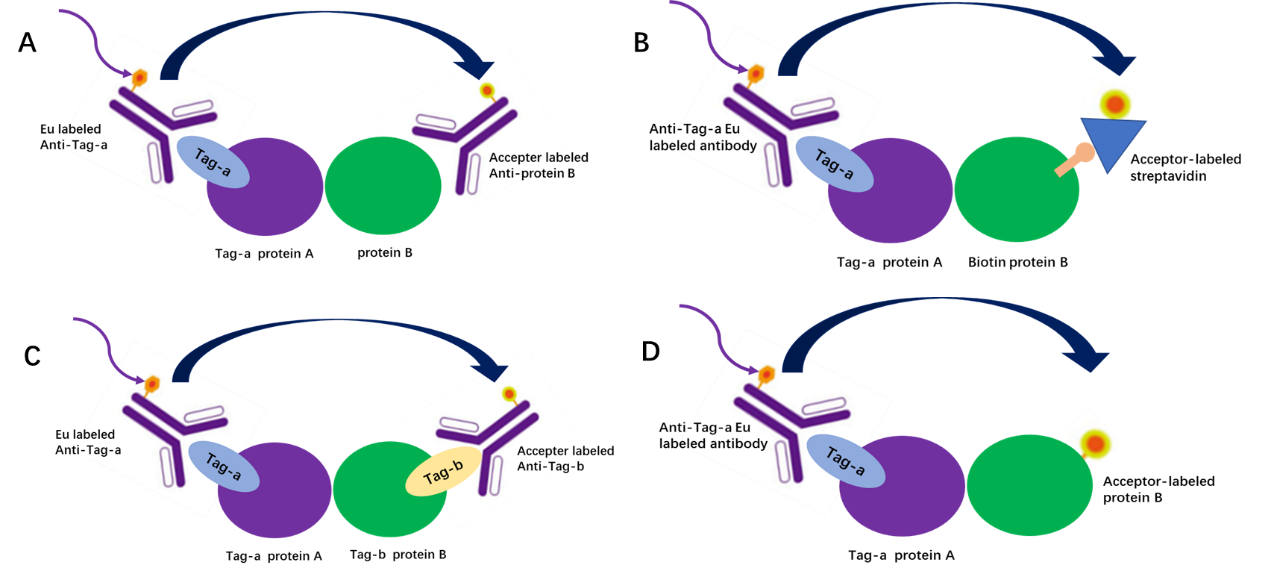
图2. 蛋白质A和蛋白质B相互作用实验方案
△点击放大图片图1A,使用带有供体标记的抗标签a抗体结合蛋白质A,并使用带有受体标记的抗蛋白质B抗体(定制或用标记试剂标记)结合蛋白质B,产生FRET信号。
图1B,使用带有供体标记的抗标签a抗体结合蛋白质A,用受体标记的链霉亲和素结合生物素化的蛋白质B产生FRET信号。
图1C,使用带有供体标记的抗标签a抗体结合蛋白质A,并使用带有受体标记的抗Tag-b抗体结合蛋白质B,产生FRET信号。
图1D,使用带有供体标记的抗标签a抗体结合蛋白质A,直接将蛋白质B进行受体标记,产生FRET信号。
以下Thunder Toolbox产品可供选择:
表1. Bioauxilium THUNDER™ TR-FRET TOOLBOX REAGENTSEUROPIUM LABELED ACCEPTOR LABELED Europium-labeled anti-6xHis Acceptor-labeled anti-6xHis Europium-labeled anti-FLAG Acceptor-labeled anti-FLAG Europium-labeled anti-GST Acceptor-labeled anti-GST Europium-labeled anti-V5 Acceptor-labeled anti-V5 Europium-labeled anti-human lgG Acceptor-labeled anti-human lgG Europium-labeled anti-mouse lgG Acceptor-labeled anti-mouse lgG Europium-labeled anti-rabbit lgG Acceptor-labeled anti-rabbit lgG Europium-labeled streptavidin Acceptor-labeled streptavidin -
选择合适的buffer
本实验涉及到的稀释液有两种:蛋白稀释缓冲液和抗体稀释缓冲液(检测缓冲液)。其中蛋白稀释缓冲液需根据文献报道或经验,选择最适合该蛋白结合的缓冲液。抗体稀释缓冲液推荐使用10X TR-FRET Detection Buffer (Catalog No. TRFRET-DB)进行检测试剂的稀释。
THUNDER™ TR-FRET技术适用于广泛的缓冲液和添加剂,并且对许多常用的化学物质具有很高的耐受性,包括洗涤剂、牛血清白蛋白(BSA)和二甲基亚砜(DMSO),如果使用自制缓冲液,推荐使用Tris或HEPES,根据需要添加盐、去垢剂和BSA,并保持pH值在5.5到8.5之间,然后根据需要进一步优化。典型的检测缓冲液是50 mM HEPES pH 7.4,100 mM NaCl,0.1% Triton X-100和0.1% BSA。
Tips:避免在您的检测中使用磷酸盐缓冲液。
例:CRBN与三元复合物结合实验,抗体使用THUNDER™ Anti-His-Eu和SA-FR,可见不同检测缓冲液对实验窗口影响较为明显。检测窗口结果显示,THUNDER™
推荐的检测缓冲液窗口(S/B)最大,表现最佳。
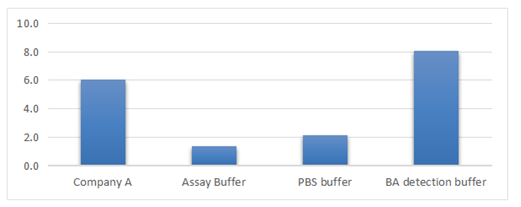
图3. 检缓冲液测对实验窗口(S/B)的影响
△点击放大图片
-
选择最佳的供体-受体组合
为了确定最佳的受体-供体对以用于蛋白质-蛋白质相互作用,需要测试不同的供体和受体标记的抗体组合,以确定哪一对组合能产生最佳的窗口。我们建议您尝试所有受体和供体对的组合,否则可能会错过具有最佳信号窗口的结果。
如以下的PPI实验开发中,发现不同抗体对组合的表现差别很大。
例:在KRAS和RAF1相互作用的实验中,Anti-GST-Eu+Anti-His-FR组合相较于Anti-His-Eu+Anti-GST-FR来说,具有更好的灵敏度及更大窗口(S/B)。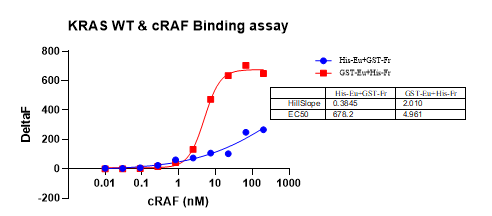
图4. KRAS和RAF1相互作用实验
△点击放大图片 -
确认信号特异性
这个实验的目的是为了确认观察到的信号是特定于两种蛋白质之间的相互作用,而不是由于非特异性效应(在没有蛋白质-蛋白质相互作用的情况下产生的能量转移)。我们建议您进行一个竞争实验,使用未标记的一种蛋白质的高浓度与另一种标记的蛋白质的几种浓度进行对比。未标记蛋白质的剂量应该是实验中标记蛋白质最高浓度的100倍。如果相互作用是特异性的,您可以预期信号显著降低到背景信号水平(图6)。如果您即使在标记蛋白质的低浓度下也无法显著抑制信号,您应该进一步判断是否是蛋白质或其他试剂,如缓冲液成分引起非特异性结果。
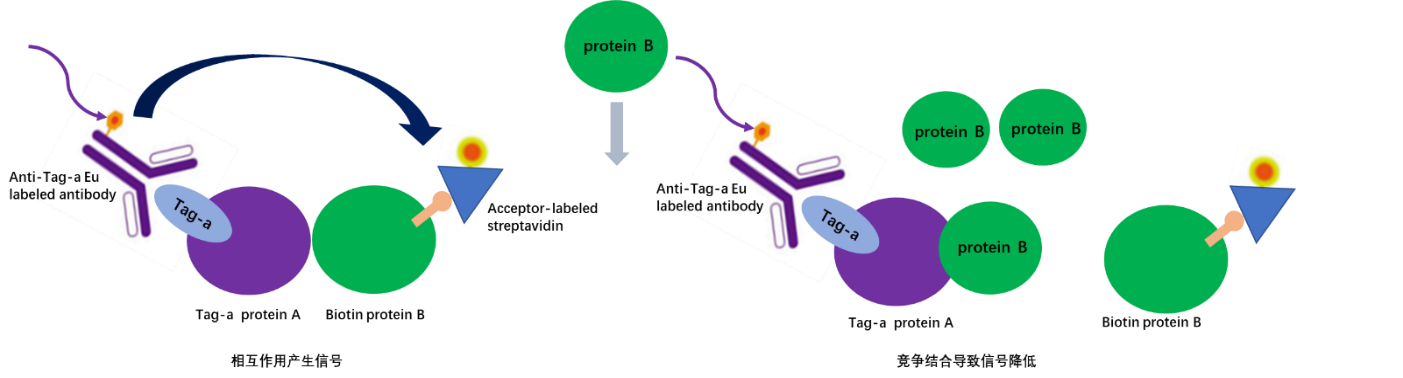
图5. 未标记的蛋白质B的竞争结合导致信号降低
△点击放大图片 -
交叉滴定优化蛋白浓度及抗体浓度
1. 确认蛋白浓度
使用初步确定的最佳的受体-供体组合,对蛋白质进行更广泛的交叉滴定,以确定在检测中使用的最佳蛋白质浓度。实验中应当包括蛋白为0 nM的孔,作为特异性相互作用的阴性对照。如以下实验中,每种蛋白质推荐设置包括0 nM在内的6个浓度进行交叉检测,以确定最优的蛋白浓度来进行后续药物筛选。
例:在GSPT1与DDB1/CRBN binding实验中,分别对两个蛋白进行浓度优化,数据显示,蛋白浓度分别为12.5nM和12.5nM时,获得最佳窗口(S/B),但考虑到蛋白用量及对药物IC50的影响可选择更低浓度作为后续实验条件。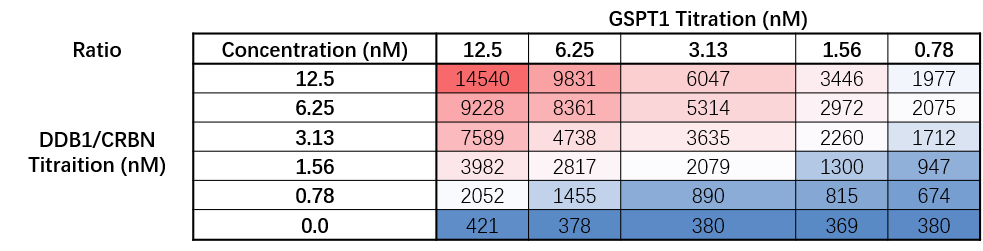
△点击放大图片
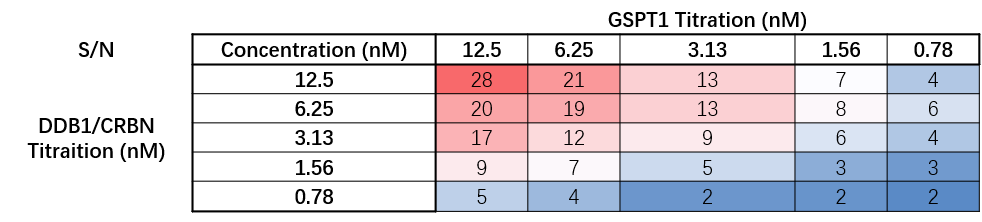
图6.GSPT1与DDB1/CRBN binding
△点击放大图片Tips:蛋白质浓度的选择的原则:
a.选择尽可能高的信噪比(S/B)。
b.蛋白浓度应在曲线的线性部分(在Hook效应之前)。
c.避免比预期的Kd有大量过量的蛋白。
d.减少所使用的蛋白质。
2. 确认抗体浓度
如果之前使用的抗体浓度已经具有可接受窗口(S/B),那么这项实验无需进行。优化受体和供体试剂的浓度可以验证窗口(S/B)是否能够在不增加背景的情况下进一步改善。根据以上实验,确定其中一个蛋白的用量,将另外一个蛋白进行滴定,同时将供体和受体试剂进行滴定,供体的浓度为推荐浓度的2倍、1倍和0.5倍,受体的浓度为推荐浓度的1倍、0.5倍和0.25倍,进行检测。
表2. 抗体浓度优化矩阵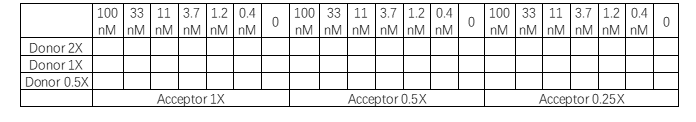
△点击放大图片
-
阳性药检测
通过已知的阳性药来进一步验证检测的有效性,无论是阻断PPI的抑制剂还是促进PPI的介导剂,都可以通过做一条完整剂量反应曲线来进行验证。进行验证时,根据之前的实验中选择两种蛋白质和抗体的最佳浓度进行检测。
例:MRTX1133是KRAS G12D突变体一种选择性抑制剂。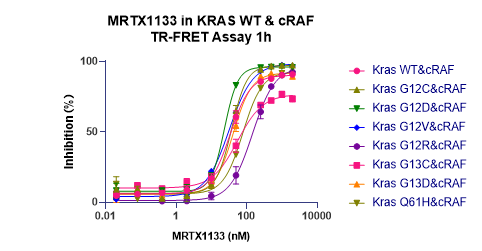
△点击放大图片

图7.KRAS/cRAF抑制剂筛选体系
△点击放大图片该实验使用Anti-6xHis-Eu和Anti-GST-FR检测不同突变的Kras蛋白和cRAF(RAF1)蛋白间的相互作用,MRTX1133从300nM进行2倍梯度稀释,孵育1小时后检测。 数据显示出较好的S/B窗口(~7倍),较高灵敏度及一定选择性(G12D IC50最小)。


