实验步骤
- 1
- 2
-
细胞处理
1.在白色384孔浅孔板加入8μL细胞(按预先优化的密度)。
2.若研究药物为激动剂:
a.加入4μL激动剂(3X)。激动剂可使用无血清培养基稀释。
b.在室温(RT)或37°C下孵育一定时间(实验优化时间),需要确定最佳孵育温度。
3.若研究药物为抑制剂:
a.加入2μL抑制剂(6X)。抑制剂可使用无血清培养基稀释。
b.在RT或37°C下孵育一定时间(实验优化时间)。需要确定最佳孵育温度。
c.加入2μL激动剂(6X)。激动剂可使用无血清培养基稀释。
d.在RT或37°C下孵育一定时间(实验优化时间)。需要确定最佳孵育温度。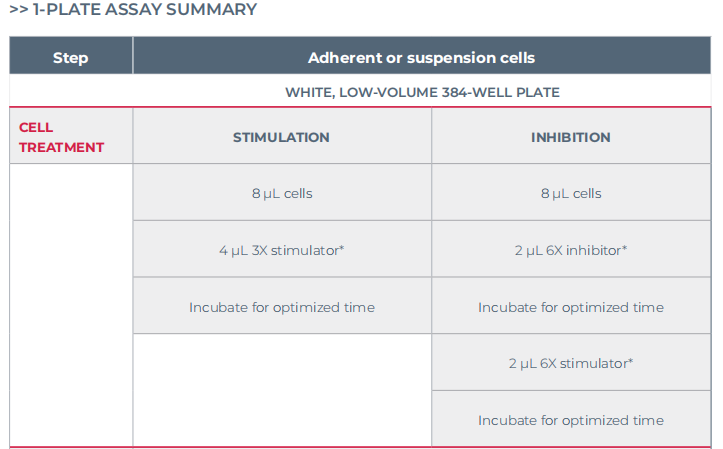
图9. 两板法细胞处理
△点击放大图片 -
细胞裂解
1.加入3μL的裂解缓冲液(5X)。
2.在摇床下孵育30分钟(轨道式平板摇床设置为400 rpm)。裂解孵育时间15-60 分钟之间进行调整。
注意:裂解物可直接用于目标蛋白检测或在-80°C 冷冻。


