贴壁细胞通常在检测前在板中培养过夜,悬浮细胞通常在铺板后立即分配并在悬液中进行测试。
1.用非酶解细胞溶液(如Versene)消化贴壁细胞。
2.用HBSS清洗细胞一次。
3.将细胞以所需浓度重悬于刺激缓冲液中。建议每次检测1,000至10,000个细胞。
4.准备“无细胞”对照(单独使用刺激缓冲液)。
实验步骤
- 1
- 2
- 3
- 4
-
悬浮细胞
1. 细胞在 T175 培养瓶中培养,80%生长度即可。除去培养基,用PBS轻轻冲洗烧瓶。
2. 加入细胞解离液(5mL / T175培养瓶),在37°C和5% CO2条件下孵育板5-10分钟或直到细胞脱落。
3. 加入5mL PBS至最终体积10mL,混匀直到细胞均匀分布。细胞悬液以340 g离心3分钟。
4. 计算重悬细胞颗粒所需的刺激缓冲液体积,以达到最佳细胞密度。
Tips:在重新悬浮细胞时,一定要使用刺激缓冲液。 -
贴壁细胞
1. 细胞在 T175 培养瓶中培养,80%生长度即可。除去培养基,用PBS轻洗烧瓶。
2. 加入细胞解离液(5ml / T175 培养瓶),在37°C和5% CO2条件下孵育板5-10分钟或直到细胞脱落。
3.加入5ml PBS至最终体积10ml,混匀直到细胞均匀分布。细胞悬液以340 g离心3分钟。
4. 计算重悬细胞所需的刺激缓冲液体积,以达到最佳细胞密度。
可以选择细胞培养处理过的孔板或聚d-赖氨酸包被板。准备将细胞分配到实验板中37°C, 5% CO2孵育过夜。
5.去细胞上清,转板,开展实验。 -
冻存细胞
1. 在37°C的水浴中快速解冻冷冻细胞,直到完全解冻。
2. 将细胞转移到小瓶中,加入10ml PBS。340 g 离心3分钟。
3. 弃上清,将细胞重悬在刺激缓冲液中。
4. 测定细胞密度和活力。
5. 在刺激缓冲液中稀释细胞以达到实验所需的细胞密度。 -
实验设置
表3.不同cAMP检测流程
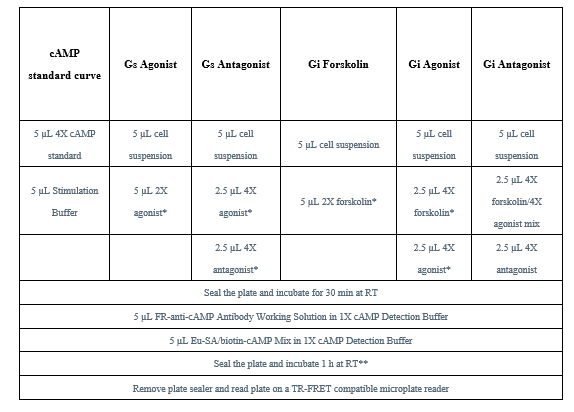
△点击放大图片
Tips 1:未经处理的细胞用相同体积的刺激缓冲液,并与处理过的细胞孵育相同的时间和温度。
Tips 2:可以孵育18小时后进行读数,不会对结果产生影响。
Tips 3:不要将FR-anti-cAMP和Eu-SA/biotin-cAMP预混。


