实验步骤
- 1
- 2
- 3
- 4
- 5
-
Forskolin (FSK)浓度优化
在研究Gi信号通路时,建议优化FSK浓度和相关的最佳细胞密度。可以对每个细胞密度进行实验分析,单独检测FSK的全剂量反应(基础细胞水平)或用最大剂量的激动剂进行预处理(处理细胞水平)。 处理细胞水平/基础细胞水平之比给出了每种条件下可获得的最大检测窗口。
建议使用达到cAMP水平的EC50的FSK浓度。该值应对应于基于TR-FRET信号的FSK EC80-EC90值。注意所选择的FSK浓度不应超过cAMP标准曲线的工作范围(IC10)。 -
最佳细胞密度
优化细胞密度是获得最佳可能结果的关键。过低的细胞密度可能会导致cAMP产生不够(用FSK处理后)。过高的细胞密度可能会使测定窗口急剧减小。建议在不同细胞密度下绘制FSK(Gs和Gi偶联受体)或完全激动剂(Gs受体)浓度-响应曲线,以确定每孔的最佳细胞密度。
建议每孔测试1,000到10,000个细胞。最佳细胞数为FSK或激动剂浓度-反应曲线覆盖cAMP标准曲线的大部分工作范围(指参考激动剂剂量反应在标准曲线的IC90-IC10范围内的细胞密度),同时使测定S/B最佳窗口。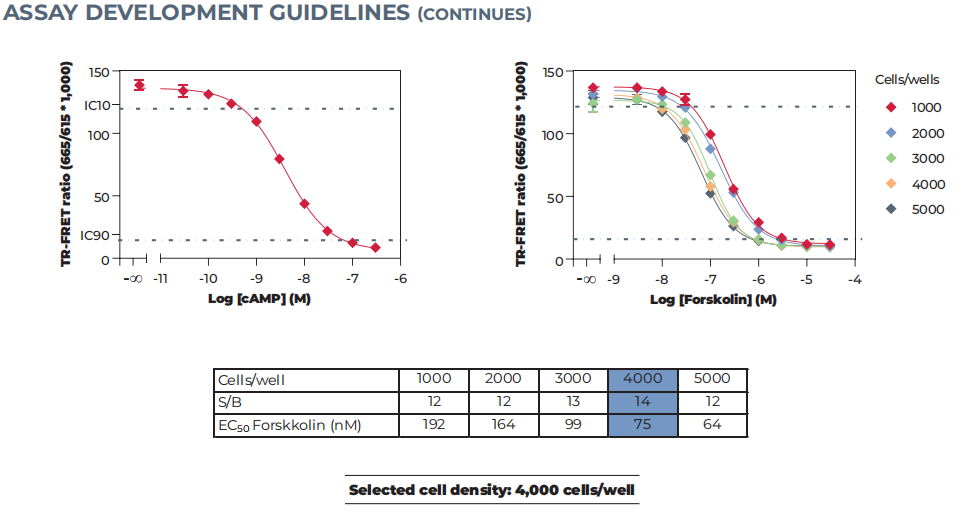
图21. 优化细胞密度
△点击放大图片左图为cAMP标准曲线;右图为细胞与福斯克林交叉滴定。在本例中,获得的FSK浓度-响应曲线显示,4,000个细胞/孔数据落在cAMP曲线的工作范围内,同时最大化测定S/B。
-
确定药物刺激时间
激动剂的刺激时间会显著影响实验的结果。缓慢结合的激动剂需要更长的预孵育时间。激动剂的动力学作用可能存在很大差异,所以必须确定药物刺激时间。
需要激动剂绘制处理细胞以绘制Gs和Gi受体的拮抗剂浓度-反应曲线,建议使用基于cAMP水平的EC50浓度的激动剂。这个值应该对应于基于TR-FRET信号的激动剂EC80-EC90值。请注意,所选择的激动剂浓度不应超过cAMP标准曲线的工作范围(Gs受体的IC10;Gi受体的IC90)。 -
确定药物浓度
1.在96孔板将化合物连续稀释到刺激缓冲液中,制备2X或4X(取决于cAMP测定的类型)稀释系列测试化合物。
注意:建议至少重复的12个点,绘制半对数区间浓度-响应曲线,以准确估计EC50或IC50。2.DMSO可溶性测试化合物,在100% DMSO中进行初始稀释,然后用刺激缓冲液连续化合物,得到2X (2% DMSO)或4X (4% DMSO)稀释。在10µL细胞处理步骤中,大多数细胞可以耐受高达1%的DMSO。
注意:溶解在DMSO溶质中的化合物进行检测前,必须确定对DMSO的测定耐受性。处理过的细胞和未处理过的细胞之间保持相同的溶剂浓度。此外,当测试化合物的一系列稀释时,溶剂浓度在稀释系列中应始终保持恒定。
-
磷酸二酯酶(PDE)抑制剂
IBMX浓度:IBMX是一种广泛使用的cAMP磷酸二酯酶非选择性抑制剂,EC50在7 ~ 50µM范围内。通过抑制PDE,IBMX保证cAMP的积累。
建议在Stimulation Buffer中使用浓度为0.5 mM的IBMX。在这个浓度下,IBMX不会降低cAMP标准曲线中的信号,适合大多数细胞类型中的 cAMP 积累。如有必要,还可以进一步优化实验中使用的 IBMX 浓度。IBMX对药物药效的影响及最佳浓度应根据实验结果和所用的细胞模型确定。IBMX可以在高浓度(500 mM)下制备,并在-20°C下保存,避免多次冻融循环。使用已知的参考激动剂分析细胞。最佳IBMX浓度是测定窗口最大化的浓度。


