- 1、流式数据分析之对照设置你设对了吗?
- 2、死活染料犯了选择困难症
- 3、我荧光素亮不亮和你固定破膜剂有什么相干的?嘿!还真有!
- 4、流式分析的圈门思路之--先分析淋系还是髓系?
- 5、流式里的平均荧光强度: 元芳,你怎么看?
1、流式数据分析之对照设置你设对了吗?(点击返回目录)
可能很多老师在分析数据的时候都有想过,流式图该把门圈在哪里才比较靠谱?尤其是那些分群不明显的结果,画门位置就是最大的苦恼。做流式我们知道几种常见的对照:1.空白对照(未染色细胞);2.单阳对照;3.同型对照;4.FMO对照;5.生物对照。了解这几种对照的正确用法基本可以使流式数据的分析更客观更准确。接下来罗工就和大家聊聊这几种对照的用法。
空白对照
作用:作为电压调节的参考,上机调电压的时候先要用空白管上机,调整电压参数使细胞信号在图上各个通道的合适位置;同时也是可以看到细胞的本底信号,圈门时直接排除。
但我们有时候会发现,常规的未染色管(空白对照)似乎不足以帮助我们确定圈门位置,如下图案例展示。这是什么原因呢?
首先,图上空白是未经药物处理的空白细胞,但是高浓度药物很可能会增加细胞的本底荧光信号,如果还按照未处理细胞圈门,可以从分群情况明显看到门不太适用于该样本。这种情况就要注意空白细胞的选择要合适,最好是与实验组经过相同处理的细胞,比如做了固定破膜、加了药物处理等,也就是除了不加抗体,其他处理都一致,这样本底信号的排除才更加准确。

△点击放大图片
单阳对照
单阳对照,也就是单染对照。
作用:做单染调补偿是其主要作用,也可以协同调电压,防止阳性信号超出接收范围。
单阳对照,很多老师都有疑惑,我们现在把问题一一罗列出来。
1. 做单染的细胞如何选择,可以混合细胞做吗?
2. 单染阴性阳性信号分不开?
3. 做单染的细胞数量不够?
4. 单染调完补偿应用到样本上不适合?
解决上述问题我们首先要了解做单阳管的基本原则。
• 单阳细胞阴阳群背景信号要一致,不能混合细胞做单阳;
• 单阳信号要要阴阳分群明显,足以判断补偿是否合适;
• 单阳染的荧光抗体,荧光要跟样本一致,不能用同通道其他荧光代替;
• 单阳收集记录的events数要足够,避免因数据太少导致补偿计算差异太大。

△点击放大图片
因此,单阳可以用细胞,也可以用补偿微球,但是不能混合在一管染,细胞也最好是跟样本接近的类型,不要两种相差很大的细胞混合在一起做(如药物处理和未处理的细胞混合做单阳); 如果细胞单染阳性分群不明显,可以选择相同荧光素的高表达marker抗体染细胞(如foxp3/AF647用CD8/AF647抗体代替做单染),也可以用补偿微球代替细胞做单染;收集记录的单阳数据至少要5000以上,确保后续补偿值计算的准确性。
同型对照
作为排除背景荧光的对照,试用同型对照可以更准确的排除假阳性,也能帮助验证抗体的特异性。
作用:1.看荧光染料与细胞的结合问题;2.看抗体FC段与与细胞FCR的结合;3.看抗体与细胞的其他非特异结合。
举个例子:参考空白圈的会有部分非特异染色,参考同型圈阳性,就把这部分非特异排除了。

△点击放大图片
很多验证抗体的特异性也会用同型做QC,比如BD官网的QC图基本都要用同型来做,如下图(截自BD官网):

△点击放大图片
或者结合指标抗体与同型抗体一起看某抗体的特异性,如下图看CX3CR1抗体的特异性(截自流式中文网):

△点击放大图片
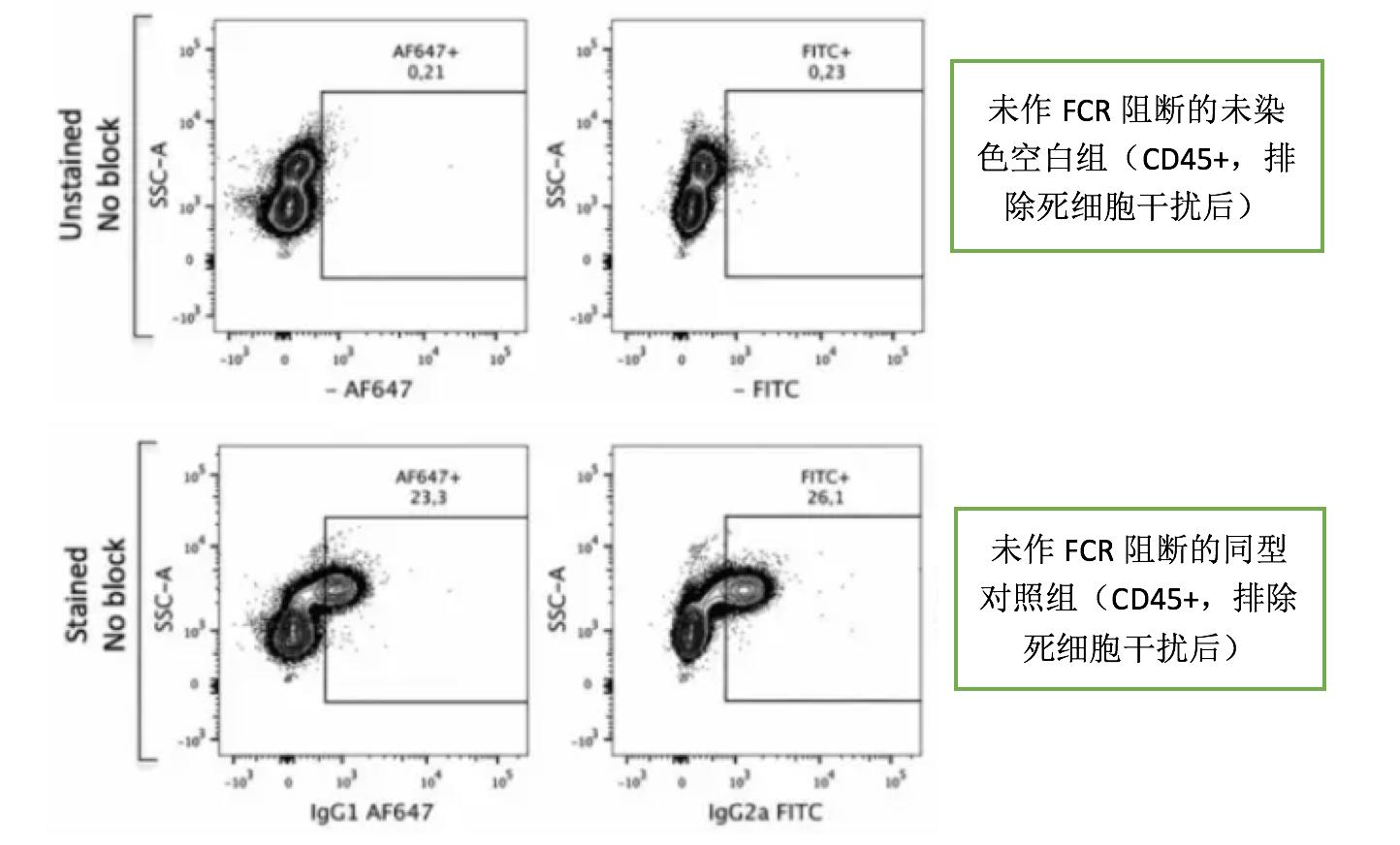
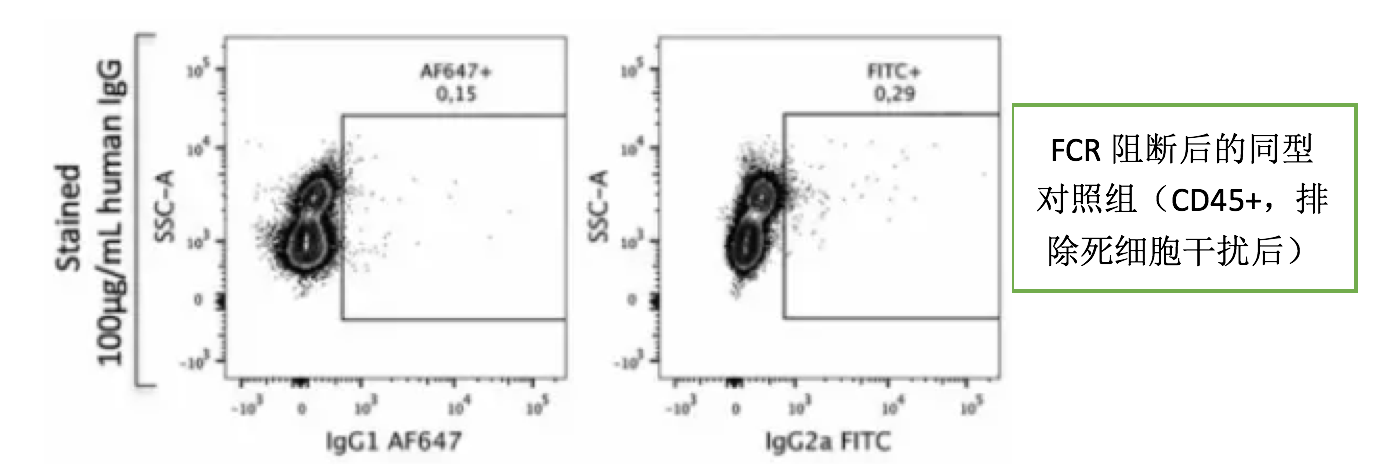
但是,有些时候我们会发现,同型抗体不适用了,因为同型对照的阳性已经比实验管的阳性高了,已经很难判断真正的阳性比例。这个时候我们首先要排除是否选错同型抗体,因为同型抗体的选择有几个基本原则:与目标抗体同宿主来源、同亚型、同荧光素、同蛋白浓度。然后就要看抗体的非特异结合问题。我们来看一下FC段与细胞FCR的非特异结合影响有多大(图来自流式中文网)。
△点击放大图片
△点击放大图片
可以看出,IgG1和IgG2a亚型的抗体跟细胞的非特异结合比较强,加了FCR阻断剂之后就好很多,FCR阻断剂可以避免大多数非特异染色,也就是用了FCR之后基本可以不用再做同型对照了。

△点击放大图片
FMO对照
对于FMO对照可能很多老师比较陌生,我们在做多色panel的时候,可能会发现一些通道信号特别难看,不好区分,可能就是某个荧光对该通道干扰很大,我们就可以用FMO对照(荧光扣除对照,抗体减一)来找到是哪个荧光的影响,这是它的用途之一;

△点击放大图片
另外一个用途就是,可以作为某些指标的阴性对照,排除全染的背景影响,帮助我们更准确地圈门。如下图所示。
用FMO去画门会比空白对照画门更加准确,有些分群不明显,或表达不高的的指标都可以做FMO对照去作为画门参考。

△点击放大图片
生物对照
这个就是在我们做一些样本处理时就要设置好的Control组,或者增加一些生物指标做参考,来判断实验处理的效果如何。

△点击放大图片
做刺激处理的时候为了确定刺激效果,就可以做一下未刺激的对照,看相应的细胞因子检测情况,如下图所示。可以去排除一下是刺激剂问题还是抗体染色问题。

△点击放大图片
以上就是我们做流式,需要掌握的对照设置问题,做好对照,才能排除分析过程中遇到的各种疑问,分析的结果也会更加客观有效。
2、死活染料犯了选择困难症(点击返回目录)
最近我们收集到很多老师在做流式实验的时候,对死活染料不知道怎么选择,也不知道该不该用这个染料。那几天罗工就给大家聊一下这个问题。
我们在做流式实验的时候,从样本制备到染色离心等等不可避免的会造成细胞死亡,更何况是冻存和复苏之后的细胞,肯定也会有很多细胞死亡。这个死细胞是有自发荧光的,它一方面会使背影信号增加,同时也会有一部分的非特异性染色,造成我马上数据不够严谨,甚至会有一坨细胞在斜45度角,不管我们怎么调都调不动,使我们的流式图很丑。
一般情况下,我们有三种排除死细胞的方式。
1:传统的DNA结合染料
像PI,DAPI,7-AAD这些都是与细胞内部的DNA结合,他们不能透过完整的细胞膜,所以活细胞是染不上这些染料的。但值得注意的是,这些染料是在上机前几分钟加入,不能时间太长,时间久了,对细胞有一定的毒性,活细胞也会染上。
还需要注意的一个点就是如果我们有做胞内或者核内染色,细胞经历了固定破膜步骤,也不能使用这一类染料,否则我们上机检测出来的都是阳性信号。
2:新型的蛋白质结合染料(FVS系列荧光染料)
这一类染料是与蛋白质发生共价反应的,那他们结合之后在流式图上的展示就是死细胞是强阳性,活细胞呈现弱阳性。因为这一类染料会与活细胞表面的极少部分的胺相结合,会与死细胞内部更多的胺相结合,所以我们可以根据阳性信号的强弱进行区分。下面给大家展示一些死活染料供大家参考。

△点击放大图片
3、我荧光素亮不亮和你固定破膜剂有什么相干的?嘿!还真有!(点击返回目录)
如果某天,你发现指标染不上颜色,也许是因为。。。
A:罗工罗工,我最近在做一个phosflow实验,但是CD4就是检测不到,能帮我看看吗?
B:phosflow需要注意的小tips还是挺多的,你的CD4搭配的什么荧光呢?
A: percp-cy5.5
B:那就难怪了,我来跟你唠唠,在做流式实验的时候我们选择固定破膜剂的目的是为了对细胞膜进行形态固定以及细胞膜穿孔,但是不同的试剂因为其成分和剂量不同,所能达到的效果和适用的实验也不同。常见的固定剂比如有多聚甲醛,乙醇等,破膜剂有甲醇等有机溶剂以及皂素,Tween-20等去污剂。当然一般做流式不太建议用自制的固定破膜剂,而是用一些商品化试剂,这样可以减少很多因素的干扰。比如你这个phosflow实验来讲,这一类实验一般根据要求,会选择不同的磷酸化的破膜试剂,最常见的就是perm III ,这里举例BD的558050。

△点击放大图片
这一类破膜试剂,相较于破胞膜,破膜程度更为剧烈,这也造成了一个非常大的影响,它会比一般的固定破膜试剂更容易造成荧光素的淬灭。

△点击放大图片
经过测试,我们发现对于Percp-cy5.5这个荧光素,使用perm Buffer III时对应的的信号完全没有的,也就是说这个荧光素造成了淬灭,这也就是你检测不到这个指标的原因。
A:天呐,原来是这样,那我应该怎样选择荧光素?
B:如果你不想换通道,可以用Percp-cy5.5的相同通道的替代荧光素BB700,这个的影响相对小一点,或者也可以换其他受固定破膜剂影响小的荧光素。
A:这个可以有,罗工,如果是其他的荧光素,我这个实验还有哪些不能用的吗,我做的多色荧光较多。
B:你可以参照这张表:

△点击放大图片
这个表现的是用CD4这个指标来检测的不同固定破膜试剂对各种荧光素的影响,尽量不用红色的即可。
A:哇塞,罗工YYDS!
B:方案设计的配色过程除了考虑这些影响,还有补偿溢漏,以及指标和荧光素强弱搭配,还有是否存在共表达等很多因素,以后我们再慢慢讨论这些,当然,如果有问题也可以直接找到小优凹~
A:好的罗工!非常感谢您的解答。
4、流式分析的圈门思路之--先分析淋系还是髓系?(点击返回目录)
最近一段时间,罗工发现越来越多的老师开始着手进行或者设计多色流式免疫亚群的检测方案,所以最近几期会着重和大家聊聊多色流式的圈门分析思路,旨在帮助大家更好的在实验后完成自己的数据分析,得到更准确的流式结果。
多色流式免疫亚群的检测是当下的一大趋势:
一方面,更多的指标让我们在一份样本中同时获取了更多的免疫亚群的比例信息,减少了我们的实验工作量,分担了我们的工作压力和试剂损耗;
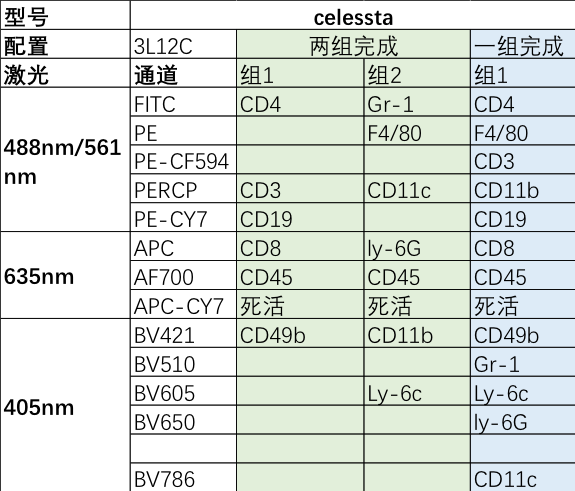
例如下图:相比两组完成的流式方案,选择一组完成的多色方案会更节约CD45和死活染料的试剂,同时减少一半的样本损耗和大量工作时间:
△点击放大图片
另一方面,单样本多指标的检测有利于我们后续对实验结果进行更多的算法分析,例如现在流行的一些降维和聚类分析。
例如下图,利用降维分析T-sne直接获得多细胞亚群的可视化关系:
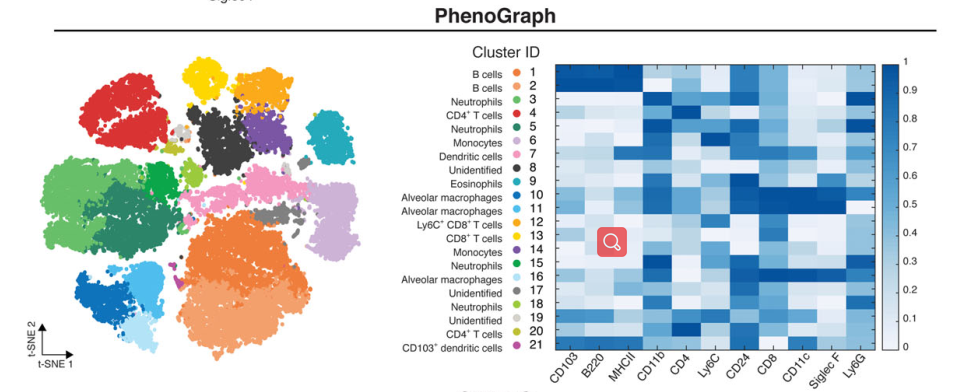
△点击放大图片
因此,我们有很多老师会选择将一些淋巴和髓系的细胞亚群marker同时标记于一个样本,期望获得不错的流式结果,那么在圈门分析时应该是先圈淋巴亚群,还是先圈髓系呢?
今天罗工就在这里给大家讲讲,在同时分析多细胞亚群的流式结果时,个人推荐先圈髓系亚群。理由如下:
1. 髓系亚群的FSC SSC更大,大面积会有更多的非特异性抗体着色,我们会发现一些淋巴亚群的marker在髓系上也有着细微的非特异性表达,如果直接圈取,等于增加了淋巴亚群的假阳性信号:
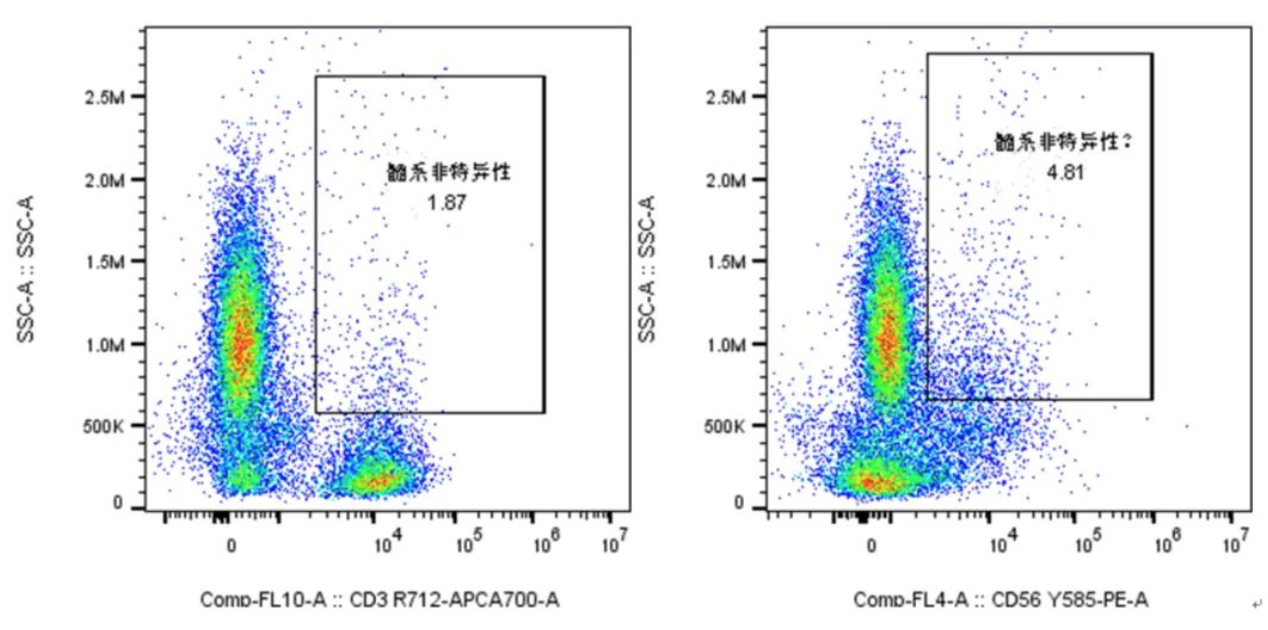
△点击放大图片
如上图,我们看到在SSC med-high的位置 均存在CD3/CD56的阳性表达,这是不太符合常规的淋巴细胞位置的,很可能就是髓系细胞的非特异性着色;
2. 髓系亚群的形态更难确定,需要通过biomarker来完成样本的筛选;
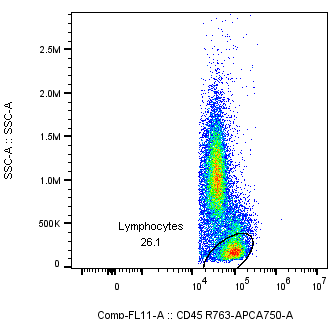
△点击放大图片
相对而言 CD45high ssclow更容易获得淋巴细胞的位置,而髓系细胞的位置相对弥散也不够成群(包含单核+粒细胞群),更需要biomarker的定位来获得。
综合如上两点,我们可以选择先圈出髓系来排除非特异性结合,再来精准的根据细胞形态&biomarker来圈出淋巴亚群:
对比两组圈门:
1. 先淋巴,后髓系:
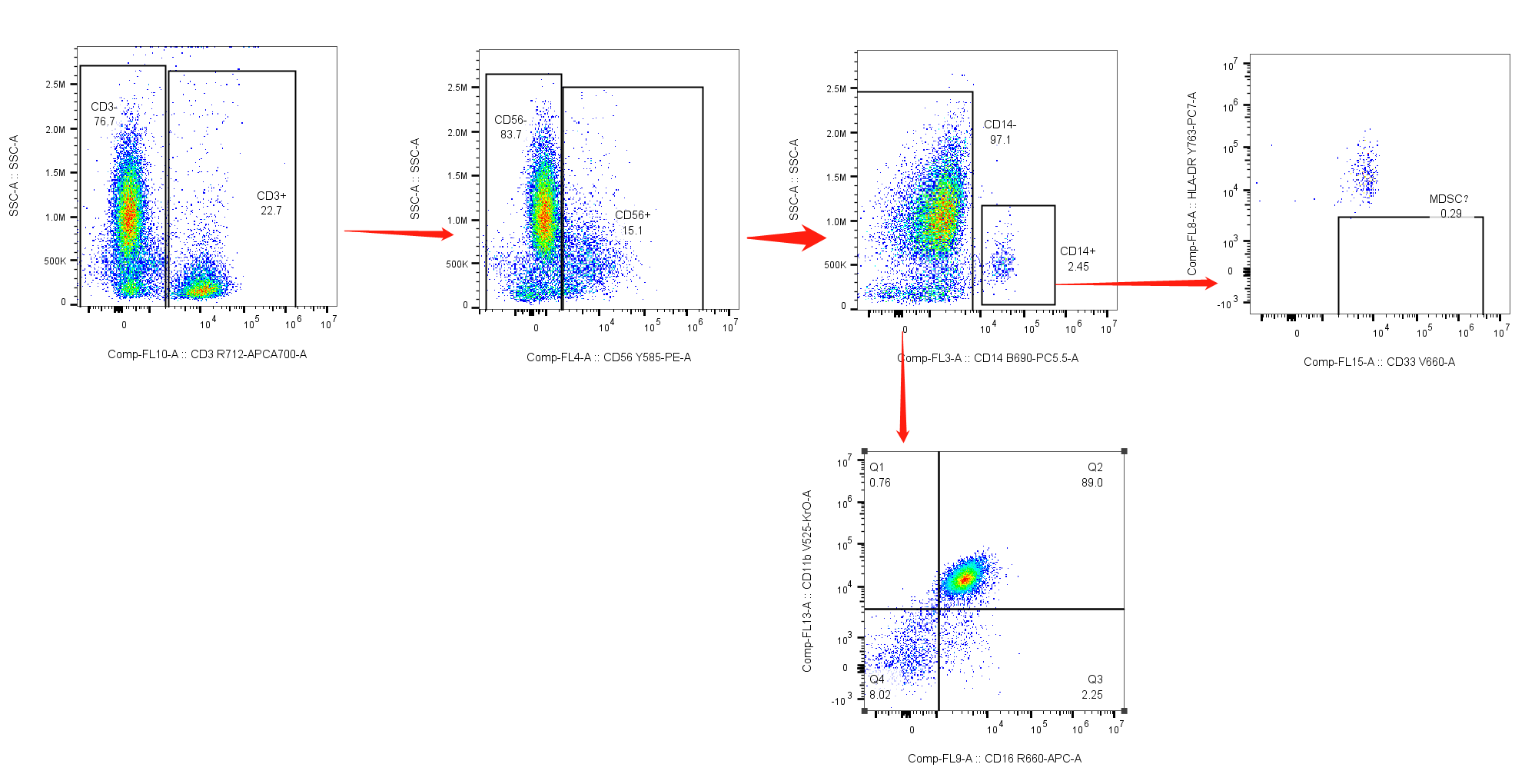
△点击放大图片
2. 先髓系,后淋巴:
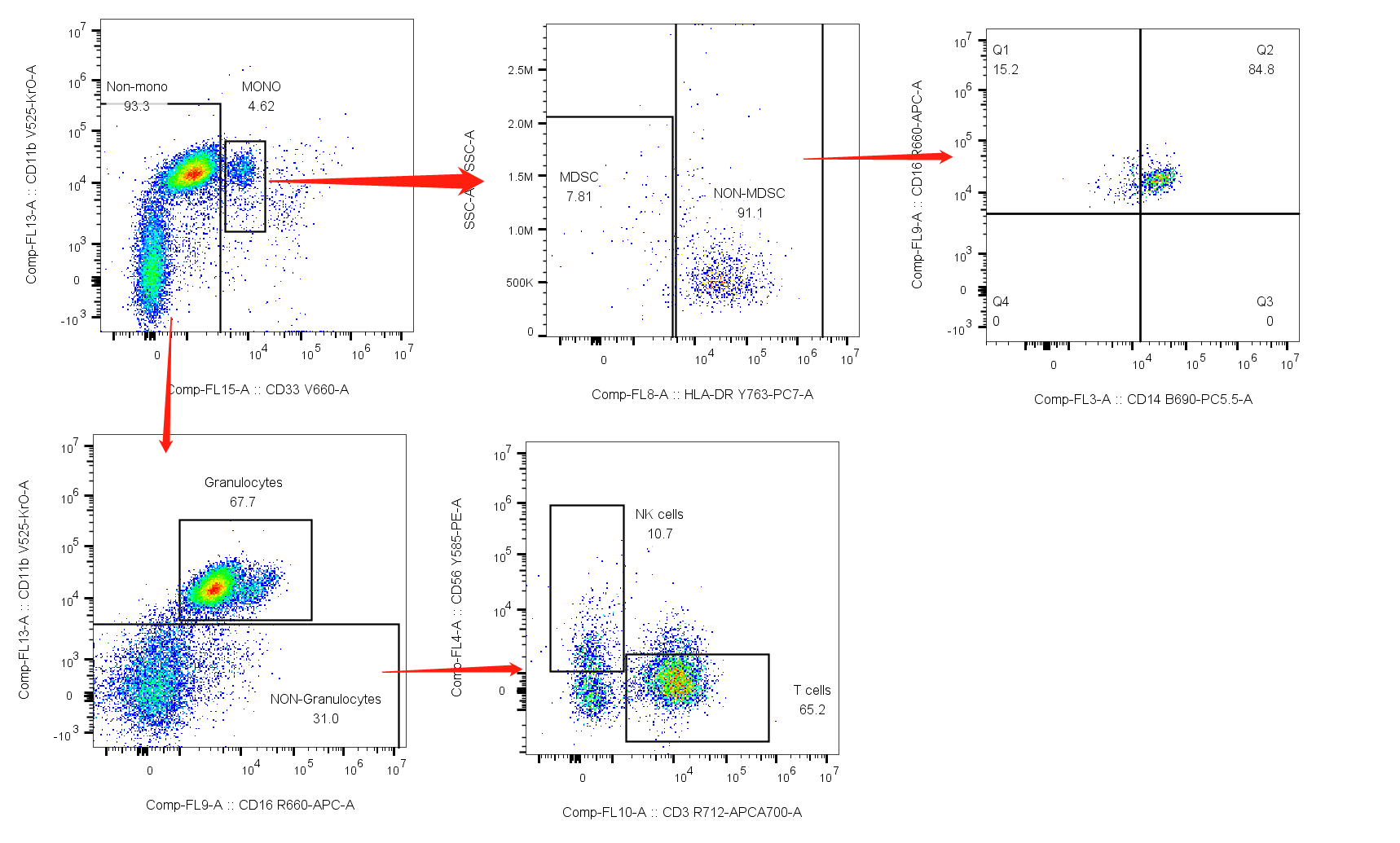
△点击放大图片
此时淋巴亚群的SSC/淋巴的图如下,对比直接圈,这样的非特异性统计就会大大降低了:
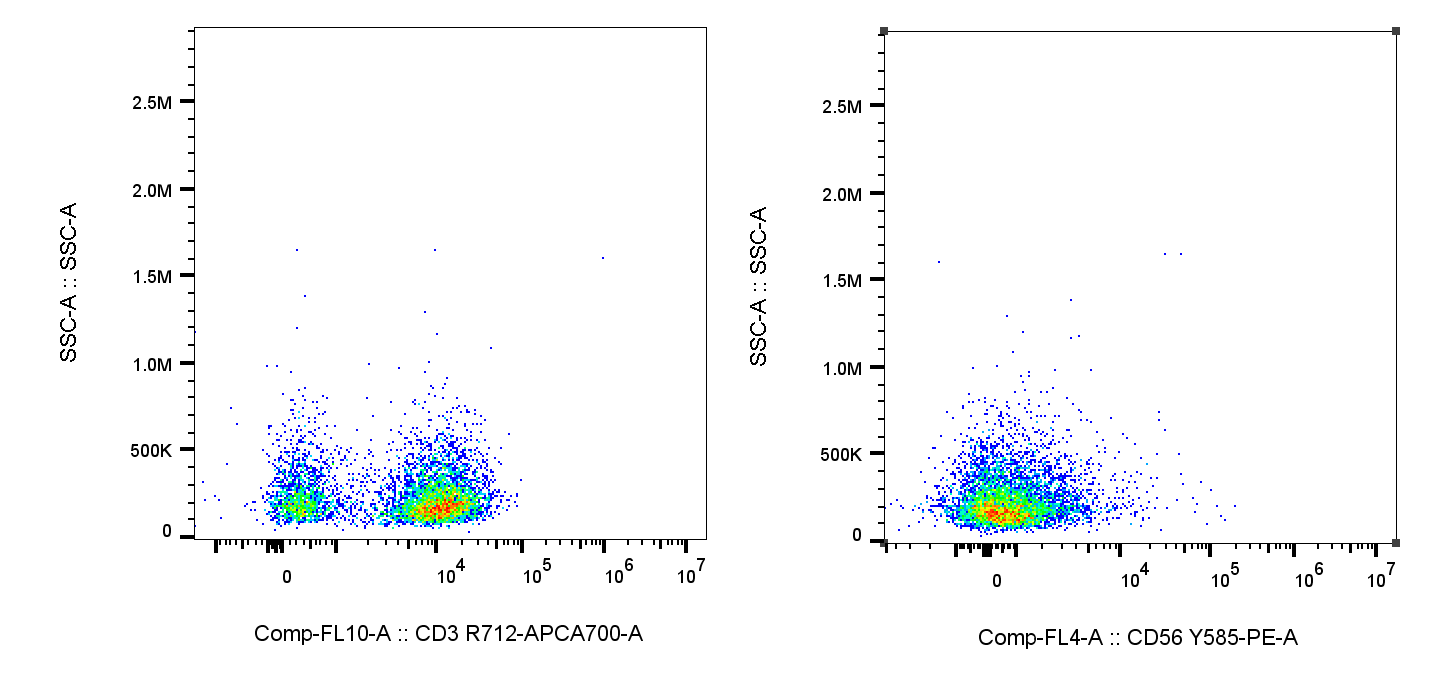
△点击放大图片
5、流式里的平均荧光强度: 元芳,你怎么看?(点击返回目录)
最近碰到很多老师提问:“罗工,文献里提到的流式MFI结果我在哪找到他啊?”
今天罗工就来教大家怎么从flowjo这个软件里找到并统计MFI。
打开flowjo,拖入样本分析模板:
首先,找到待分析的门:
例如:观察NK细胞中CD16的MFI,我这里就应该选中NK cells门,切记不要选择CD16+这个门,很多老师的误区认为应选择CD16+的门,但是选择了CD16+的门得到的MFI就是CD16+的MFI了,而不是NK细胞中CD16的MFI:

△点击放大图片
其次,右键当前门,选择添加参数:
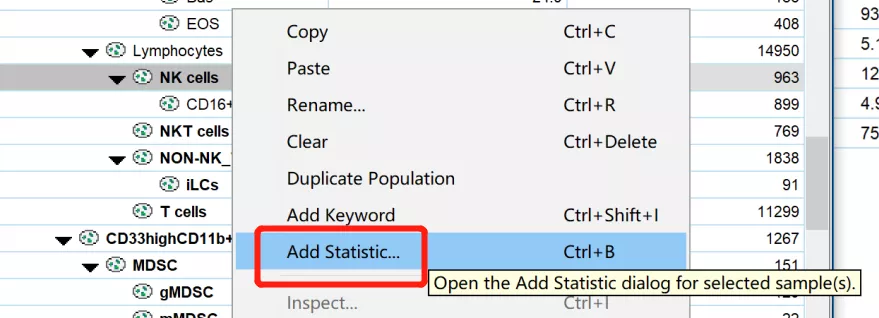
△点击放大图片
跳出的界面中,选择添加median,mean,geo mean或者mode,选择通道为CD16:

△点击放大图片
点击add,这样原门下就会出现相应的统计结果了:

△点击放大图片
我们再把这个结果代入组分析后进入table editor,就可以进行批量的数据分析了:

△点击放大图片
到这里,很多老师就会问第二个问题了,罗工文献里的MFI是平均荧光强度,那这里的median,mean,geo mean和mode,谁才是平均荧光强度呢?
其实这些都是平均荧光强度,但是不同的流式结果对应的是不同的选择,怎么选择呢?罗工总结了一下:
当流式结果为线性正态分布时,mean更接近MFI,代表流式实验为细胞周期倍体等线性轴的结果;

△点击放大图片
当流式结果为对数正态分布时,geo mean更接近MFI,代表流式实验为一些普遍蛋白表达类的结果,例如一些在细胞上全部表达的蛋白指标,当然这种情况相对少一些;

△点击放大图片
最常见流式结果往往是对数,而非正态分布的,此时通常推荐选择median,Median不受数据形态分布的影响,不需要是正态分布,可以减少异常值对整个数据的影响,是流式里面用的比较多的一个统计值。

△点击放大图片
至于mode,我们使用的就比较少了,mode往往只是为了统计最高峰,对应流式就是表达最多的细胞所在荧光强度,这种只在很少的情况下才会和MFI重合。

△点击放大图片
所以总结来说,median胜出更多的场景,在大部分情况下我们选择Median作为MFI的结果。
怎么样,这样一来你会从你的数据中调用MFI了嘛?