- 1、多色流式串色严重怎么破?
- 2、如何避免抗原抗体的非特异性结合
- 3、细胞自发荧光对流式配色的影响
- 4、如何确定一些陌生荧光素,在流式细胞仪上是否可用?
- 5、有时候用新荧光染料替代传统荧光素结果分群更好凹~
- 6、抗体上荧光染料的染色指数——SI值如何计算
1、多色流式串色严重怎么破?(点击返回目录)
在做多色流式实验中,很多老师都会遇到的一个问题就是,染料之间串色太严重,补偿太难调了!可谓是“众口难调调众口,补偿难调调补偿!”
那么,除了在一开始配色的时候通过小优进行免费的方案设计及优化升级外,我们还能做哪些来减少荧光素之间的非特异性相互干扰呢?
这里给大家介绍一款神奇buffer“BV stain buffer”(BSB),增强抗体稳定性,减少荧光间干扰,用了的老师都说好!
光说不靠谱,有图有真相。
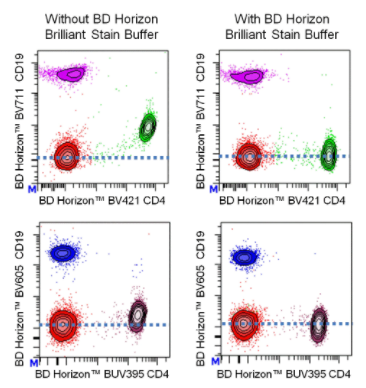
△点击放大图片
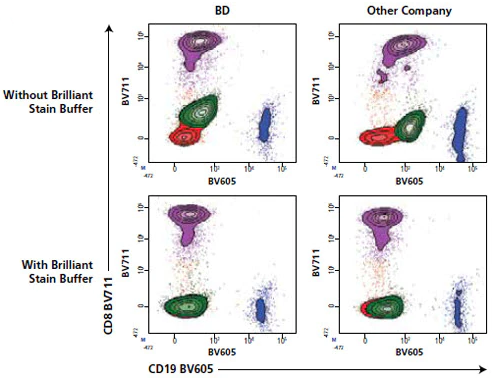
△点击放大图片
到底为什么会出现这种补偿不足,或阴性的离散群体现象呢?
想要实现如今的多指标在同一panel中进行同时染色的需求,就一定会用到BD专利的sirigen荧光素系列标记的抗体,当多种 BV/BUV/BB染料同时使用时,我们经常会观察到一些如上图的假阳性信号。这种情况多发生在多色染色中,而在2个及以下该系列染料共同使用时并不会出现这种现象。这与染料本质为由有机多聚物构成有关。这种异常信号与抗体结构中含聚乙二醇(PEG)有关,样本中经常会含有的抗PEG的抗体,特别是人的血液样本中,尤其是COVID-19疫苗广泛接种后,增加了血清中含有抗PEG抗体的频率。
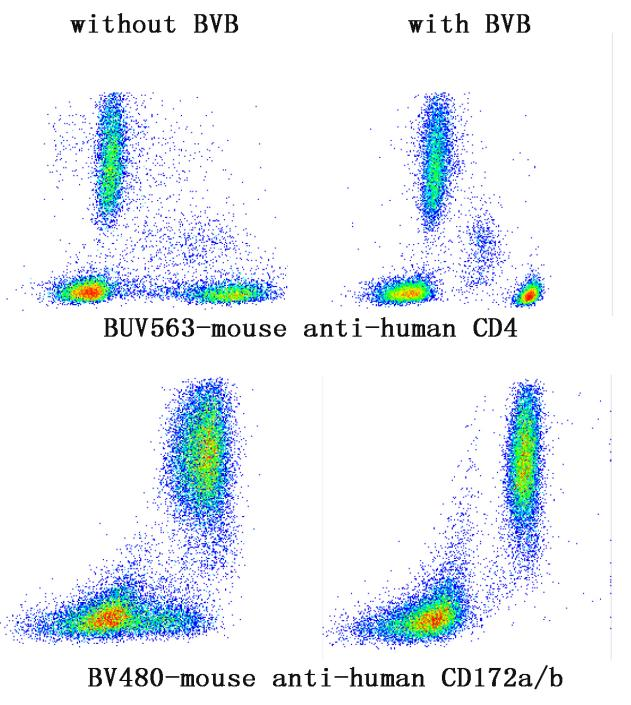
△点击放大图片
Brilliant Stain Buffer 在抗体添加之前加到样品中,不仅可以减轻这些因供体中存在抗PEG抗体原因所造成的虚影,提高染色质量,还有可以稳定预混抗体保存至少 24 h等功效哦。 下表为常见的含PEG的荧光染料:

△点击放大图片
Brilliant Stain Buffer产品详情:
| 货号 | Buffer name | Size |
| 563794 | BD Horizon™ Brilliant Stain Buffer | 100 Tests |
| 566349 | BD Horizon™ Brilliant Stain Buffer | 1,000 Tests |
| 566385 | BD Horizon™ Brilliant Stain Buffer Plus | 1,000 Tests |
| 659611 | BD Horizon™ Brilliant Stain Buffer | 2.5 mL |
2、如何避免抗原抗体的非特异性结合(点击返回目录)
流式实验中,为了让我们的实验更严谨,更好的分辨出阳性信号,我们都会采用各种对照来辅助圈门。
这些对照管只能帮助圈门的判断,并不能从本质上解决非特异性的抗体染色背景问题。
那该怎么办呢?
抗原抗体非特异性结合,大部分来源于抗体的保守区域FC端与细胞表面的FC受体(FCR)的结合。

△点击放大图片

△点击放大图片
多数免疫细胞,比如B细胞、单核/巨噬细胞、DC细胞、粒细胞、γδT细胞等,表面都会表达FCR,从而导致假阳性结果:
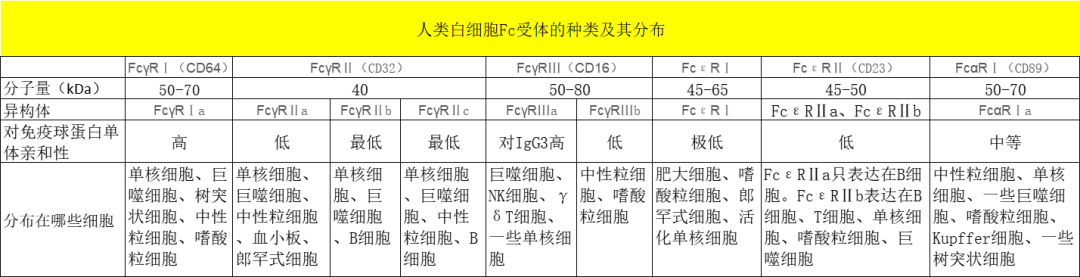
△点击放大图片
所以为了减少非特异性染色,在抗体染色之前,进行FCR阻断是很必要的呢!!
下图的结果,未进行FCR和进行FCR阻断,结果形成了明显的差异,也验证了FCR阻断的必要性。
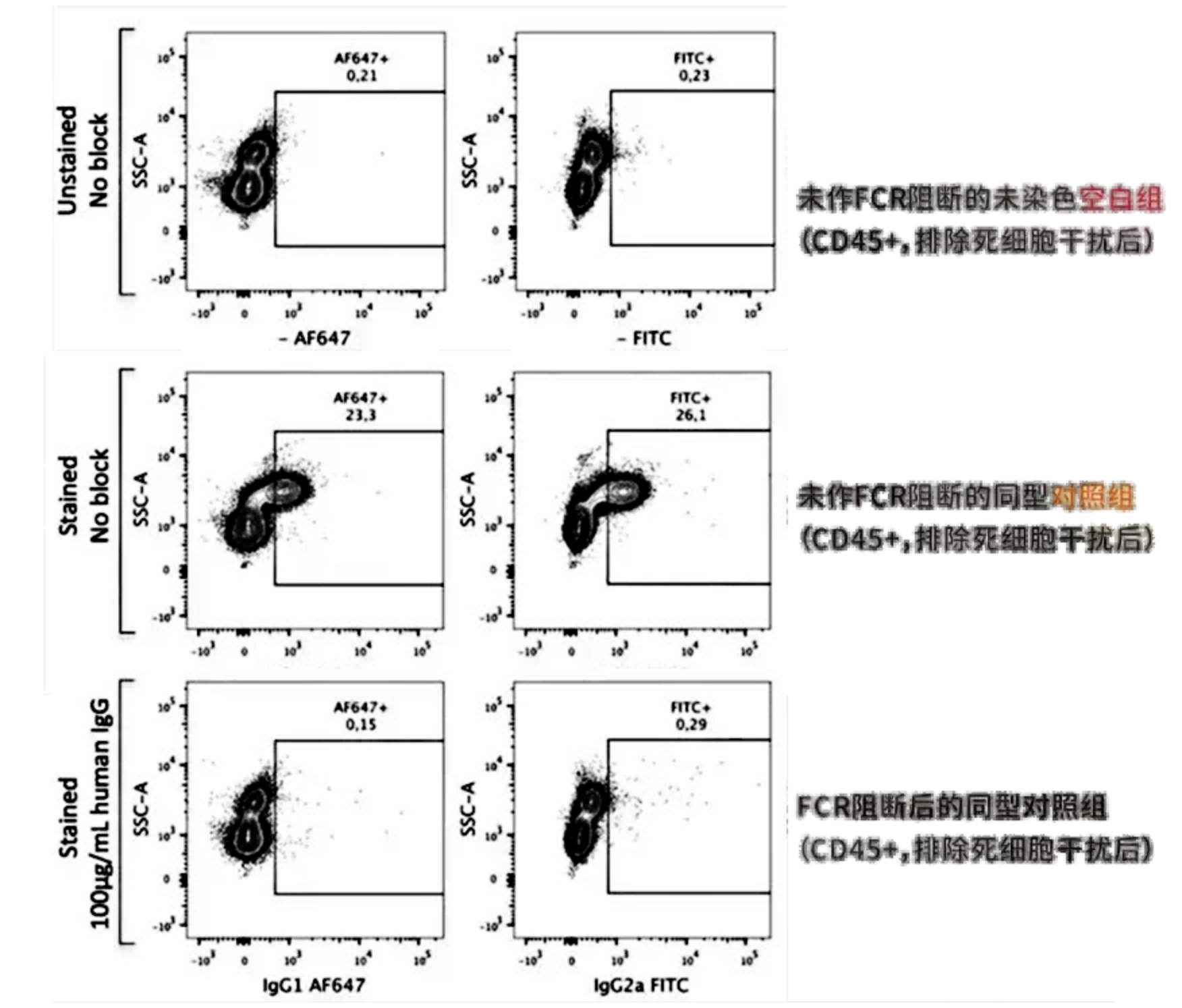
△点击放大图片
样本是CD45+的白细胞,并且排除了死细胞和粘连体(图片来源于流式中文网)
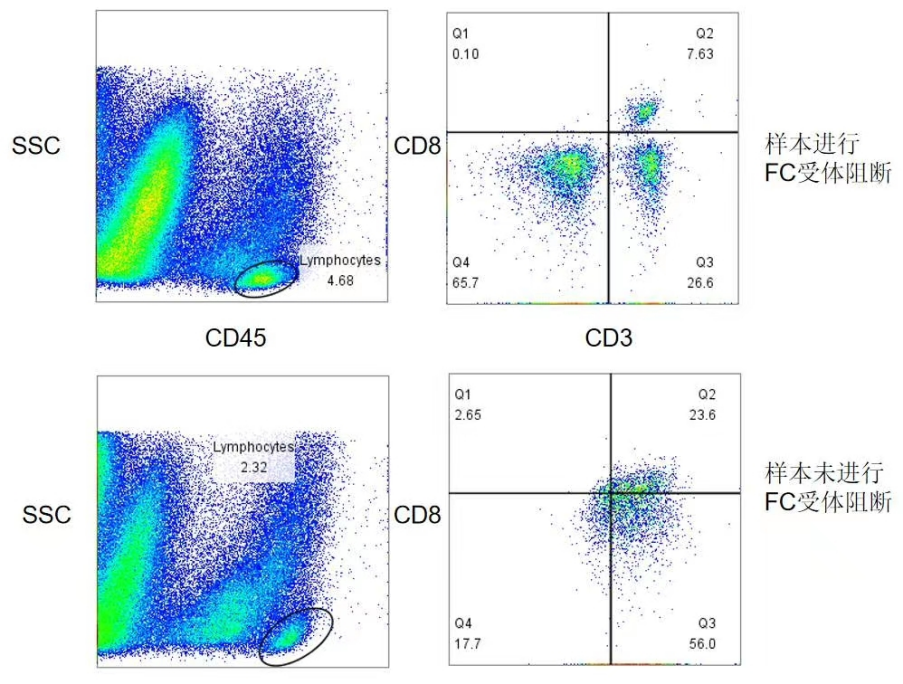
△点击放大图片
组织样本不加FCR阻断影响更是尤其显著
那FCR阻断剂怎么去选择呢?罗工给大家总结了以下常用的FCR阻断剂,可根据咱们的样本种属,直接参考选用:
| 货号 | 用途 | 产品名称 | 规格 | 备注 |
| 564219 | 减少非特异性染色 | Hu Fc Block Pure Fcl.3216 | 50ug | 人的FCR阻断剂 |
| 564220 | 减少非特异性染色 | Hu Fc Block Pure Fcl.3216 | 250ug | 人的FCR阻断剂 |
| 564765 | 减少非特异性染色 | Hu BD Fc Block NALE FC1.3216 | 250ug | 人的FCR阻断剂(NA/LE级别) |
| 553141 | 减少非特异性染色 | Ms CD16/CD32 Pure 2.4G2 | lOOug | 小鼠的FCR阻断剂 |
| 553140 | 减少非特异性染色 | MsCD16/CD32 NALE 2.4G2 | 500ug | 小鼠的FCR阻断剂 |
| 550270 | 减少非特异性染色 | Purified Anti-Rat CD32 | lOOug | 大鼠的FCR阻断剂 |
| 550271 | 减少非特异性染色 | Purified Anti-Rat CD32 | 500ug | 大鼠的FCR阻断剂 |
3、细胞自发荧光对流式配色的影响(点击返回目录)
流式细胞术是通过用荧光信号去区分不同蛋白表达的,那么我们在进行荧光配色时,就需要考虑,在处理样本或做一些外源刺激时,是否会引入一些荧光信号。比如做质粒转染、病毒感染、药物处理等,都是会引入一些荧光信号的。这些荧光信号就会在流式检测中存在一定干扰,本期内容,就给大家讲一下这些常见的荧光蛋白的特征和其他可能引起外源荧光信号的因素。
Part 1:常见的人为引入荧光蛋白特征
荧光:GFP(绿色荧光蛋白), EGFP(增强型绿色荧光蛋白);RFP(红色荧光蛋白),mCherry(樱桃色萤光蛋白),mStrawberry.
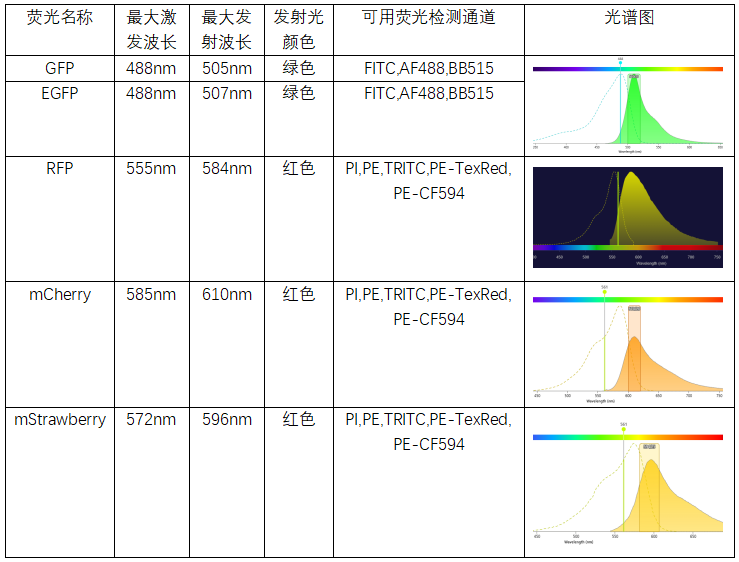
△点击放大图片
在传统流式仪器中,当样本引入如上荧光蛋白后,走相同通道的荧光是不能同时染色的,会区分不开。如果荧光蛋白的表达量过高,超过30%以上时,由于发射光谱的区间很宽,相邻通道的荧光抗体,也要慎重选择,经常会出现靠调节补偿,依然无法进行有效分群的现象。
PS:更多荧光光谱信息可以在流式专家公众号-流式工具-荧光素光谱(点击查看)查看中搜索,或在BD官网的光谱查看器检索 https://www.bdbiosciences.com/zh-cn/resources/bd-spectrum-viewer
Part 2:如何确认细胞的自发荧光
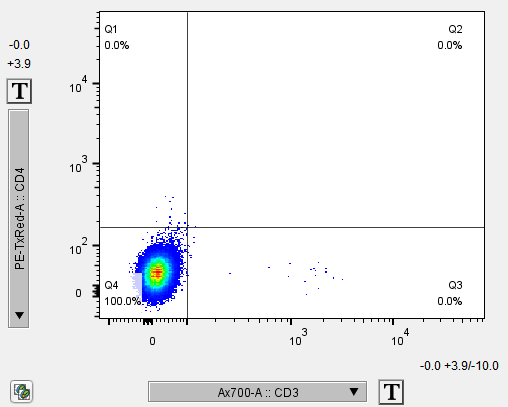
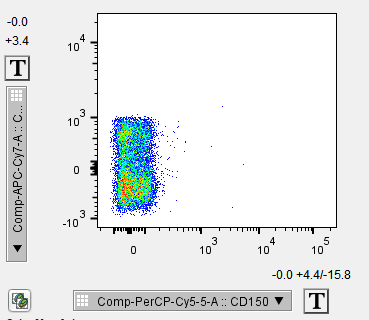
△点击放大图片
当细胞有自发荧光时,未染色细胞在一些通道也会有明显的阳性分群,哪个通道阳性明显,在流式配色时就不能再用同通道的各种荧光去做检测了。有少量自发荧光的通道可以通过补偿调节,排除干扰。
Part 3:自发荧光的可能来源
1. 细胞转染带荧光蛋白的质粒,并被细胞正常表达;
2. 细胞感染带荧光蛋白的病毒,并被细胞稳定表达;
3. 药物处理,药物或试剂所带的背景荧光,尤其是含芳香环苯环结构的药物;
4. 细胞体外共培养实验,导致细胞状态受到影响,出现细胞本底荧光的变化;
5. 染色前样本本底水平或处理过程中产生的死亡的细胞,自身会有荧光信号,在几乎所有荧光通道都能看到阳性信号,双参数散点图能看到对角线上的群体(如图所示,此为空白对照数据)。
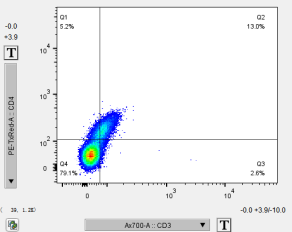
△点击放大图片
可以通过染死活染料进行区分排除。
常用死活染料清单:
| 染料 | 不固定细胞 | 固定细胞 | 检测通道 | 激光器 | 货号 |
| PI | V | X | PE | Blue/YG | 556463 |
| 7-AAD | V | X | PerCP | Blue/YG | 559925 |
| DAPI | V | X | BV421 | UV/Violet | 564907 |
| Via-Probe Green | V | X | FITC | Blue | 565799 |
| DRAQ7™ | V | X | APC | Red | 564904 |
| Via-Probe Red | V | X | APC | Red | 565803 |
| FVS450 | V | BV421 | Violet | 562247 | |
| FVS510 | V | BV510 | Violet | 564406 | |
| FVS575V | V | BV605 | Violet | 565694 | |
| FVS520 | V | FITC | Blue | 564407 | |
| FVS570 | V | PE | Blue/YG | 564995 | |
| FVS620 | V | PE-CF594 | Blue/YG | 564996 | |
| FVS660 | V | APC | Red | 564405 | |
| FVS700 | V | AF700 | Red | 564997 | |
| FVS780 | V | APC-H7 | Red | 565388 |
在做流式方案设计之前,如果有细胞自发荧光干扰的风险,就需要各位Flower做一下预实验,用未染色的细胞上流式,看看各个通道细胞散点图的信号是否正常,是否有分群的情况,以此避免配色后出现干扰的情况,减少来回调整方案的消耗。
4、如何确定一些陌生荧光素,在流式细胞仪上是否可用?(点击返回目录)
荧光素
在多色流式实验设计时,荧光素的选择很重要。但我们发现流式仪器的标记荧光名称或厂家提供的检测说明书上写的荧光素并不那么全面。因为品牌的原材料不同,专利限制和荧光素研发等因素影响,我们经常会遇到很多陌生的荧光素名称,那如何去判断,我们自己的流式仪能不能检测这些荧光呢?
我们先来了解下荧光素特性,两个特征光谱(nm):
①激发光谱(Excitation,Ex):是指能特异性地激发某种荧光素的一定波长范围内的光线,也称为吸收光谱。最大吸收波长,也就是吸收波峰,简称Ex-Max。
②发射光谱(Emission,Em):是指某一波长激发光引起荧光素发射的一定波长范围内的荧光。最大发射波长,即发射波峰,简称Em-Max。
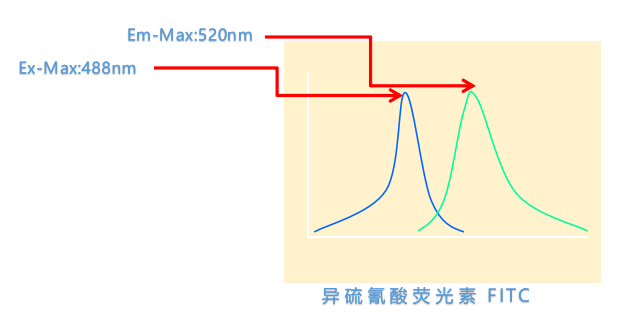
△点击放大图片
再来了解下常规流式仪,检测荧光素的原理:
流式细胞仪的光学系统中,配备了不同的激光器和滤光片,用来激发和收集不同的荧光素信号。
①激光器:用来给荧光素,提供激发能量。常见的激发光有紫色Violet(405nm),蓝色Blue(488nm),绿色Green(561nm),红色Red(633nm),高配仪器还有紫外光UV(345nm),用来激发荧光素。
②滤光片:又可以分为长通、短通和带通,用来收集不同范围的发射波长,也就是能够检测不同的荧光素的发射信号,滤光片的设置主要是针对发生光谱中的发射波峰进行设置的。
因此,我们平常说配色,需要提供流式细胞仪荧光配置,是要有具体的激发器和滤光片的2个信息,才能判断具体能够检测的荧光通道。
下图为例,是405nm激光器下安装的滤光片以及能够检测的荧光素:
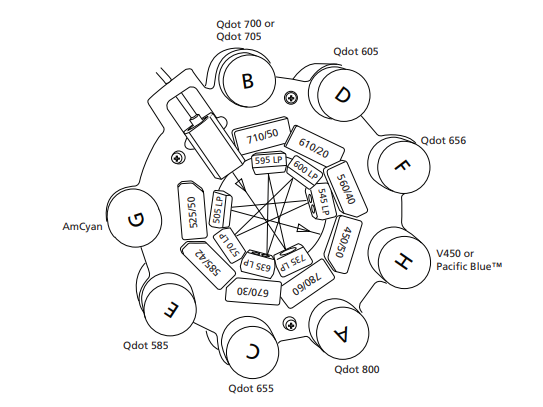
△点击放大图片
但我们发现,405nm激光器下常用的的荧光素,比如BV系列的荧光素,在流式机器上并没有注明,那配色的时候到底还能不能用BV的染料?下面给大家介绍一种确认的方法:
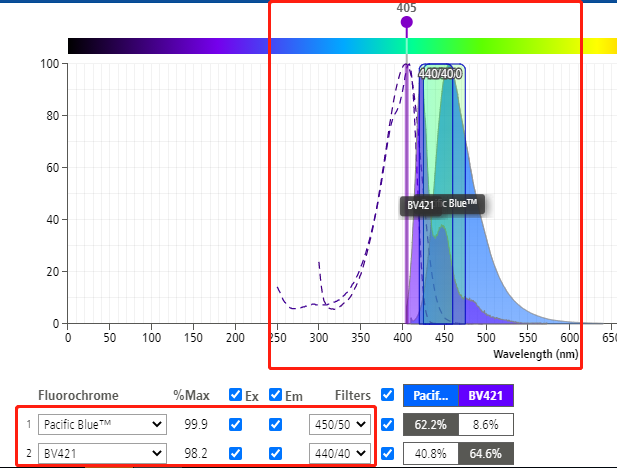
△点击放大图片
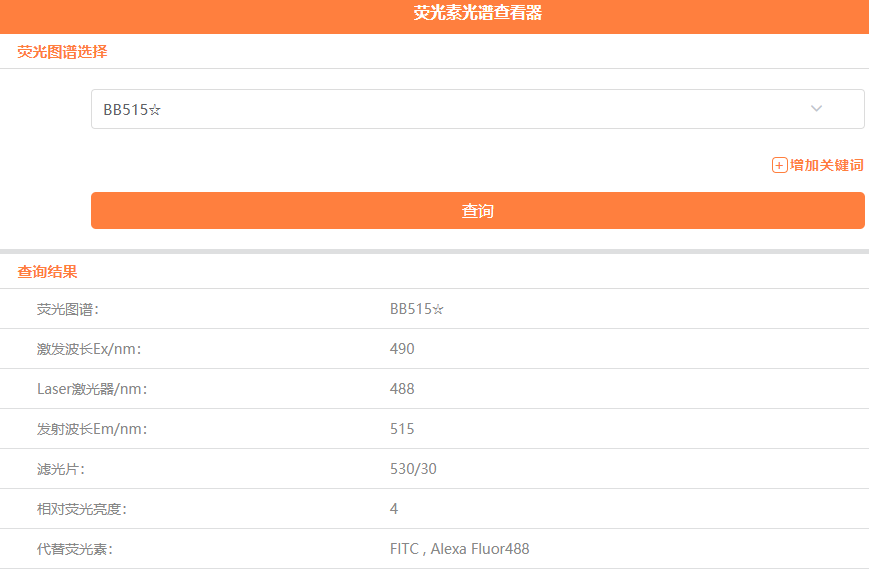
我们可以利用BD官方网站的“荧光光谱查看器”(https://www.bdbiosciences.com/zh-cn/resources/bd-spectrum-viewer),来查看其荧光素的激发波长以及滤光片的信息。
如上图,只要是荧光素激发波长和发射波长相近,能够被激发器激发,并能够在滤光片接收波长范围内,就都可以检测得到。就比如BV421,其实是可以用V450 or Pacific Blue这个通道检测的。
觉得这个比较复杂的话,或者手机端更方便时,还可以通过我们“流式专家”的微信公众号中的荧光光谱查看器进行查询。
△点击放大图片
△点击放大图片
千万不要因为名字不熟悉,而错过很多,又亮,性价比又高的荧光素哦!
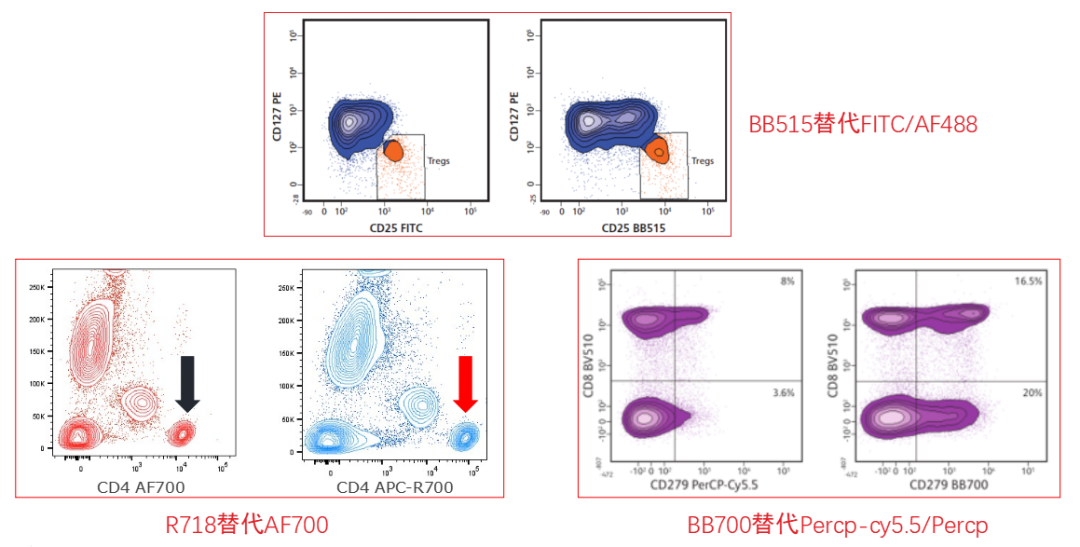
BD Sirigen系列专利荧光素:BB系列、BUV系列、BV系列、APC-R700, R718,更亮、更稳定、更准确。
△点击放大图片
5、有时候用新荧光染料替代传统荧光素结果分群更好凹~(点击返回目录)
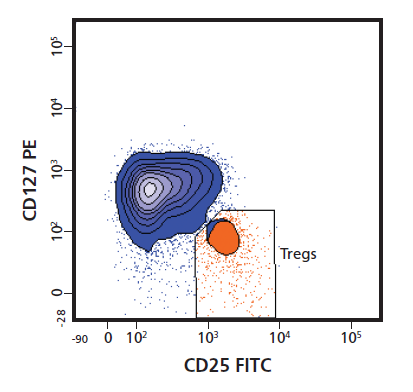
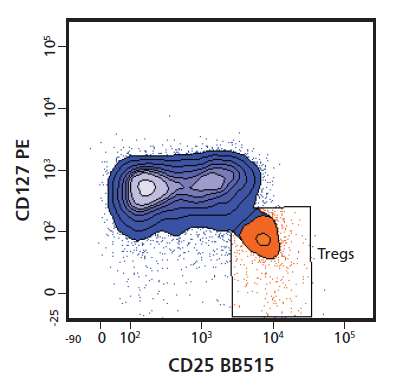
Q:罗工罗工,我最近做的TREG分群不好,您看看能不能帮我调整一下配色呢?
罗工:你这个CD25用的FITC,直接用BB515替换就行了,不需要重新配色的。你看,这是我们的demo数据。结果是不是很nice!
罗工:下图BB515标记的CD25分群更优秀了。
△点击放大图片
△点击放大图片
Q:WOW,这BB515是何方荧光素啊?
罗工:目前市场上研发出了很多新的荧光素,远不止FITC,PE,APC等等我们熟知的一些。像这个BB515就是BD公司专利的Sirigen系列荧光素。是基于一项曾获得了诺贝尔学化学奖,有关导电塑料研究的聚合物技术。这类荧光素较常规荧光素更亮,更稳定,补偿也相对更小。
Q:这类荧光素听着不错诶,还有哪些荧光素比较常用?我以后都试用下。
罗工:有好几个可以替代传统荧光素哦,如下:
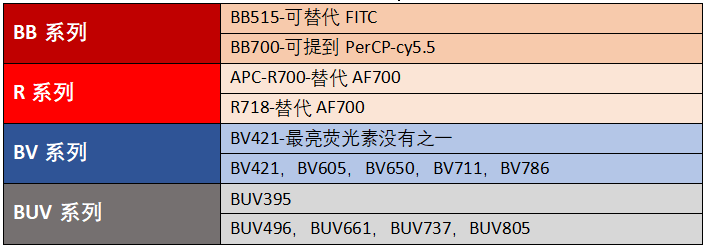
△点击放大图片
罗工:今年还刚出了个新荧光素RY586,可以替代PE,您可以看这个链接了解下
https://zhuanlan.zhihu.com/p/519585610
Q:新产品的价格是不是很贵呀?
罗工:并不是所有的都贵呢,很多替代常见荧光的抗体,甚至可能比常规荧光抗体还便宜,如果需要可以找小优询价哦~还有免费配色服务。给你看几个性价比很高的产品:(点击货号可加入购物车哦)
| 货号 | 品名 | 规格 |
| 564467 | Hu CD25 BB515 2A3 | 100T |
| 562424 | Hu CD4 BV421 Rpa-T4 | 100T |
| 566392 | Hu CD4 BB700 SK3 | 100T |
Q:好的,下次有需要一定搞几只试试^_^
6、抗体上荧光染料的染色指数——SI值如何计算(点击返回目录)
SI(Stain index)——染色指数,这个概念相信各位一直关注我们的Flower已经不陌生了,它是一种测量流式抗体上荧光染料的相对亮度并以生物学相关方式将其与其他荧光染料进行比较的方法。
简而言之,就是用于评价荧光染色后,阳性群和阴性群的分群水平的一个参数。
SI值可用于对您当前使用的仪器上的各种荧光染料亮度进行排名,也是一个用于评估抗体滴定数据的有效工具。
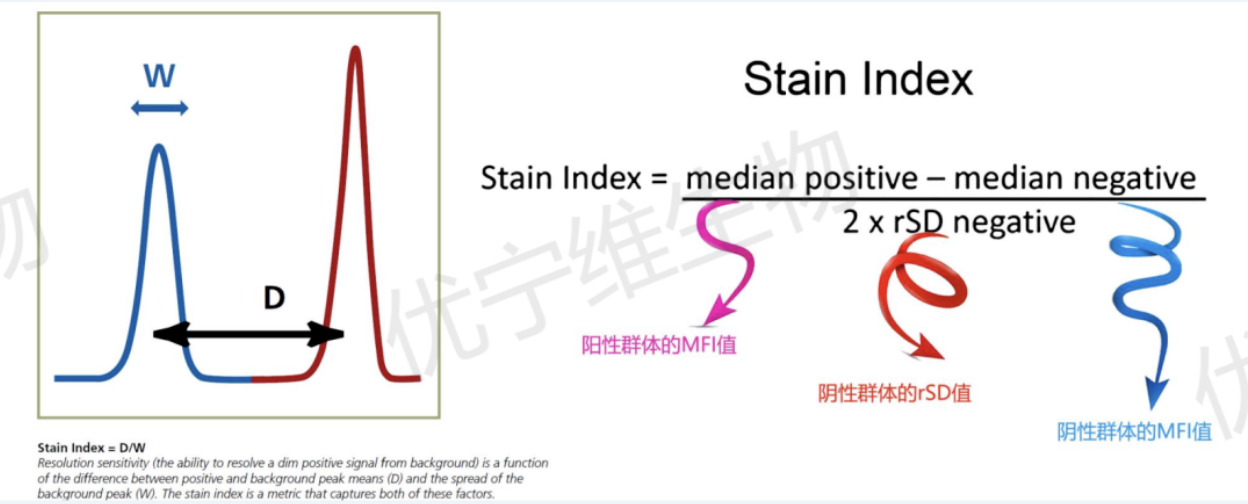
染色指数的示意图和公式
△点击放大图片
SI值计算方法如下:
1、结合上图公式,我们即可在Flowjo里获取,其中每个参数的具体数值,即可直接进行计算。
各参数具体数值的获取,参看上一期《【罗工流式秘籍78】Flowjo里可以得到哪些统计学信息?》(点击查看)
2、利用Flowjo的小插件,来进行快速批量计算。
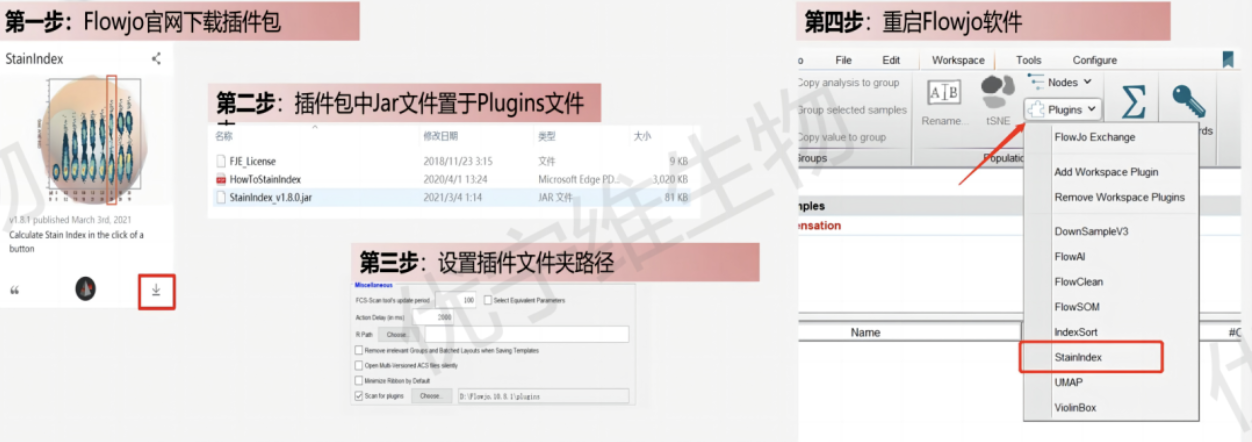
△点击放大图片
①通过前序各种门控(如去除碎片,去除黏连,去除死细胞等),把需要计算的通道单染管处理成阴阳分峰明显的图像
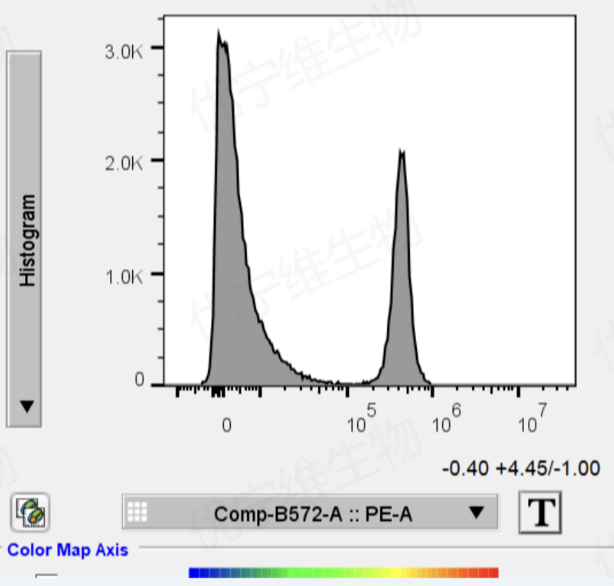
△点击放大图片
②选中当前圈门,选择SI插件,选择其中染料对应通道做计算,调整自动识别圈门位置
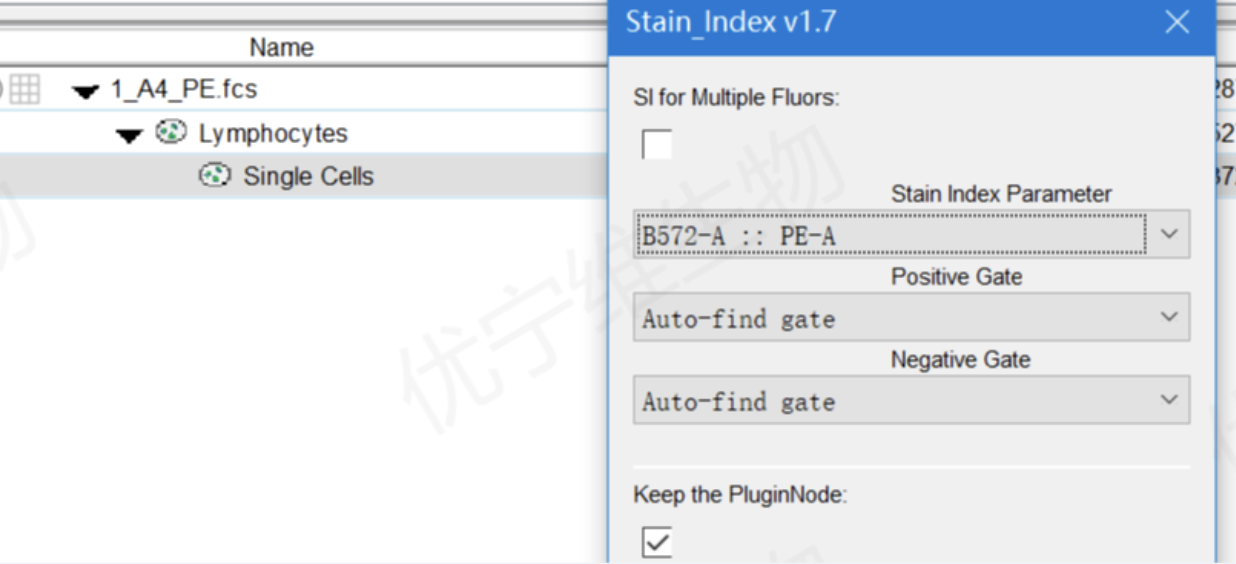
△点击放大图片
③计算结束后在Table功能中选中“Formula”后“Create Table”
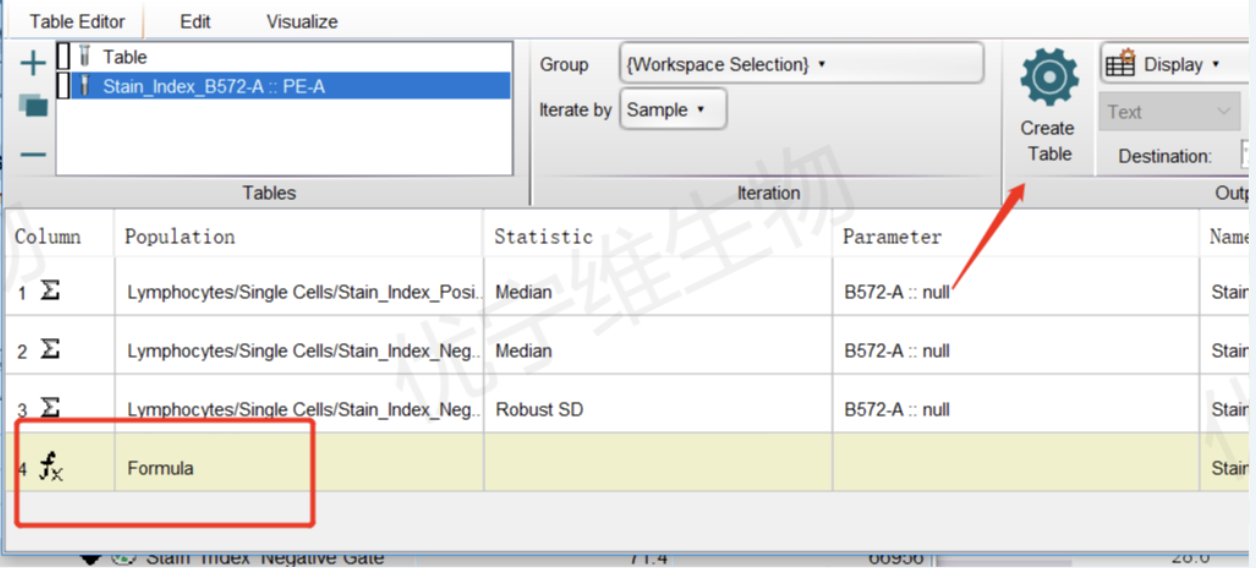
△点击放大图片
我们就能得到对应数据的SI值了:
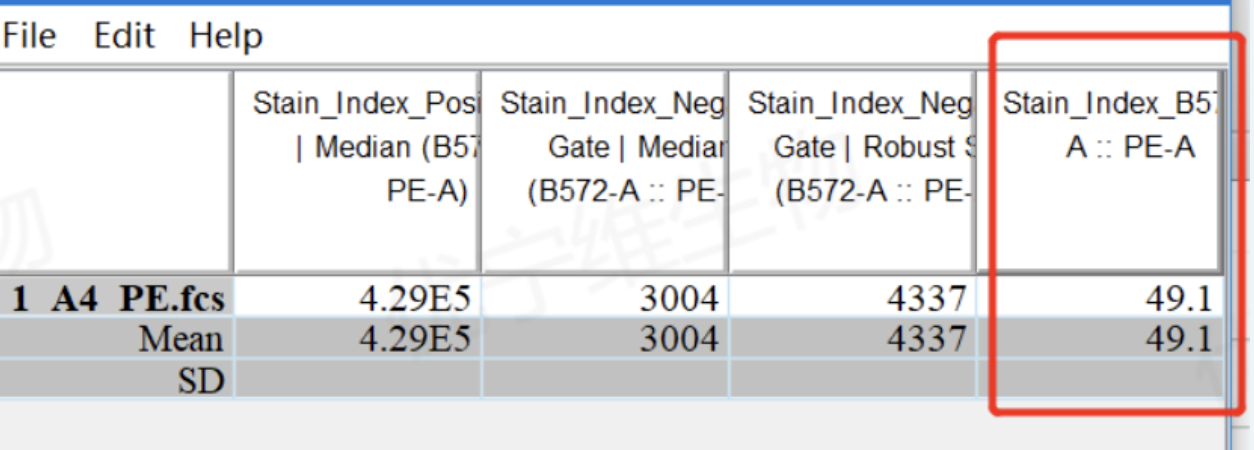
△点击放大图片