- 1、为什么说科研流式结果分析不推荐单参数直方图圈门
- 2、补偿难于上青天——如何使用flowjo调节补偿
- 3、补偿难于上青天?!——如何使用flowjo调节补偿
- 4、为什么你的流式图不够好看?
- 5、KeyWords二三事
1、为什么说科研流式结果分析不推荐单参数直方图圈门(点击返回目录)
各位英雄在做流式的过程中难免会遇到一些小小小小小困难,在这里罗工为大家准备了升级打怪的一系列流式秘籍,以免“走火入魔”,希望可以助各位英雄早日获取武林秘宝,发得高分文章,走上人生巅峰!
直方图往往用于细胞系(比如msc)或状态好的细胞亚群中作为统计/展示方式。
但是科研流式不推荐这样分析,一个是非特异染色,一个是表达很低的marker(如cd25)也不好通过直方图去看到阳性群。这时候选择ssc+荧光通道的散点图结果会更直观准确。
#理想的样本
没有非特异性染色(进行过FCR block,并且样本本身是健康人外周血)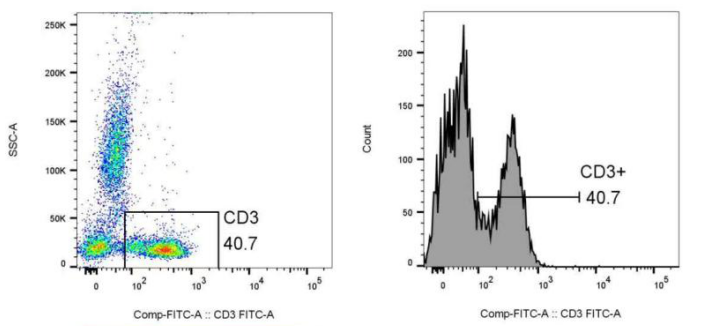
#实际情况下的大多数样本
△点击放大图片
没进行过FCR block,或者是病人的外周血,或者是健康/病人的组织提取的淋巴细胞,多有单核/粒细胞的非特异性着色。
故实际应多以SSC+荧光来界定一些单参数阳性值。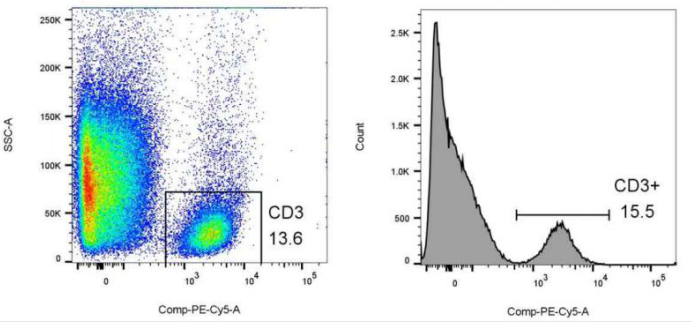
图中所用软件:Flowjo
△点击放大图片
【罗工秘籍5】如何做出高分文章中的峰形叠加图
我们经常会在文章中发现一些蛋白表达类的流式结果figure出现如下的阳性结果+阴性对照在一个图上的流式结果:
△点击放大图片
甚至还有这样的伴随不同处理组叠加在一张图上更多信息量的结果:
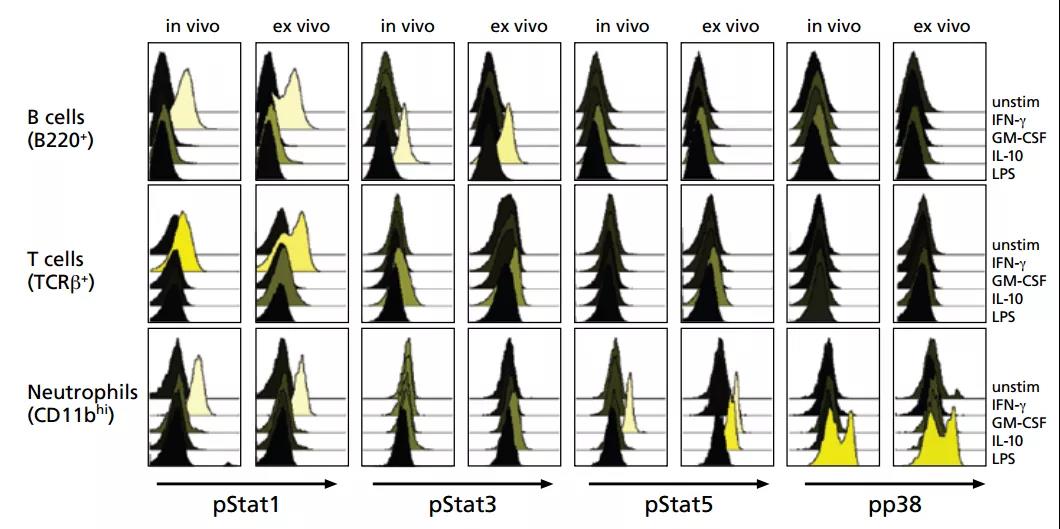
△点击放大图片
这是如何做出来的呢?一般来说我们都是使用的flowjo这款软件来完成这种“叠加图”的,今天我们就来教大家如何使用flowjo这款软件完成峰形叠加图这个小技巧:
首先我们需要一个flowjo软件,这个软件目前是支持免费下载安装,并且可以免费申请使用30天的,如下是下载和安装地址:
Flowjo官网:https://www.flowjo.com
软件下载:https://www.flowjo.com/solutions/flowjo/downloads
免费使用30天:https://www.flowjo.com/solutions/flowjo/free-trial
当我们下载好软件后打开他,双击你想要分析的样本,找到你要分析的蛋白的荧光通道, 选择横轴为待分析指标的通道,纵轴选择histogram,即为当前的直方图,将图拖动到layout-editor中。
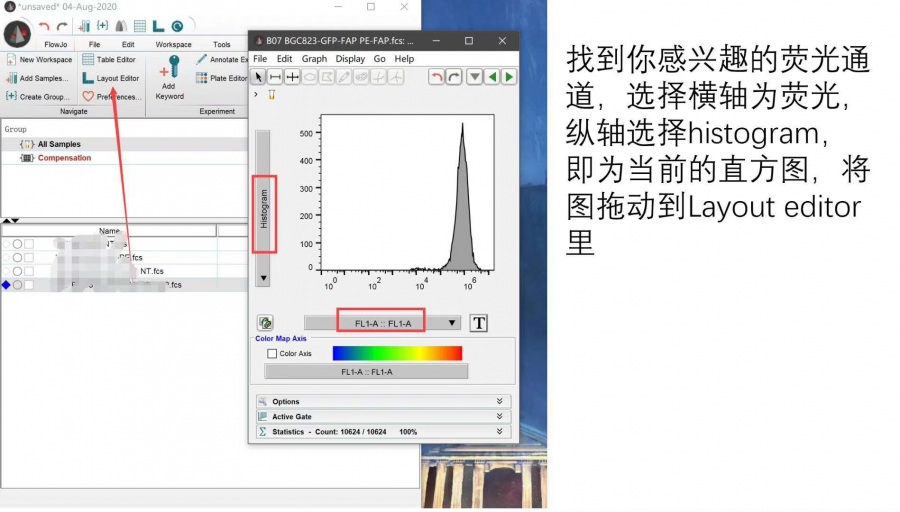
△点击放大图片
将另一个想要对比的样本也拖到当前的layout editor的这张图上面,马上就会出现叠加图了:
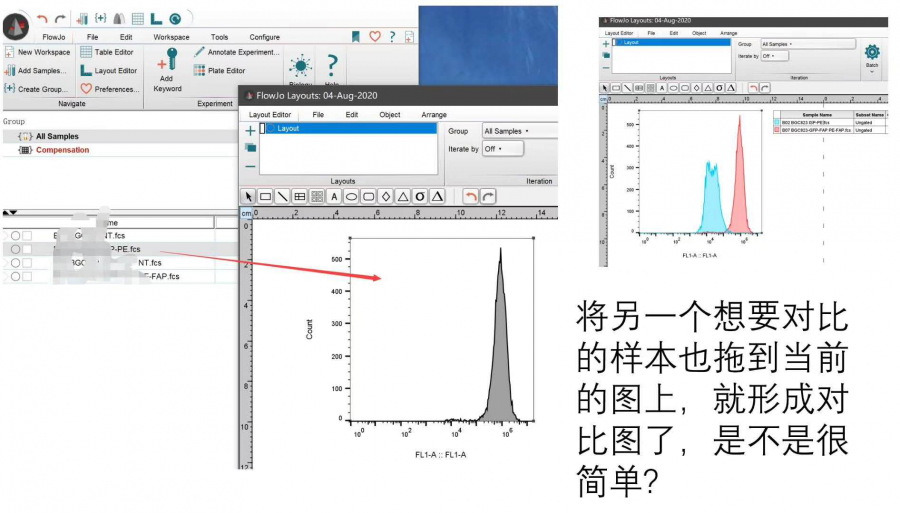
△点击放大图片
我们还可以右键layout中的叠加图,更改不同的图形类别哦!
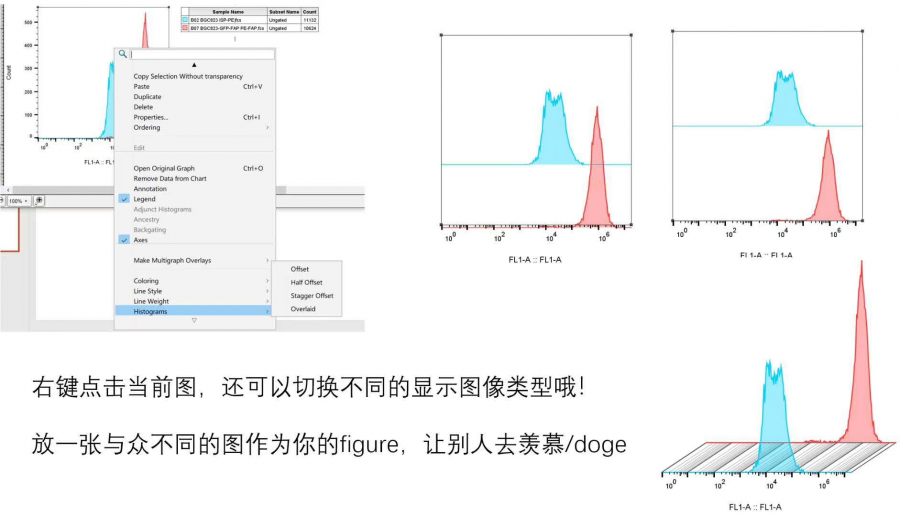
△点击放大图片
怎么样,今天的小技巧,你学会了吗?
2、补偿难于上青天——如何使用flowjo调节补偿(点击返回目录)
△点击放大图片
应胡同学的要求,特别出一期补偿调节专辑分为上下两集,分别教学1.如何使用flowjo完成补偿调节;2,如何从自己的实验结果判断补偿是否合适,本期讲解前者。
首先我们要了解什么是流式里的“补偿”。我们知道我们流式中用的荧光抗体,他的特点就是偶联了荧光素的一抗,而荧光素发出的光,科学的说法是波长,是存在一定范围的,例如FITC这个荧光,他的最大发射波长在520nm左右,但是实际上在575nm处也会有激发,也就是说这个荧光的范围很“宽”,这就造成原本一个FITC的荧光,在不做任何干预的情况下PE通道也会有些许信号:
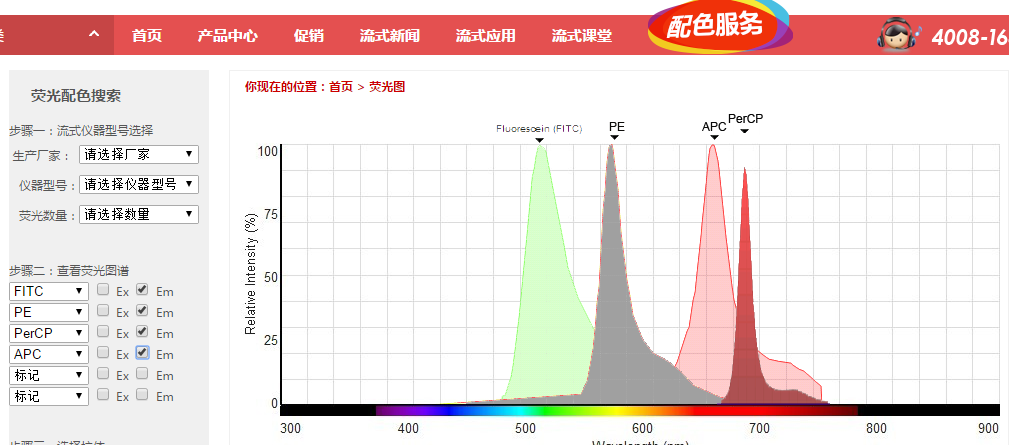
△点击放大图片
FITC,PE,APC,Percp四种荧光素的em范围,可以看到很多都存在相互干扰覆盖。
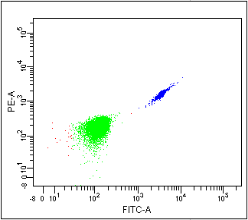
△点击放大图片
单独染色FITC,在不加干预的情况下PE也会有阳性哦!
那么,如何减少这种荧光泄露造成的影响呢?在流式细胞仪上,有一个选项叫做“Compensation”直译过来就是“补偿”,补偿就是人为校正减除掉原本不应该出现的阳性信号,将结果恢复到正常情况下展示,例如上面的FITC,我们通过单染FITC的样本管作为补偿对照管,在仪器上补偿校正后就可以得到无PE信号的结果图啦:
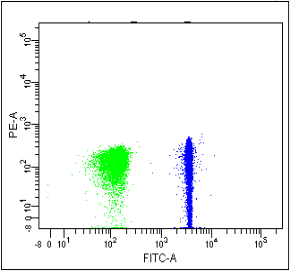
△点击放大图片
问题来了,有的时候我忘了调补偿,或者我觉得仪器上的补偿调节不太准,我想要在自己的电脑上再调节或者抢救一下,怎么办?下面进入正式教学,还是继续使用flowjo这款软件完成今天的技巧。Flowjo支持2种调节补偿的方式,分别是代入单染管数据拟合补偿矩阵和直接在补偿矩阵中调节2种。
第一种,代入单染管数据拟合补偿矩阵适合保存有单染管的上机文件,并且单染阴性和阳性分群很明显的老师,操作方法如下:
将单染的数据(一定要包含空白管,并且最好单染以单染管的荧光通道来命名)拖入compensation中:
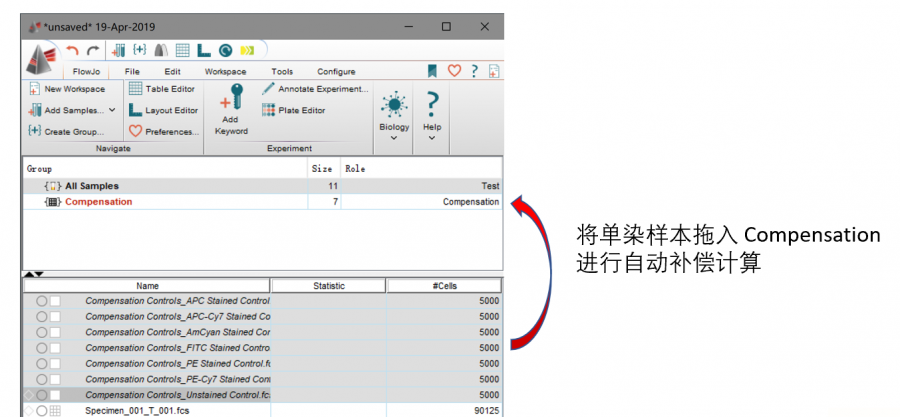
△点击放大图片
代入后点击主界面像彩虹桥一样的选项,即可进入补偿计算界面,在拟合好阳性群后点击apply to group即可应用:
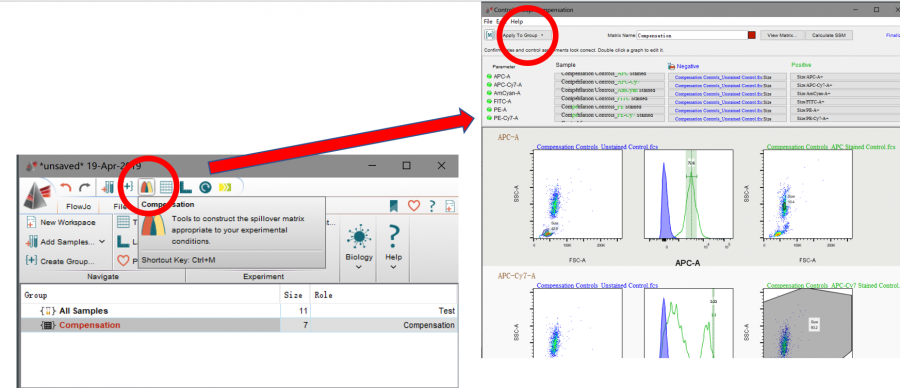
△点击放大图片
第二种,直接建立补偿矩阵,在补偿矩阵里微调补偿,适合对补偿比较熟悉,对数据分析要求比较高的老师:
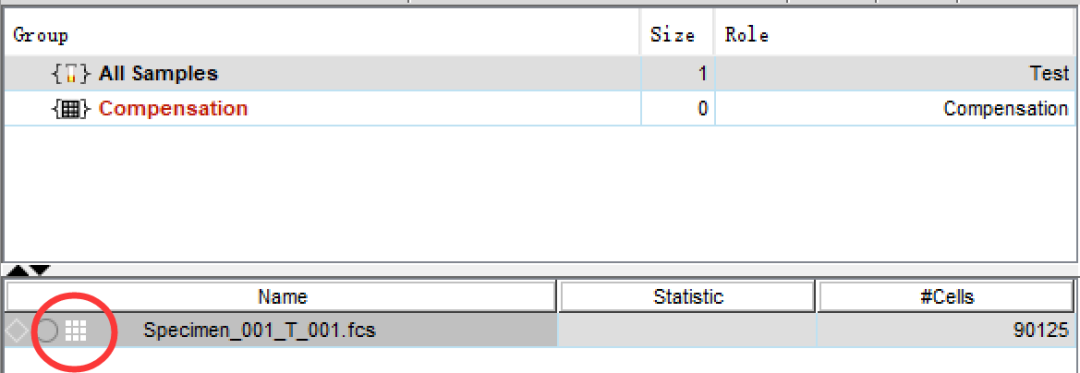
△点击放大图片
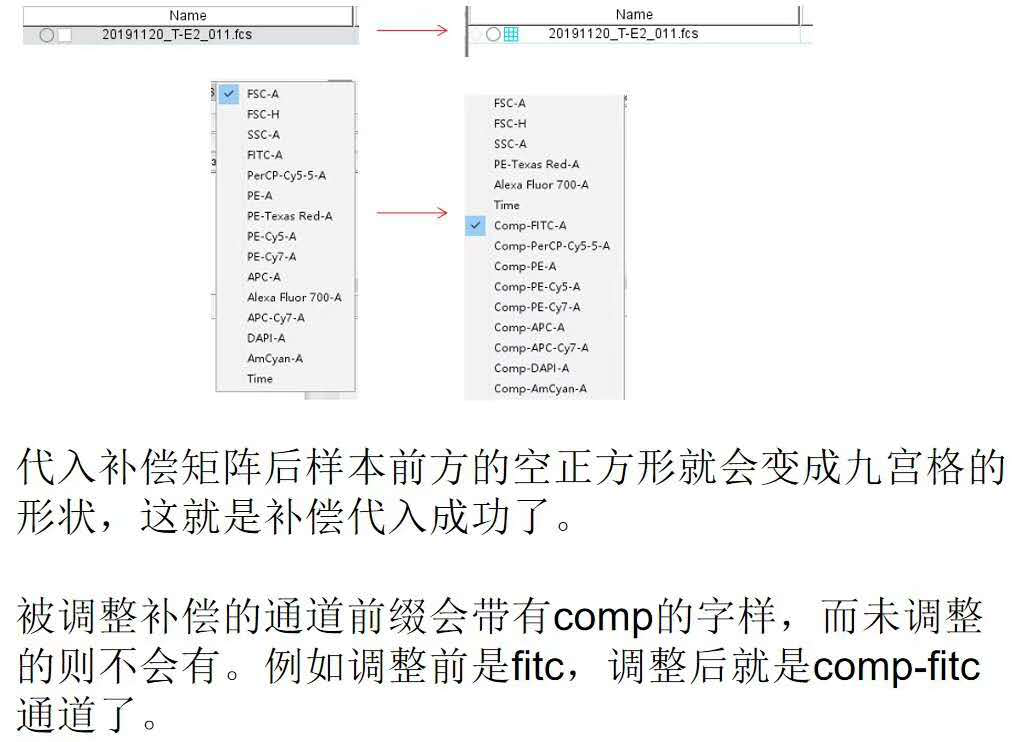
我们找到样本前面的正方形(上机时有补偿记录的有九宫格,没有调过补偿的就是空心正方形),双击打开补偿矩阵。
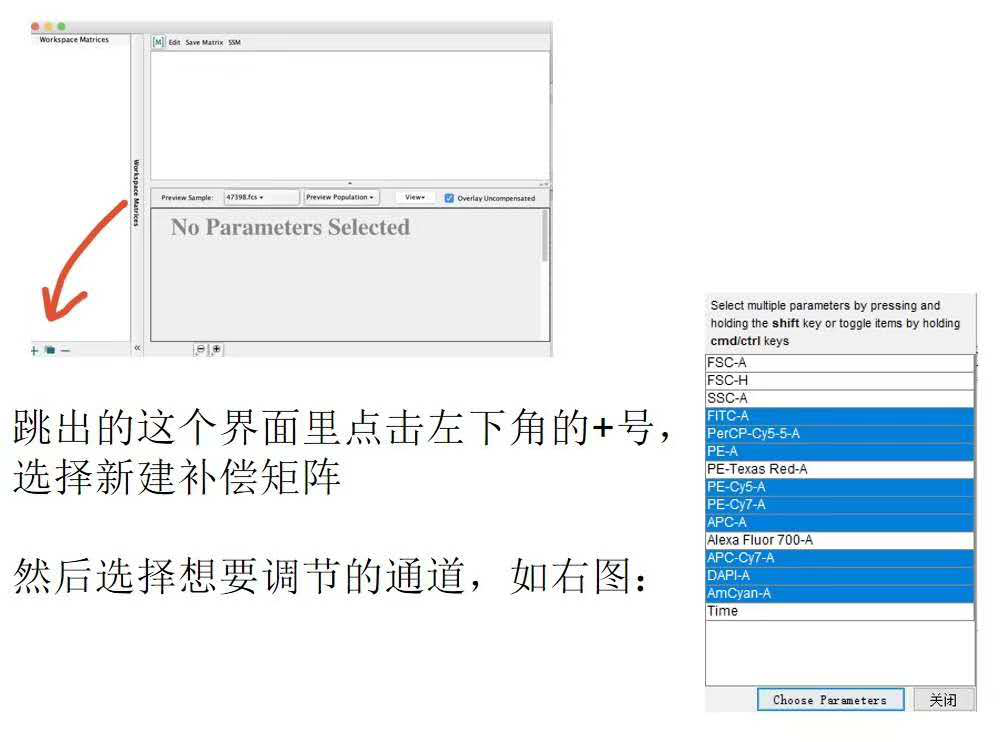
△点击放大图片
在补偿矩阵中进行相应的补偿调节:
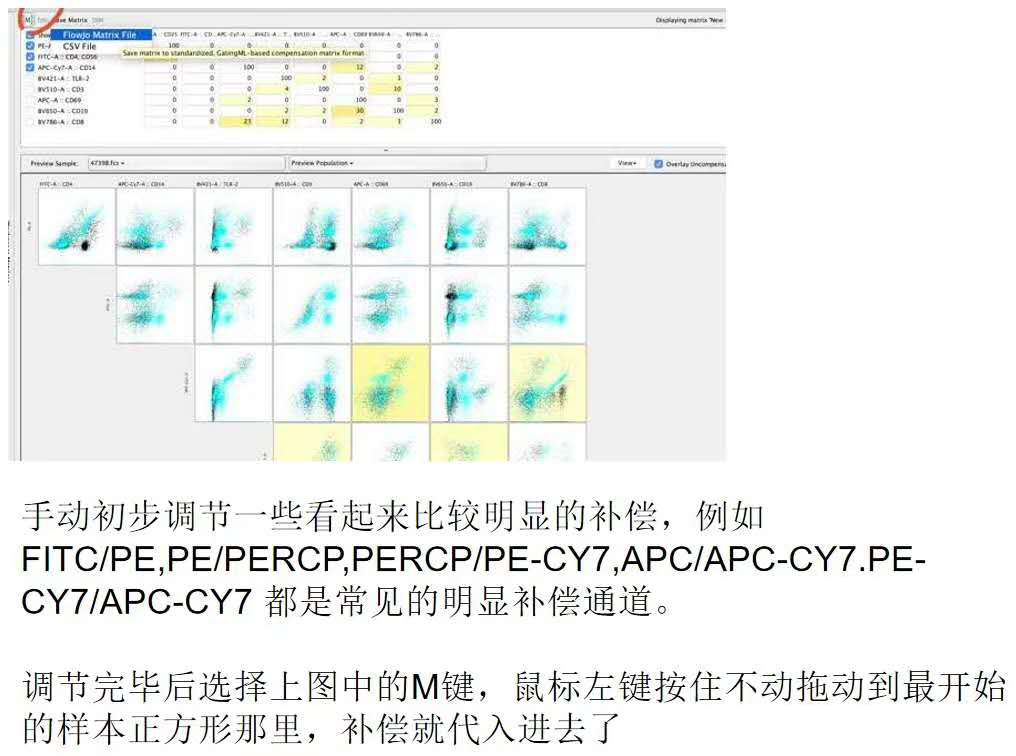
△点击放大图片
△点击放大图片
这是我们第一种调补偿的方法,大家有GET到嘛?等到熟练后罗工将教大家第二种方法,敬请期待吧!有任何不懂的,也欢迎给我留言哦!
3、补偿难于上青天?!——如何使用flowjo调节补偿(点击返回目录)
上一期我们讲了流式荧光补偿这个概念,以及我们怎么使用flowjo完成流式的荧光补偿调节,这一期我们深入给大家分享纯经验内容,即:我们如何判断自己的实验结果中荧光补偿的调整是否合适。
要做到补偿调节合适,我们需要做到2点即可,第一就是该调的补偿调好了,第二就是没有补偿被调过了。
我们如何发现该调的补偿没调好呢?
关键词就是“形状”,不知道大家注意了这个问题没有,一张流式双参数散点图,在实验结果良好的情况下,形状一定是横纵走向的,即如下:
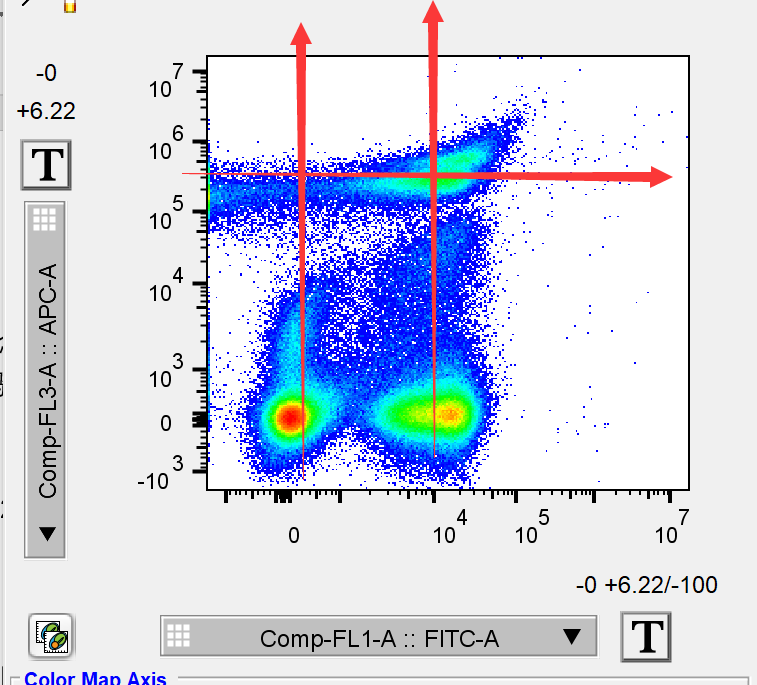
△点击放大图片
所有的双参数散点图都是呈现横/纵的走向,总的来说大部分细胞群都是圆形/椭圆形。
所以当我们发现细胞群形状明显为对角线走向时,往往提示可能出现2种问题:1.死细胞过多,2.补偿调节不到位。而后者往往在一个通道的高阳性区和另一个通道低阳性区出现对角线方向的细胞群:
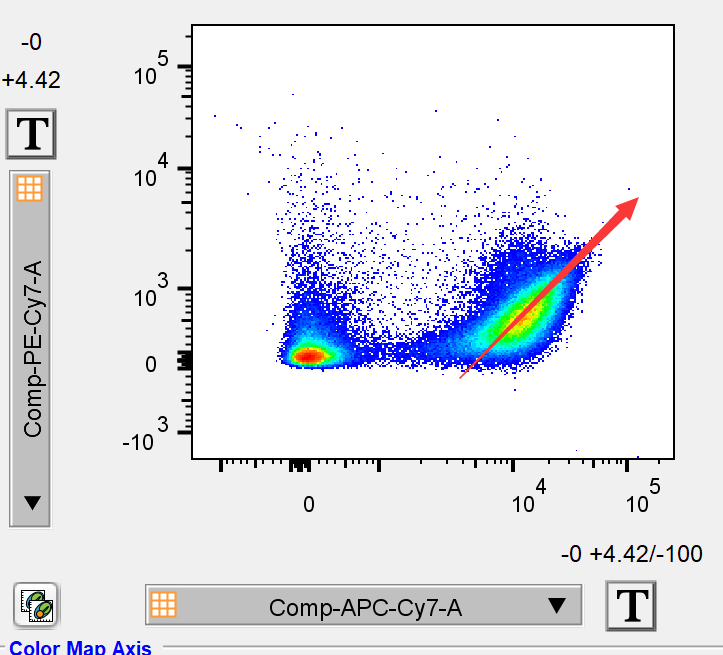
△点击放大图片
例如此数据中APC-CY7/PE-CY7的双参数散点图下出现了APC-CY7 high/pecy7low的细胞群呈现了一个对角线的偏移,即提示存在补偿调节不足的情况出现。
此时我们进行反向补偿调节,即在flowjo上打开补偿矩阵,点击edit进入手动调节模式,增加pe-cy7-apc-cy7的值,即可让实验结果修复正常:
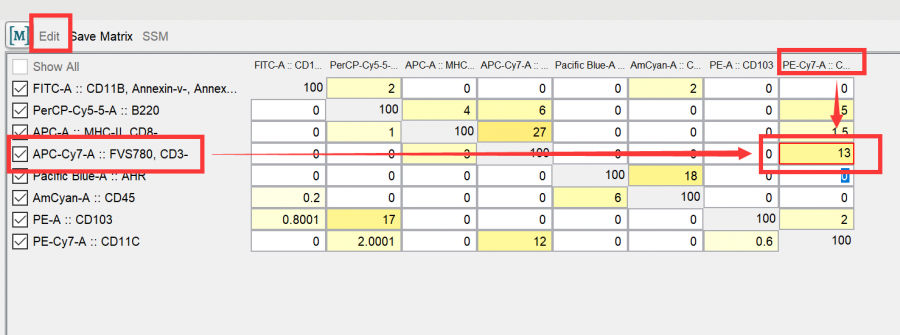
△点击放大图片
注意,A-B即在补偿矩阵的纵列选择A通道,横列选择B通道,大家不要弄反了哦!
△点击放大图片
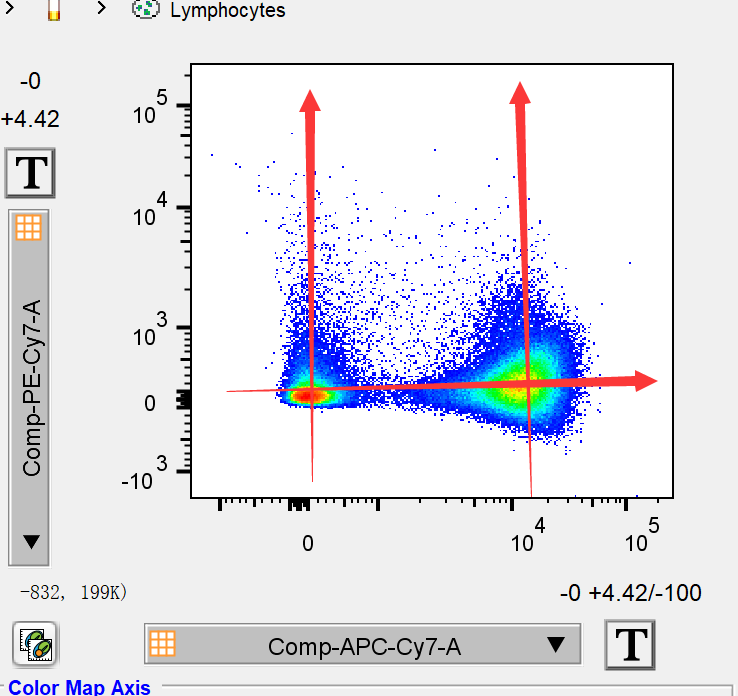
复后的实验结果,所有分群呈现横纵分布
针对补偿不足总结来说,我们在reviews数据时一定要去观察结果的所有双参数散点图,一旦出现流式分群的形状异常时,就应该进一步判断是否补偿不足或是死细胞干扰了。
那么,如果补偿调节过度了,我们如何发现并调节呢?
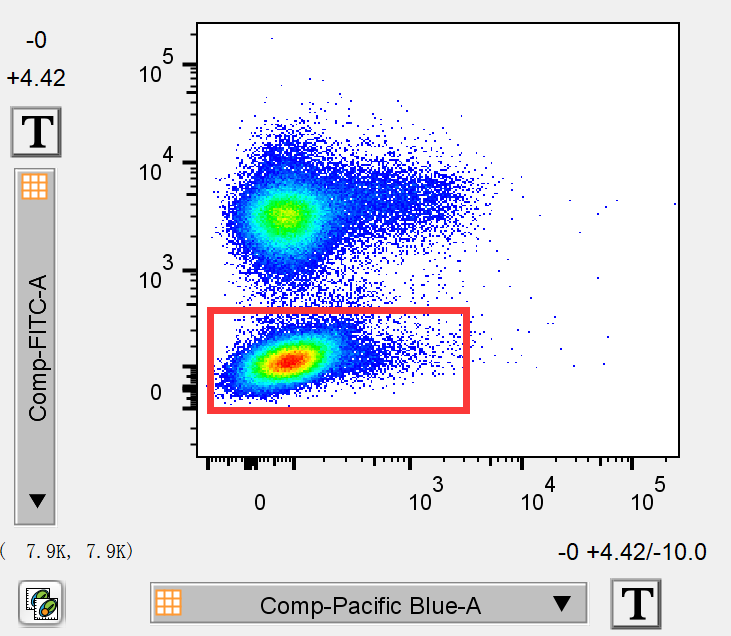
发现补偿调节过度,关键词就是“双阴性群”。如果我们在review流式结果时发现有的双参数散点图出现了比较诡异的2团阴性细胞群,就需要警惕是否是某个通道的补偿调节过度了。
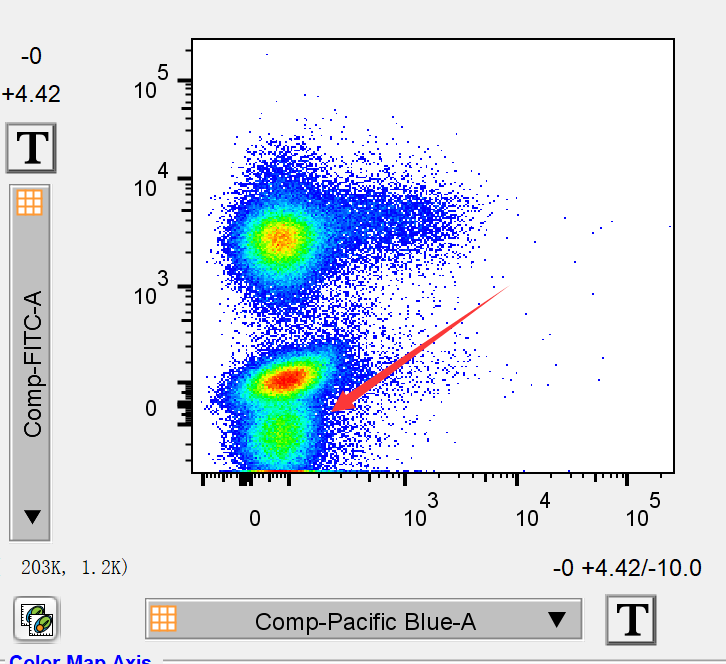
△点击放大图片
比如我们在review结果时,发现BV421/fitc双参数散点图中,有2个阴性细胞群,主要是在FITC上出现了双阴性,这是就要高度怀疑fitc和某个通道的补偿调过了。此时我们就要检测该双阴通道和其他通道的所有散点图了经过检查我们发现问题出在FITC/APC-CY7这张图上:
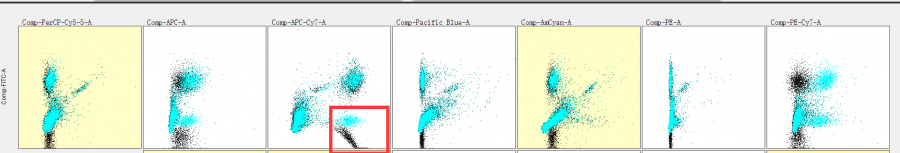
△点击放大图片
比如我们在review结果时,发现BV421/fitc双参数散点图中,有2个阴性细胞群,主要是在FITC上出现了双阴性,这是就要高度怀疑fitc和某个通道的补偿调过了。
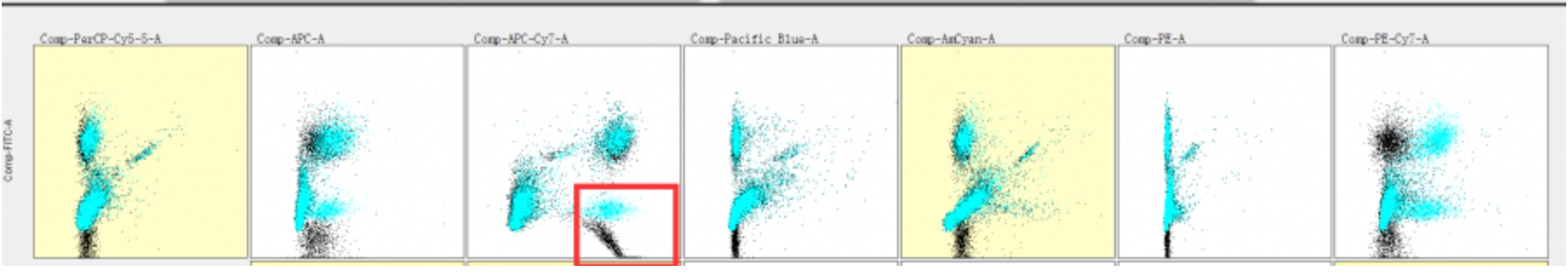
△点击放大图片
此时我们就要检测该双阴通道和其他通道的所有散点图了经过检查我们发现问题出在FITC/APC-CY7这张图上:
△点击放大图片
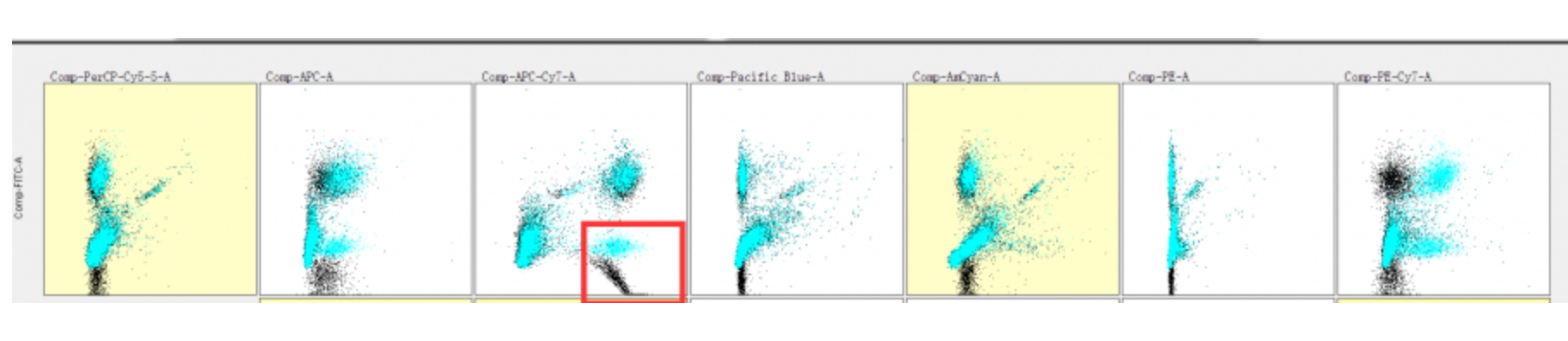
进一步调出这张图发现补偿出现了非横纵走向而是反向对角线走向,这就是明显的补偿过度了:
△点击放大图片
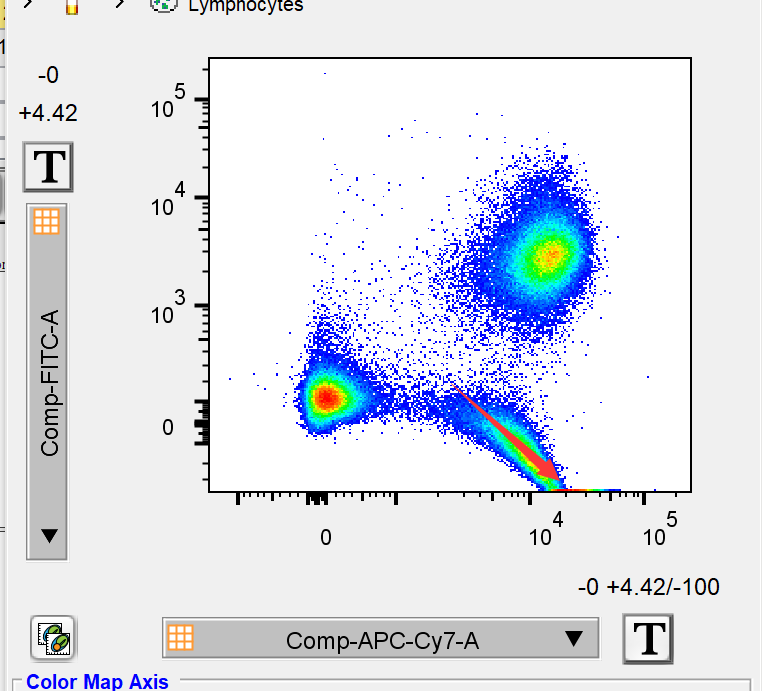
此时我们也选择在flowjo里打开补偿矩阵,减少FITC-APC/CY7的补偿值,让实验结果恢复正常:
△点击放大图片
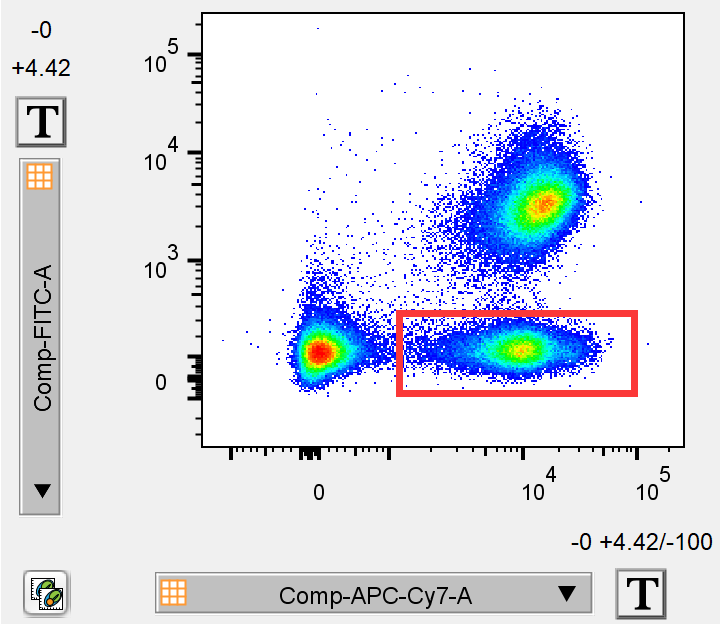
△点击放大图片
双阴性细胞群也就随之消失了。
针对补偿过度总结来说,我们在reviews数据时一定要去观察结果“双阴性”群,出现双阴性群往往不是真的有2个阴性群,而是我们的某些通道出现了补偿过度。
解决了补偿不足和补偿过度,我们的实验结果就会更加准确了,如果大家有什么补偿的小技巧,也欢迎留言分享哦~
4、为什么你的流式图不够好看?(点击返回目录)
经常有老师会问我,罗工,这个流式的图怎么和上机的时候看的不一样?罗工,为啥文章里的流式图做的那么好,我的怎么做的那么丑啊,是哪里做的不好吗?
其实,很多时候我们的结果已经做的足够好了,只是需要在分析软件上进行一定的调整,才能让我们的流式结果更好的呈现出来,今天就来教教大家如何使用flowjo这个软件来让我们的流式实验结果展示的更加美观,亦或是更加还原上机时的实验结果。
首先我们还是需要使用到flowjo这款软件,如果没有的同学可以在既往教学里找到下载地址,这里就不重复放了。
那么我们在数据分析时常会碰到哪些结果展示不好的情况呢?
1. 细胞压边, 细胞一部分被压在了0值附近,导致图片的结果显示不完全,这种情况是最常见的,往往是因为电压调节的过低导致,例如下图:

△点击放大图片
此时细胞的横纵轴都存在不少压边细胞,压边的细胞在有的仪器上还会出现影响细胞分辨率的情况出现,例如上图使用Verse这台仪器就出现了0值附件的“断点”式散点图,非常影响实验结果的美观。
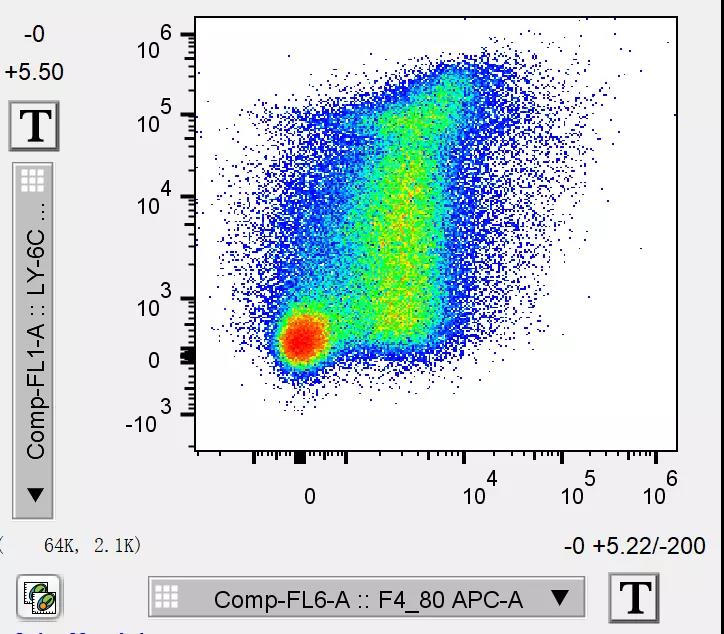
而有时细胞的阳性太高,超出了当前的显示上限,也会对我们造成困扰:
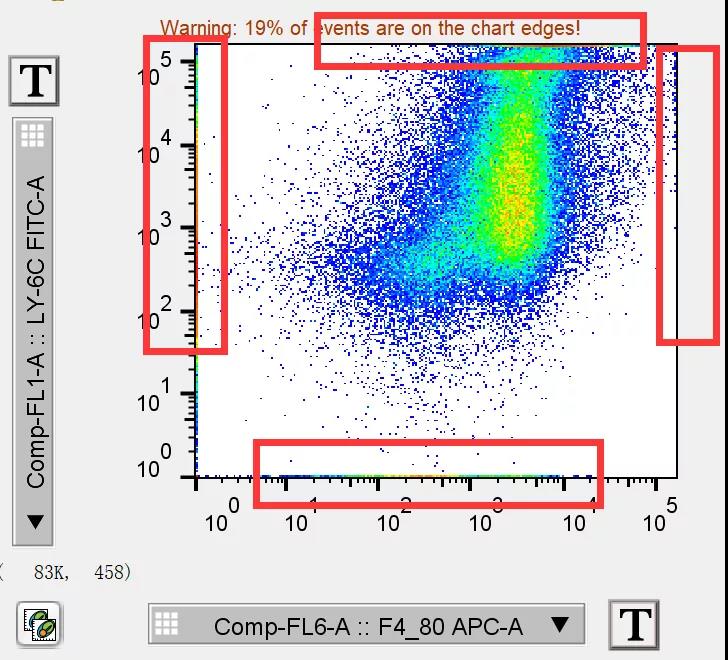
△点击放大图片
像如上这个结果,不仅存在0值压边,因为Ly-6C和F4/80的表达很高,导致还有一部分超出了检测的上限。
其实,如上图2种情况很多时候我们是可以调节好的,怎么调节呢?
我们选择打开flowjo荧光通道旁边大写的“T”字母,选择最下方的自定义参数轴:
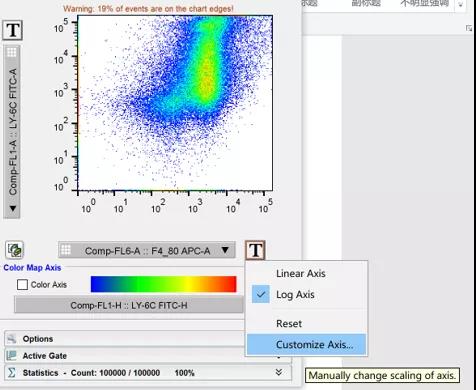
△点击放大图片
在flowjo的自定义参数轴界面中,先选择将坐标轴类型更改为biex,然后放大坐标轴的上限,即可把当前坐标轴的细胞适当的拓宽到合适的位置。
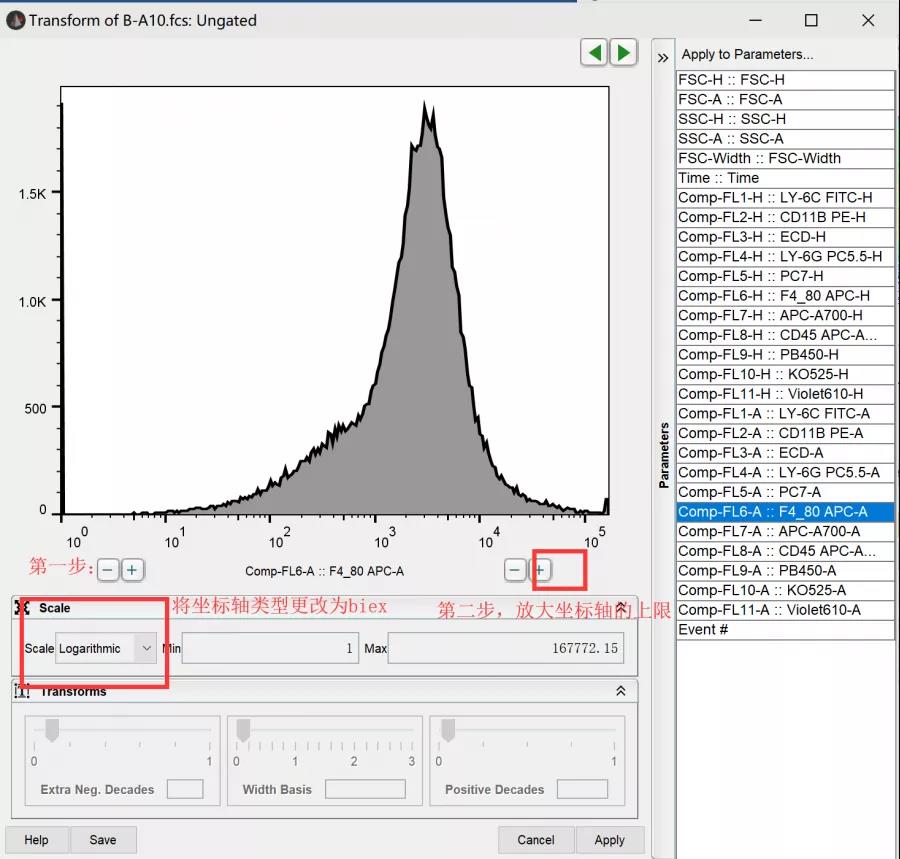
△点击放大图片
拓宽后的结果,就不会再存在着上述的“压边”困扰了,整个实验结果也显示的更加美观:
△点击放大图片
当然需要注意的是,并不是每台流式细胞仪的结果都能够在如上调整后得到理想的实验结果:如一些比较古老的经典4色流式仪,压边后都无法完美开启负轴(仪器太老,压根没负轴这个功能0.0)
还有一些小厂的仪器,例如Guava,或者是cytek这些品牌/型号的流式仪检测上限是非常窄的,高表达的细胞很容易就压上限了,也无法通过增加上限显示的方式调整到位。
2. 实验结果存在比较强的补偿“振幅效应”,让实验结果非常不美观,或是实验结果负轴显示过度,即阴性细胞群被缩放到很小一小群,让实验结果分群不清晰;
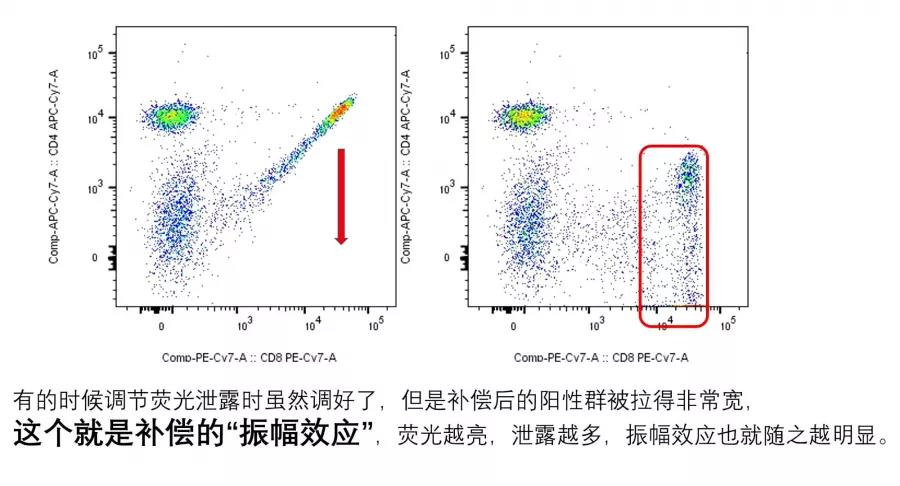
△点击放大图片
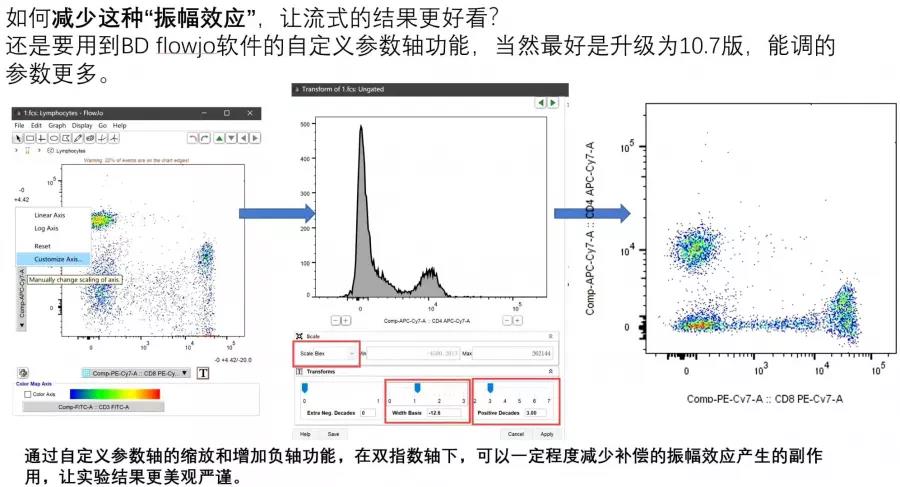
△点击放大图片
同样的,如果反过来阴性细胞群压缩的太厉害了,也可以通过缩放的方式调节到比较美观的实验结果:
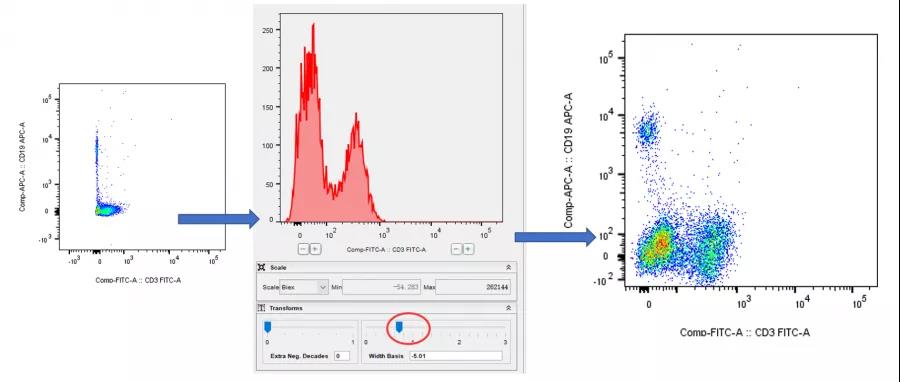
△点击放大图片
3. 获取细胞数不足,让流式检测的结果显示不够美观或分群不清晰。
这个情况也是很多时候我们会碰到的,例如,检测的细胞数太少,如果直接列散点图的话就会显得非常单薄:
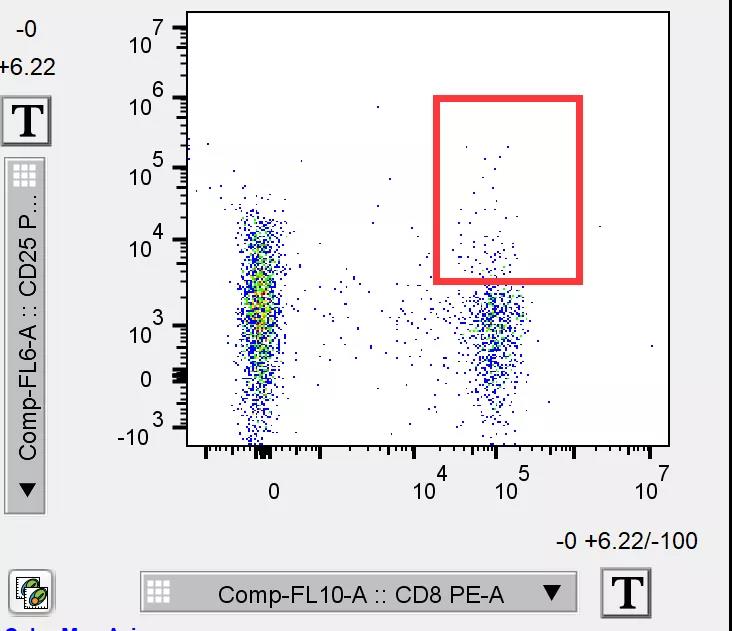
△点击放大图片
例如这张CD8/CD25的双参数图,有经验的老手当然一眼就能gate出双阳门,但是门内的细胞太少,放到文章里难免不被说实验结果不够好。
这时,我们可以考虑更改图像类别,来得到更好的实验结果展示:
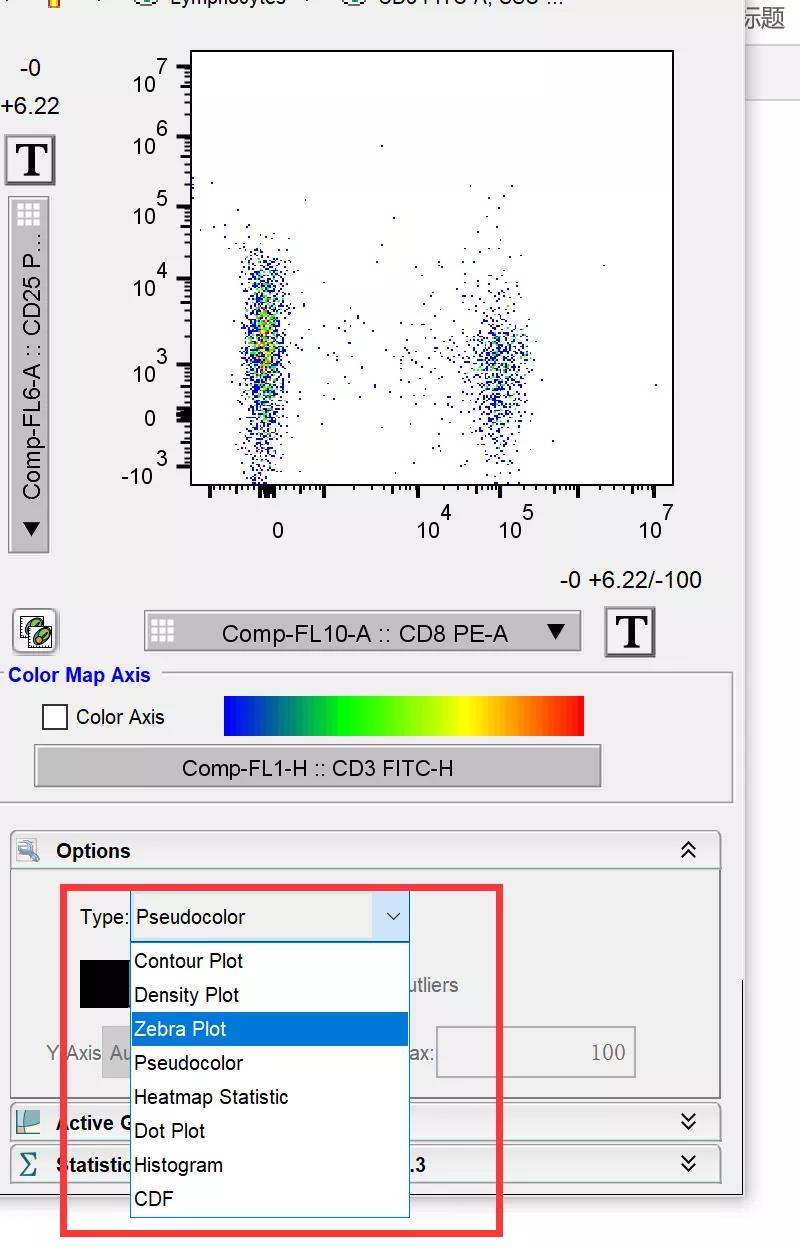
△点击放大图片
在当前流式图下方的选项中选择zebra plot显示,勾选smooth和show outlies选项,图片的阳性结果瞬间就更加清晰的展现在大家面前了:
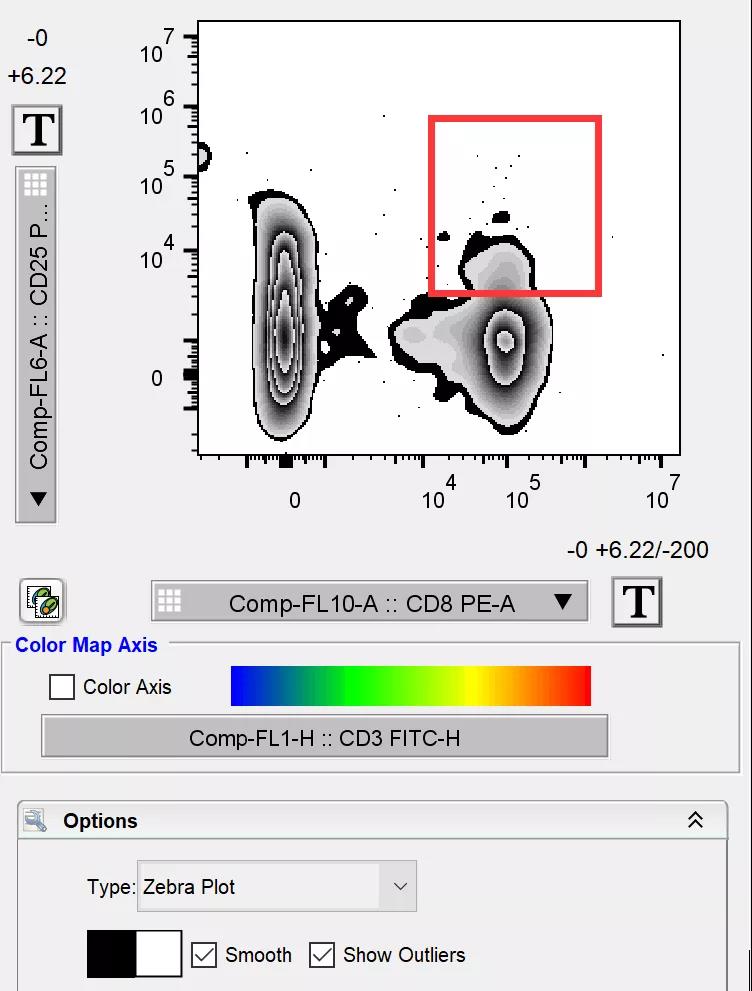
△点击放大图片
Flowjo还有很多其他的图像展示类别,每种都有着不同的妙用。本期的罗工秘笈到这里也告一段落了,大家有GET到吗?也欢迎各位老师在留言区进行分享哦~
【罗工秘籍15】在用FlowJo数据分析时怎么设门?
关于流式数据分析,大家一直都想听,群众呼声也很高,但是一直苦于没有时间去做,最近正好有时间来做一些梳理,本期专门给大家讲讲我的流式数据分析和圈门的思路经验。
那么当我们在做完流式实验,拷贝到流式上机时的数据后,我们要怎么开始我们的流式数据分析工作呢?
首先,准备软件,本期所有的数据分析讲解都是基于BD flowjo这款数据分析软件,没有的老师可以参考往期内容去下载;
其次,将待分析的数据按照上机的panel进行分组整理,拖动到flowjo中,检查每个样本的上机补偿是否合适,如果不合适在flowjo或者其他软件(例如cytoflex的脱机软件)中微调到合适结果(关于如何调补偿,如果发现补偿不合适,请参考往期内容,这里不赘述)。
当一个补偿合适的结果放到我们面前时,我们接下来要做的就是去进行正式的数据分析了。
第一.明思路
数据分析前一定要明确自己的分析思路,我的思路一般是“两先两后”。
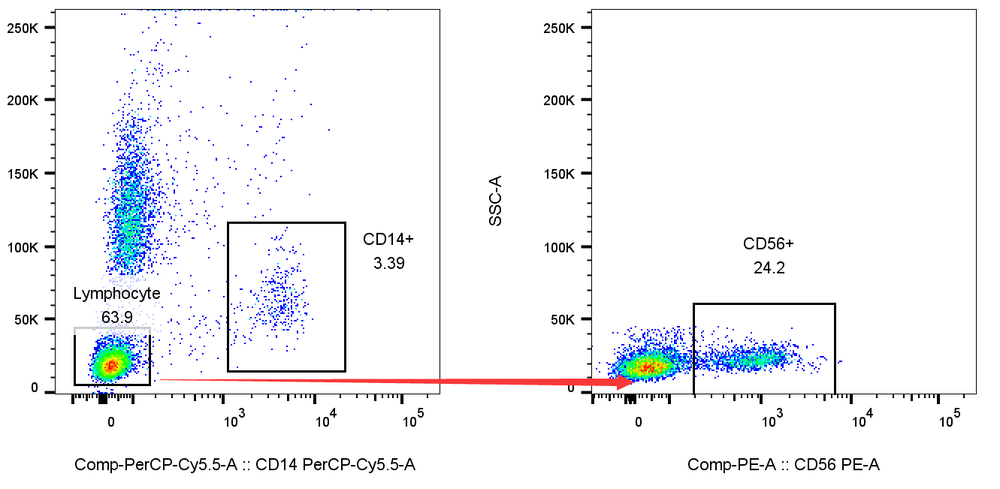
1. 先髓后淋:如果你的样本中包含多个细胞亚群,尤其是同时含有髓系和淋系细胞时,推荐先圈出髓系,后再髓系阴性中圈淋系,因为髓系表面的FC等受体,往往会非特异染色淋巴的抗体,先髓后淋可以获得更加准确的淋巴亚群结果。
例:先分析CD56后分析CD14,会导致CD56阳性偏高,CD14阳性偏低,而如果遵循先髓后淋的原则,结果则会更加准确:
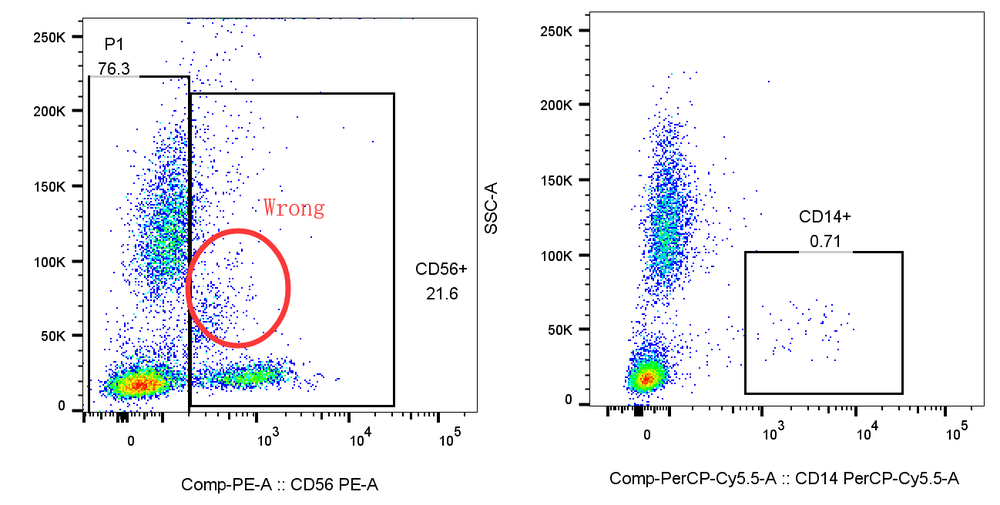
△点击放大图片
△点击放大图片
2. 先准后不准:对于表达准确biomarker的亚群优先gate,留下不准确的亚群最后gate,这个就有点类似于排除法了,也和之前几期讲过的lin值的思路一致,先圈出准确的亚群,留下不准确的亚群进行gate,有助于我们把不准确的亚群也变得准确:
例:肺脏髓系亚群分型,作者先分出容易鉴定的Neu/EOS/mono,再进一步分析得到DC和M亚群:

△点击放大图片
第二,定门型
这个也是很多流式新人不太明了的地方,流式的圈门方式多种多样,十字门,矩形门,圆形门,不规则门等等等,那我到底什么时候用哪种门进行gate呢?这一点其实也只需要根据一句口诀,就是“随形而圈”。
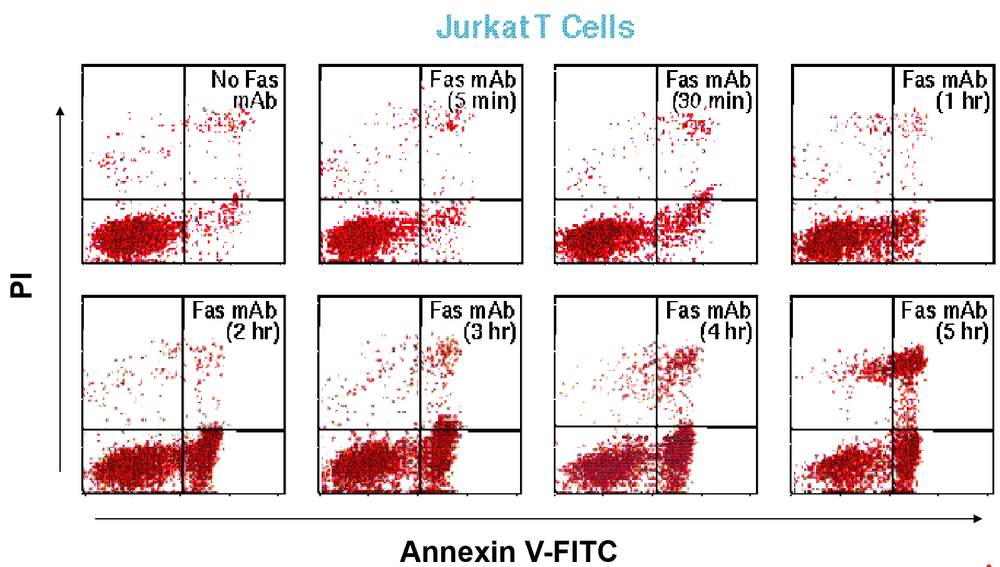
1.当样本分群非常方正,单阳就是单阳,双阳就是双阳,不存在多个单阳/双阳群时,我们一般可以选择十字门进行圈门;
例:最经典的十字门就是凋亡了:
△点击放大图片
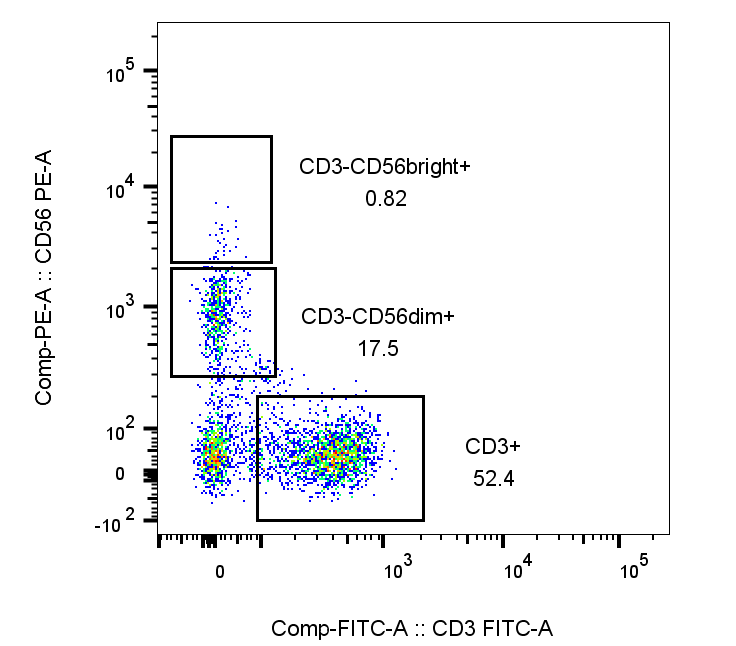
2.当样本的分群比较明显,但是存在多个单阳群,或者多个双阳群且分界清晰时,可以选择矩形门或者多边形门根据细胞的分群,形态进行圈门;
例:在分析NK细胞时,统计CD56的2个分群比例关系:
△点击放大图片
例:通过细胞形态进行CD14/CD11b的多边形圈门,从而分析多个细胞亚群的比例关系:

△点击放大图片
3. 当样本分群不明显时,我们需要根据其FMO或者同型FMO对照,来确定样本的阳性区间,并根据阳性区间的边界进行圈门,此时多推荐矩形门或者象限门;
三,巧统计
当我们把数据圈门按照如上所讲的思路和原则圈门完成后,接下来我们就到了统计分析的时候了,这时候我们也要注意一点,一定要对我们的数据进行合理的统计方式选择,并不是任何时候都是看一个数据的百分比了事的。
总的来说我们一般在流式里有3种统计方式,这里列出给大家参考:
1. 统计百分比:这个应该是最常见的统计方式了,针对我们圈的每一个门,我们都能看到当前门占上一个门的百分比,进而统计出整个细胞亚群中门的百分比,但是需要注意的是,如果某类细胞全部表达一个marker,那么我们就很难通过百分比来得到统计学差异了;
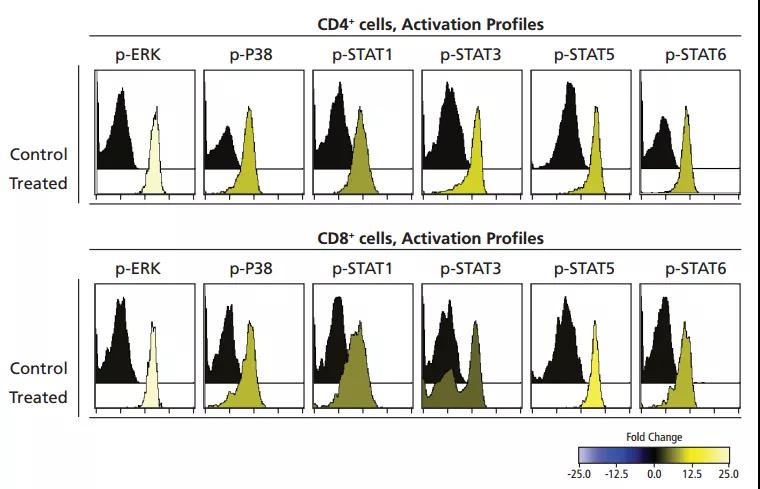
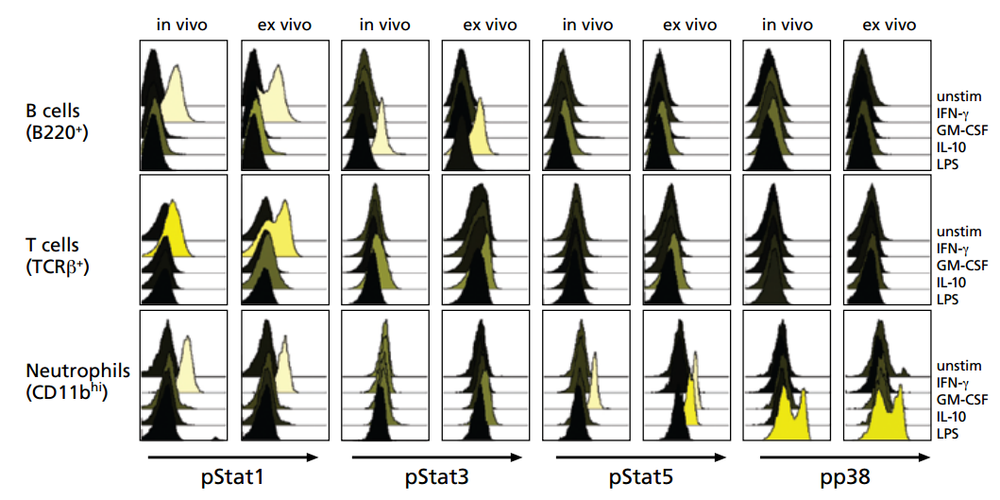
2. 统计平均荧光强度:针对细胞上某种蛋白的表达强度,我们不仅仅可以通过百分比统计,更是可以统计其平均荧光强度来判断样本的表达水平,这样的好处是对于某些都表达的marker,我们也可以根据其表达强弱来统计出差异性;
例:在磷酸化表达的流式实验中,通过MFI表达结果的差异性明显好于通过百分比:
△点击放大图片
3. 对于一些组织中的样本,我们可以利用绝对计数微球来统计出某些细胞占组织样本的绝对占比,从而统计出差异性,比如某个样本中,CD45+的细胞亚群比例没有太大差异,但是CD45细胞本身出现了增加或者减少,我们此时就可以通过绝对计数来发现这种现象,从而完成细微的统计分析。
总的来说,流式的数据分析需要我们有清晰的思路和细致的观察,多多尝试,一定可以得到自己理想的分析结果的。
当然,很多时候也在和大家强调一个问题,就是染色本身,做好流式染色本身也是一个一力降十会的事情,如果各位老师想要系统的了解各类流式染色步骤,也欢迎关注我们本周三的流式集中营:完整的流式实验流程在这里。
【罗工秘籍19】为什么要用降维分析T-SNE展示流式数据
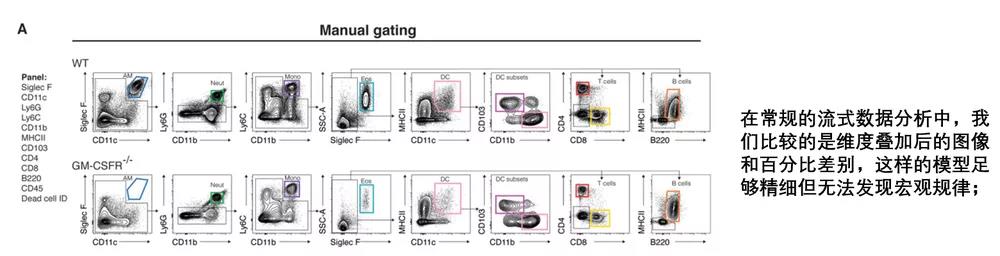
刘老师最近对文献阅读很苦恼:“罗工,我看文献做免疫亚群分析的,这给出来的结果说是用流式做的结果,这怎么和常规的流式图不一样啊?真的是用流式做出来的?
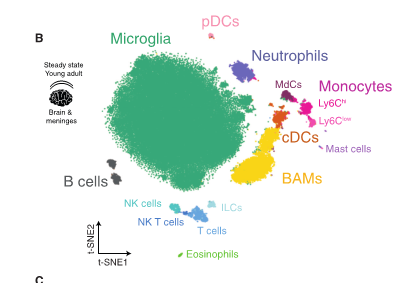
△点击放大图片
是的,这就是流式的数据分析结果,只是展示的方式使用的是最近比较火热的降维分析展示方式。
今天就来做一期超简单教学,告诉大家什么是降维分析,以及如何把自己的流式结果转换为降维分析进行展示。
什么是降维?简单地理解,你手上现在有一个快递盒子,啪一声,你把他拍扁了,这就是降维,或者说你在餐桌上发现一只嗡嗡嗡的苍蝇,这时母上大人啪一声,又扁了。或者说你看过著名的小说《三体》,相信你对其中太阳系二维化的描述也是难忘的吧,嗯,太阳系也扁了。所以简单的说降维分析的关键词就是“拍扁”。把高维度的信息拍扁到2个维度上,呈现出多种信息,就是降维。
那么什么是流式的降维分析?很简单,就是把多个荧光通道的实验结果及其相互关系展示在一张流式结果图上。其实flowjo本身最早的时候就支持3维降2维的常规分析,例如我们在flowjo的双参数散点图下方勾选第三个通道,第三个通道就会以颜色热力的方式展示出来:
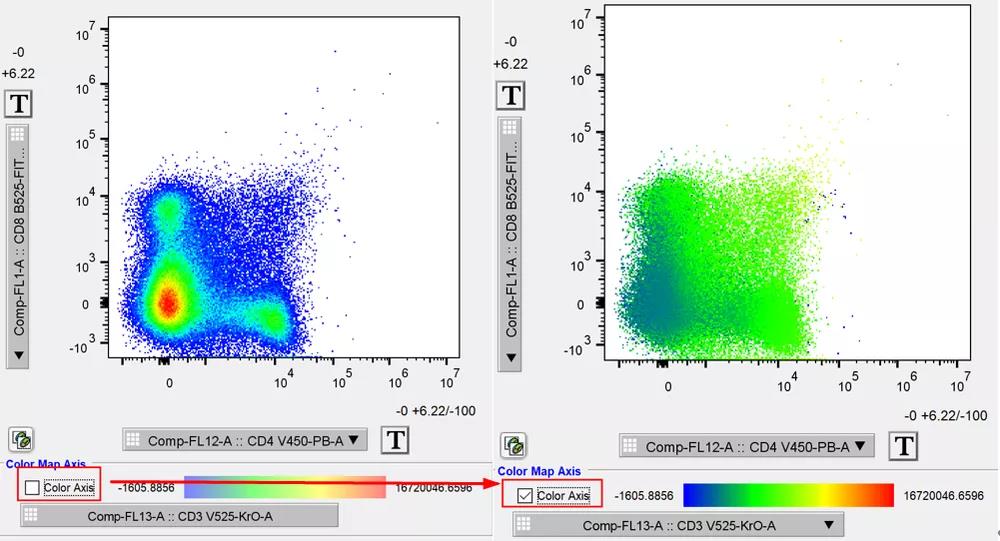
△点击放大图片
此时CD4和CD8以散点的形式表现其荧光强度,而被勾选的CD3以热力的方式表现其荧光强度,同一张二维平面图上出现了3个维度的信息,这就是最简单的降维分析。
那么如果呈现更高,更多参数的维度到一张纸上呢?其实就是将这些荧光通道的信息通过电脑的整合,重新排布在一张散点图上即可。
原本施加2个维度的细胞排列可能是这样的:
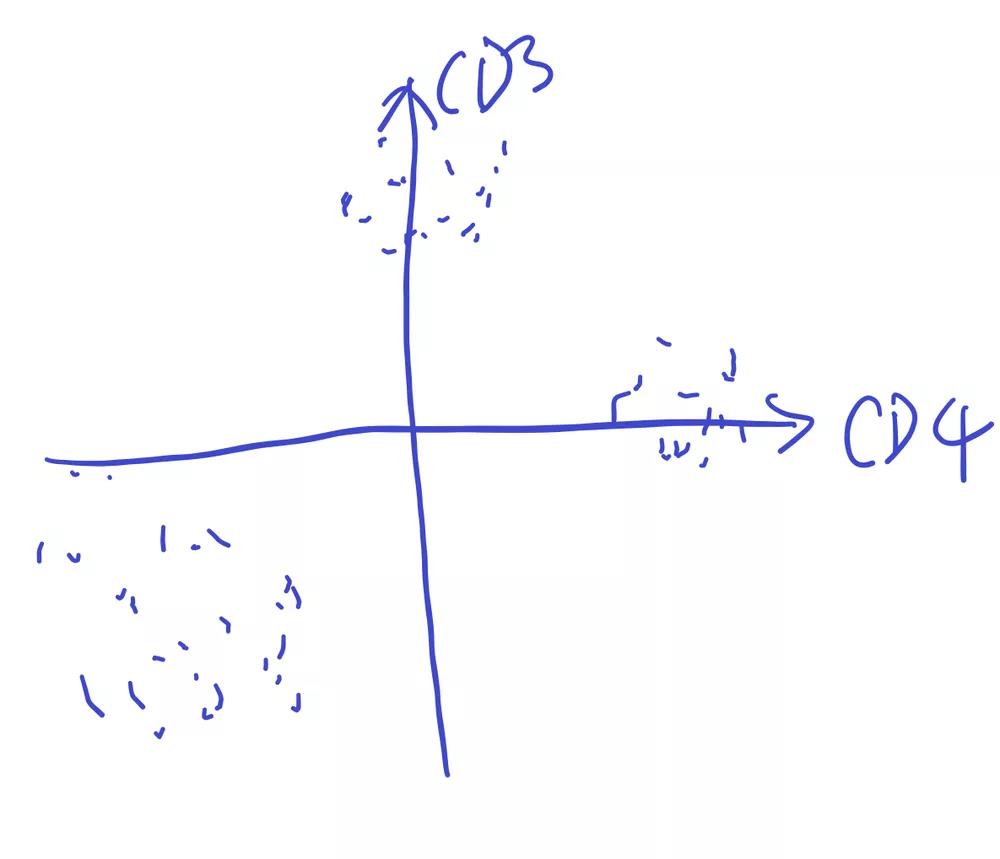
△点击放大图片
当施加3个维度后一部分细胞会伴随第三个维度进行移动,形成新的群落:
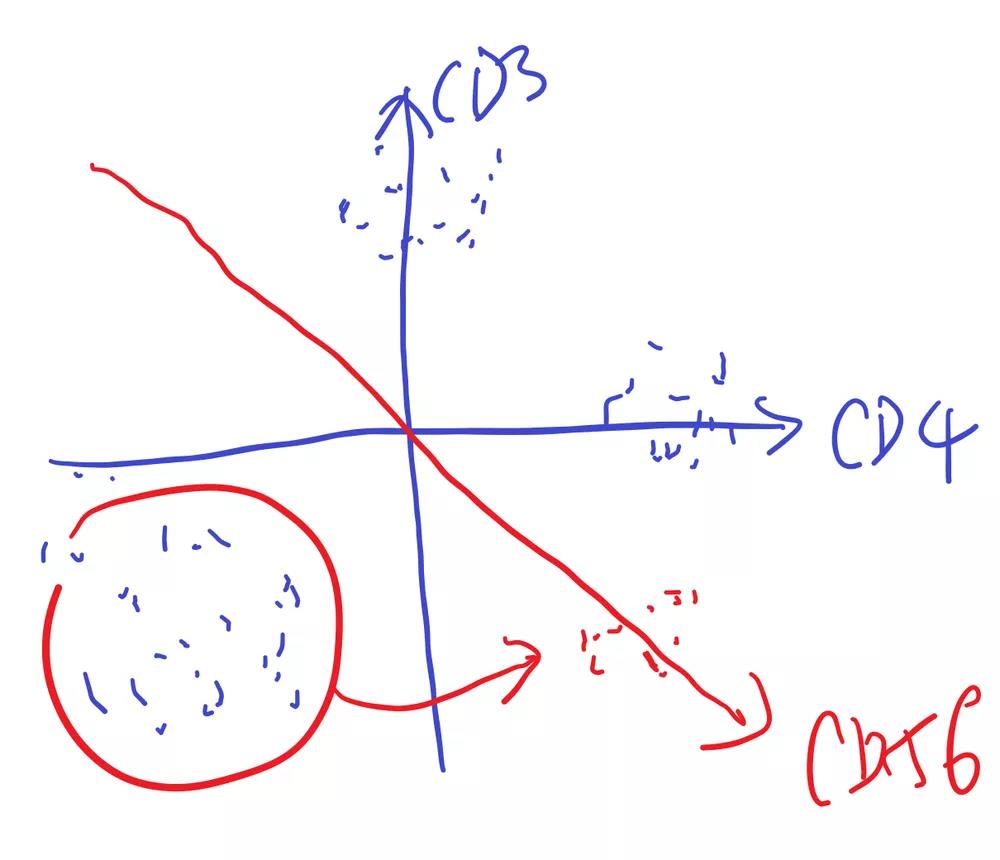
△点击放大图片
当继续施加维度后会继续增加新的群落:
△点击放大图片
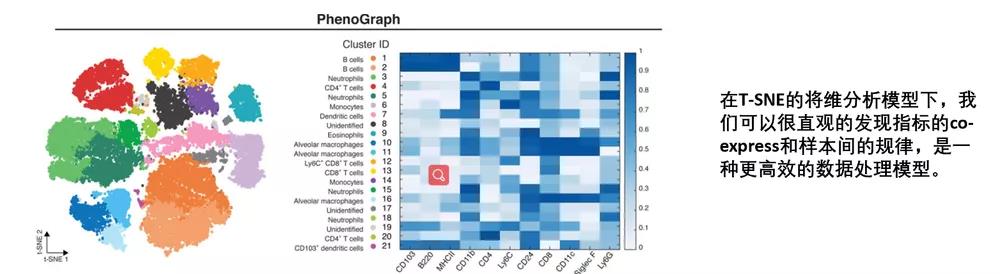
最终在施加多个维度后,实验结果以多个群落的方式进行最终的展示,群落的大小反应了细胞的占比,群落的远近和集中度反应了细胞的蛋白表达水平的高低以及相似度,这就是降维分析的结果展示。
降维分析的好处是原本要很多张流式结果图才能展示清楚的实验结果,现在就简单的1张图就展示清楚了,大大的节约了图片位置,为我们文章的信息量压缩添砖加瓦。所以这种分析方法已经成为信息科学领域的研究热点。在理论和应用上,降维的学习方法都具有重要的研究意义。
△点击放大图片
△点击放大图片
言归正传,如何使用flowjo完成数据的降维分析呢?其实非常非常简单,flowjo支持我们对当前的流式数据进行全自动的降维分析,即T-sne。T-Distributed random Neighbor embedded (tSNE)是一种降维算法,它允许在保持数据结构的同时,在更小的维数下实现复杂多维数据的可视化。
我们打开flowjo,把我们的样本拖入其中,选择样本或是进行必要的gating后(例如肿瘤细胞先圈出CD45+的门),选择合适的门,点击Workspace中的tSNE选项,然后直接点run即可:
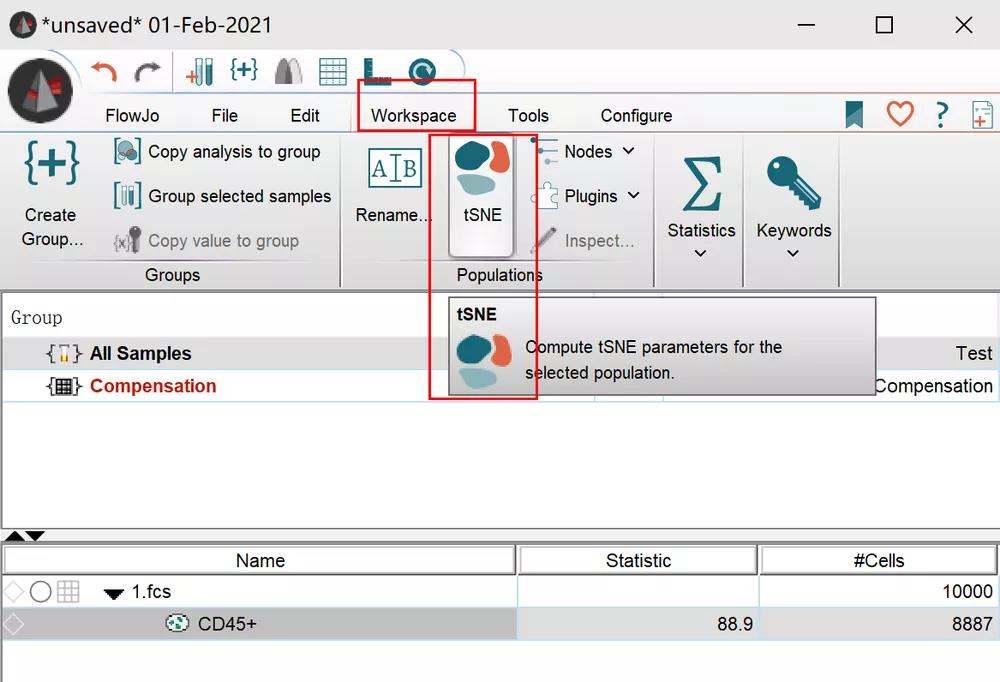
△点击放大图片
之后flowjo会开始自动计算当前gating的降维结果,时间大约1-3分钟左右:
△点击放大图片
计算完成展示的结果如下:
△点击放大图片
此时我们将不同的gating代入layout,即可得到多个细胞亚群在当前Tsne上的展示结果:
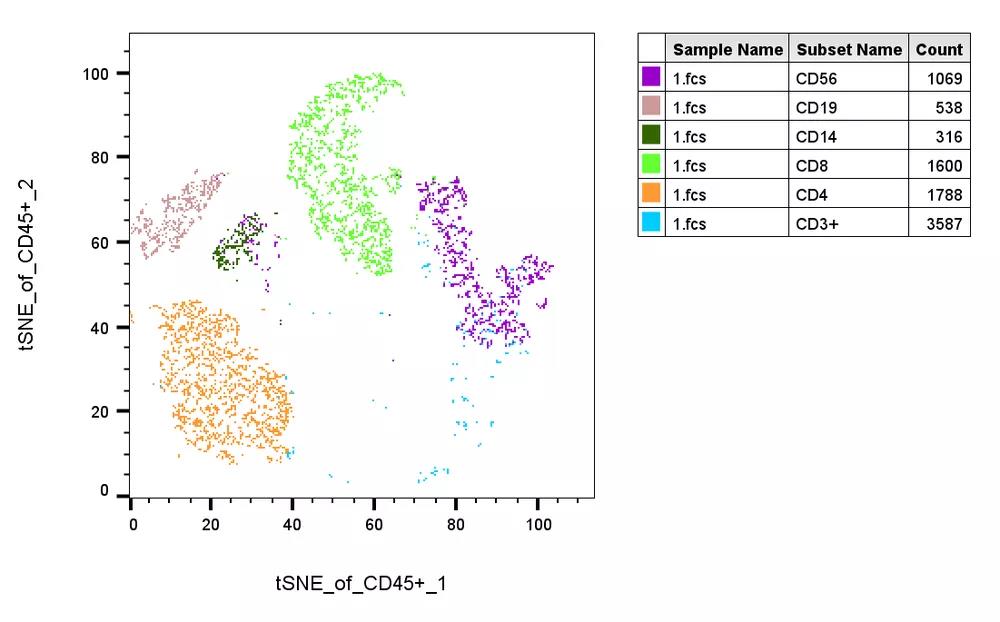
△点击放大图片
5、KeyWords二三事(点击返回目录)
KeyWords二三事: 使用关键字来组织和批处理您的数据
一、 什么是Keywords?
可用来定义样本间的差异(可多个关键词),将多个样本重新分组的依据
二、 快速添加新的关键词途径:(可添加多个关键词)
1、 首先选中一个样本,shift+Ctrl+I,输入关键词(英文),Workspace界面则生成新的一栏(关键词为抬头)
2、 首先选中一个样本,右键,选中Add Keywords,输入关键词(英文),Workspace界面则生成新的一栏(关键词为抬头)
三、 使用Flowjo已有的关键词作为(可添加多个关键词)
1、 shift+Ctrl+K,在Column Values列表里选择合适的参数,Add Column,OK
2、 右击一列的抬头,选择Edit Columns, 在Column Values列表里选择合适的参数,Add Column,OK
四、 每一个样本编辑对应合适的关键词字符
例如:关键词为刺激条件,每个样本需要编辑具体刺激条件是什么(英文简写或者数字代替)
五、数据导出
Table Edit

△点击放大图片
1、 导入计算公式,例如Median值
首先选中要分析的细胞群体,右键,选择Add,Statistic,跳出弹窗;先选择Median,再选择Population的参数(比如IFN),点击Add(如不需要其他统计数据,可关掉弹窗,反之继续添加),添加成功后,样本群体下方会出现对应的公式和计算结果

△点击放大图片
2、 选中添加后的公式,右键,copy analysis to group,批量应用到其他样本上
△点击放大图片
3、打开Table Edit

△点击放大图片
4、 设置Group(All samples或各自Group); 设置Iterate by(sample/Keyword)
5、 若是选择Iterate by sample,将一个样本的对应添加的公式直接拖拽到Table Edit界面上,可填写Name(自定义),然后点击Create Table;弹出结果Table,点击File,选择save as形式,进行保存。
6、 若是选择Iterate by Keywords,需要选择Iterate by 和 Discriminator各自的关键词
7、 同样向Table Edit界面拖拽对应的公式, 注意点:需要拖拽不同样本下相同的公式,样本根据Discriminator选择的关键词来决定
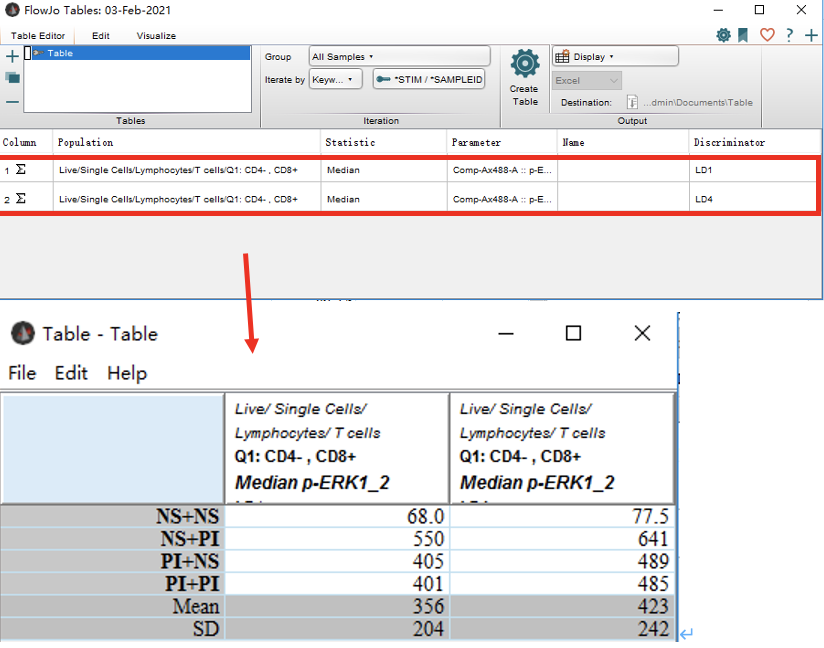
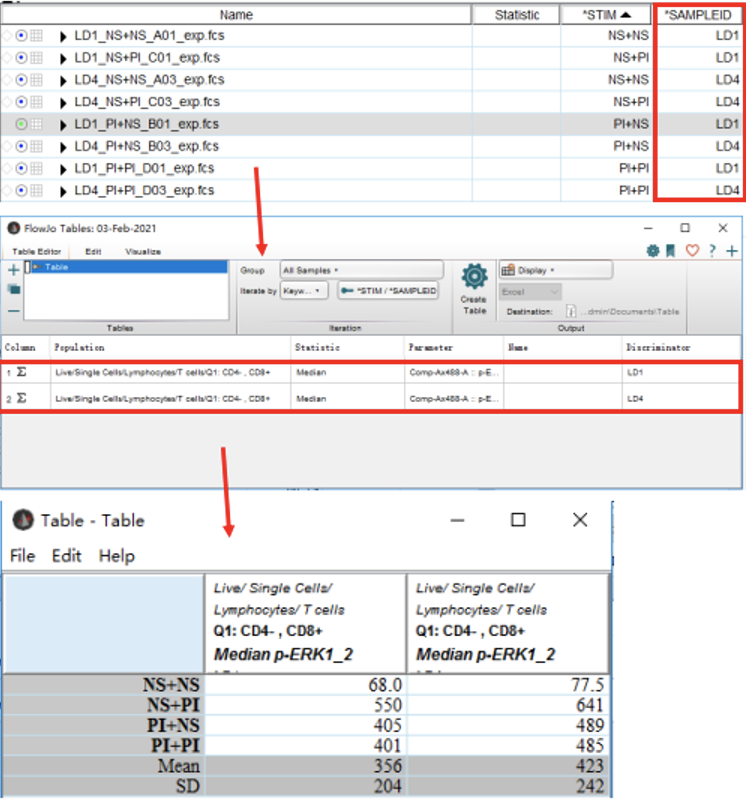
举例:Iterate by STIM,Discriminator为SAMPLEID
1)则先确认,当前需要导出数据的样本中SAMPLEID关键词栏下的每个样本的标记,比如下图 SAMPLEID栏,所有的样本中只有LD1和LD4两种标记;( 如果 Iterate by SAMPLEID,Discriminator为STIM,则确认STIM栏)
2)所以我们需要拖拽SAMPLEID标记为LD1和LD4两个样本下对应相同的公式到Table Edit中;
3)可填写Name(自定义),然后点击Create Table;弹出结果Table,点击File,选择save as形式,进行保存
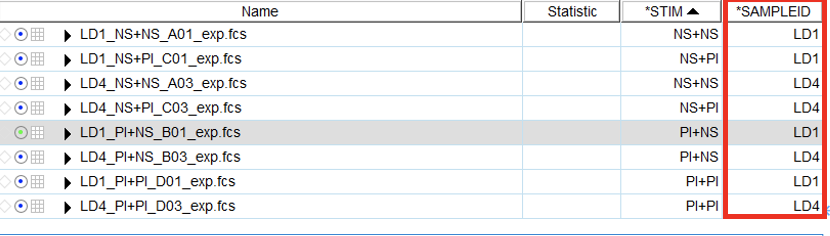
△点击放大图片
△点击放大图片
4)表格中数据从左往右和拖拽后的公式的排列顺序对应( 如上图,第一列是 LD1类型样本的数据,第二列是LD4 类型样本的数据)
8、在Table界面,可点击Edit,点击select all,再右键,选择Heat Map,可制成热图
△点击放大图片