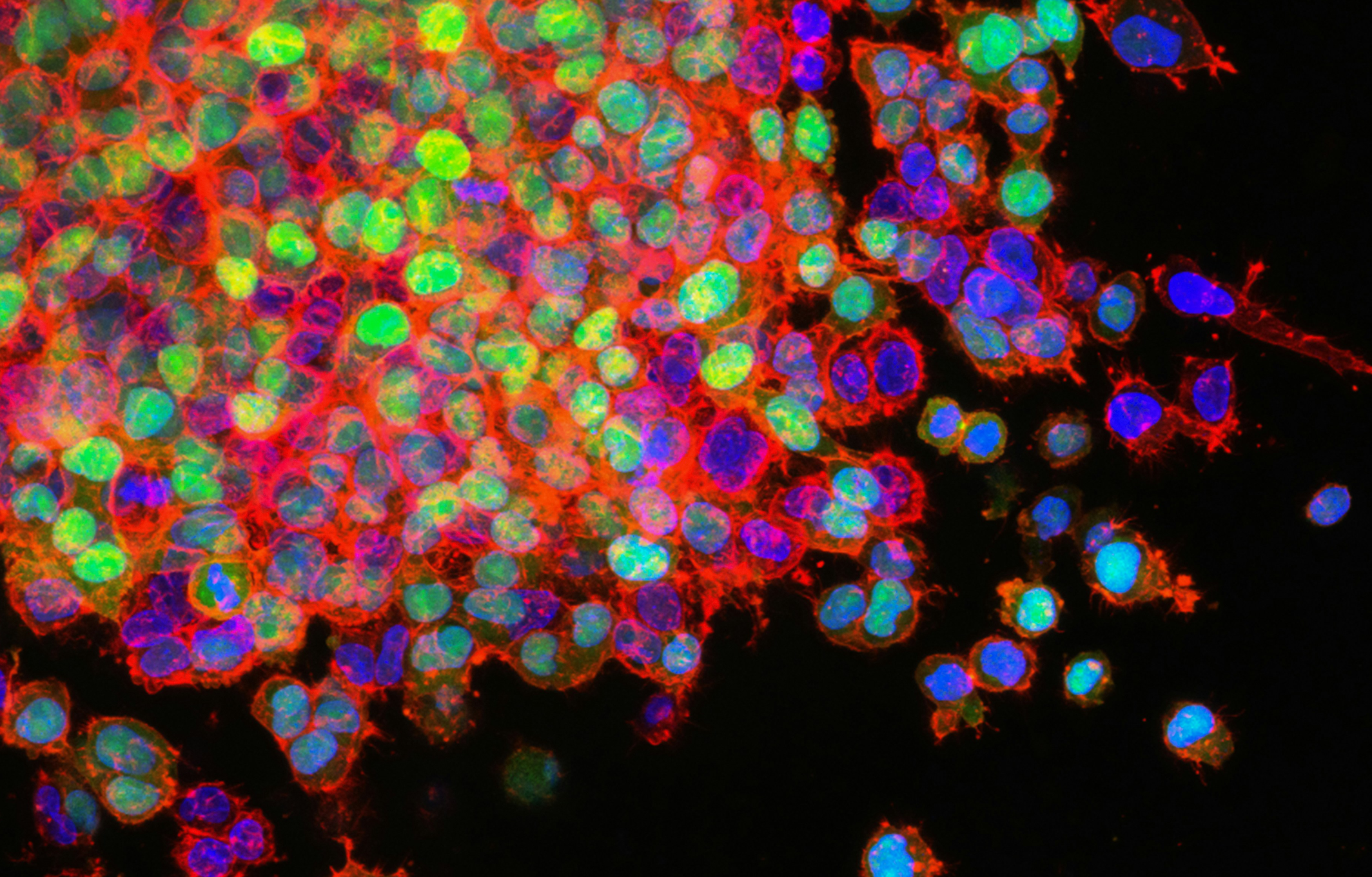
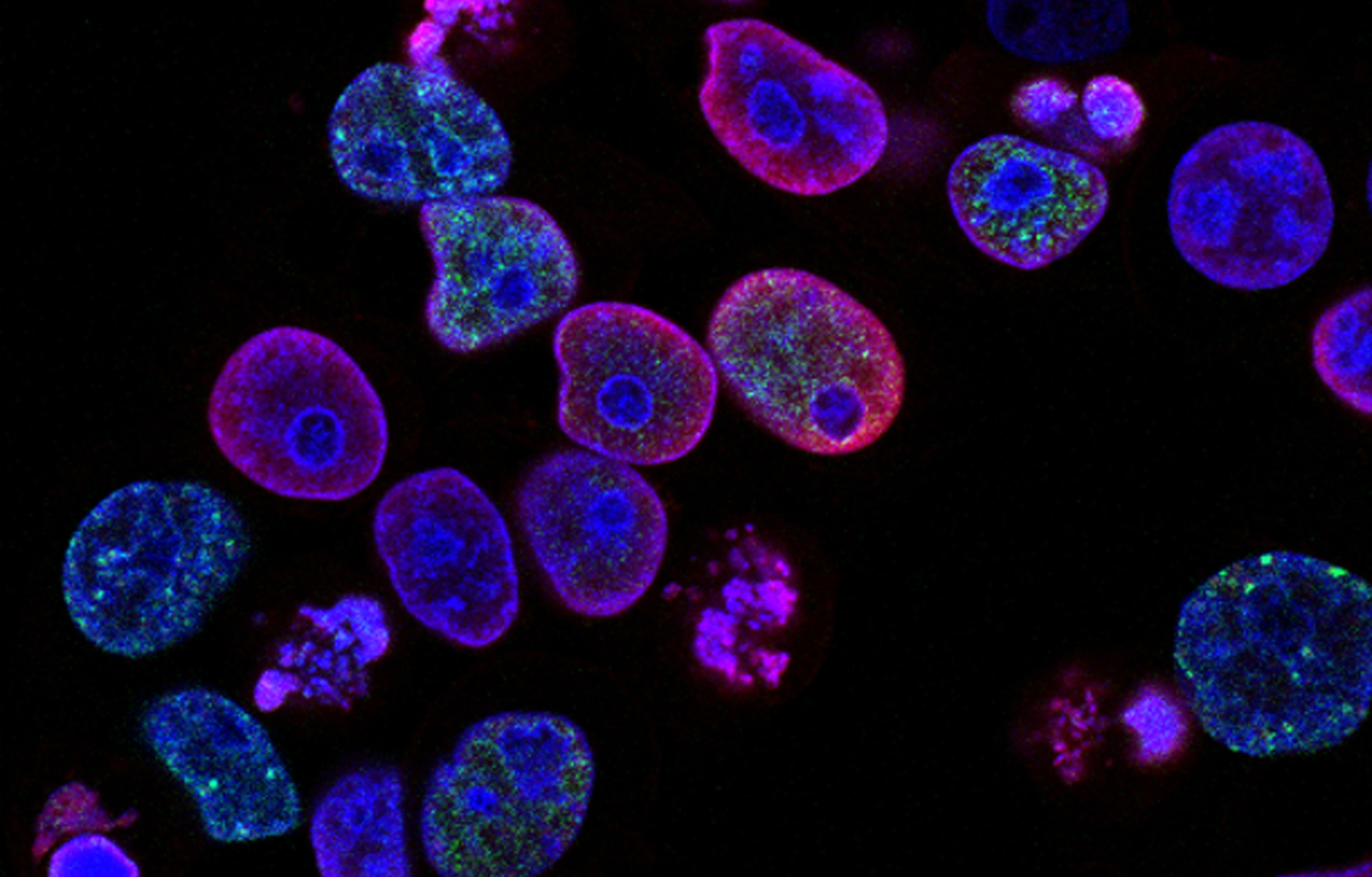
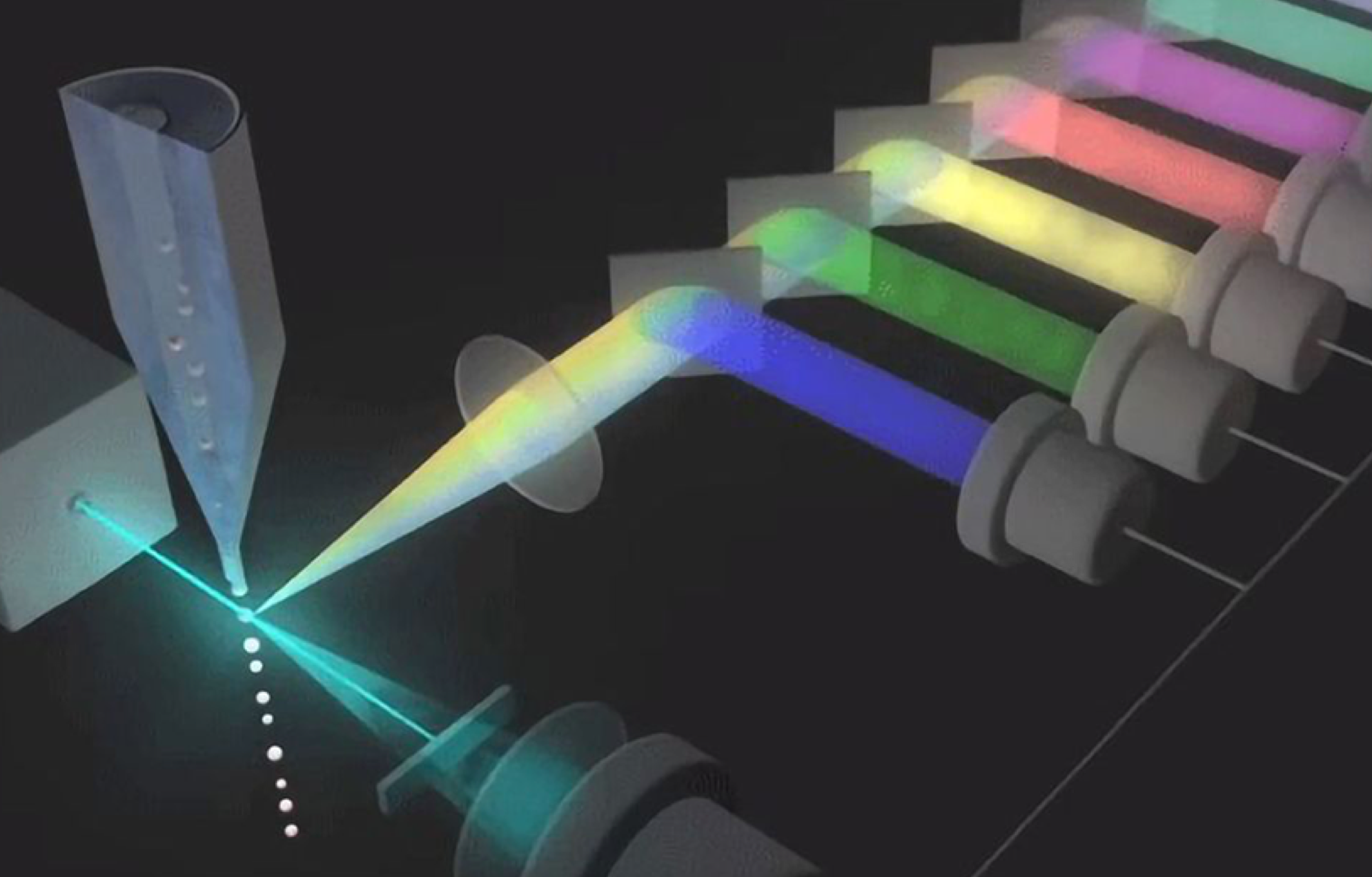
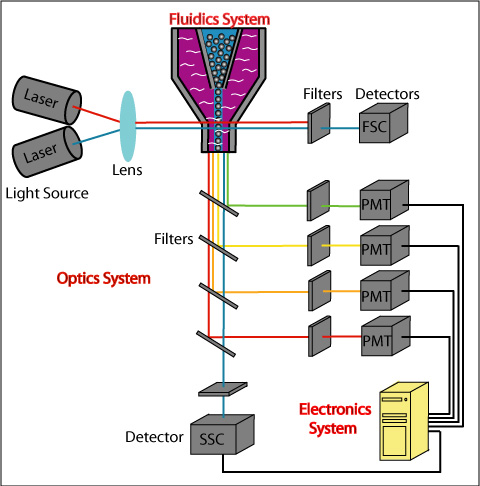
光子倍增管(PMT)是流式最常用的探测器类型,可通过电压增益的调节,从而能够获得最佳分辨率,也就是我们通常所说的上机时模板的电压调节,它也是我们获取数据的重要影响因素。下面给大家介绍一下如何优化仪器特性和电压调整:
△点击放大图片
一、CS&T质控
对于流式仪器,为了检测其仪器激光的稳定性和群体的分辨率等,日常开机操作前都需要维护,进行CS&T质控。健康的仪器才足以确保不同时间检测批次间的稳定性、可比性及仪器对低频细胞的分辨率等。
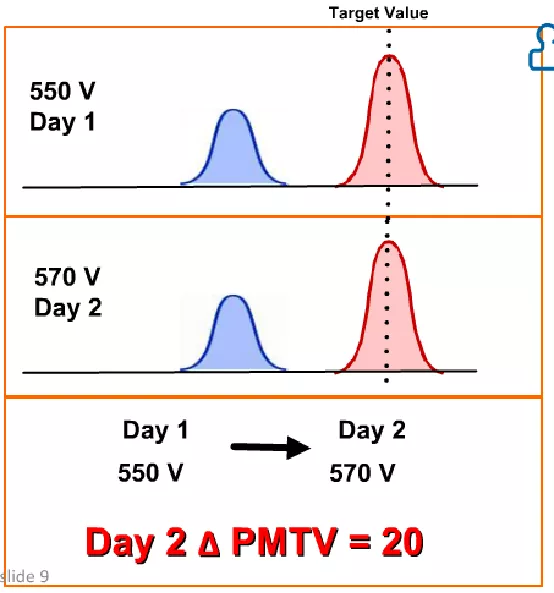
相同激发水平不同日期所需的电压会不同
△点击放大图片
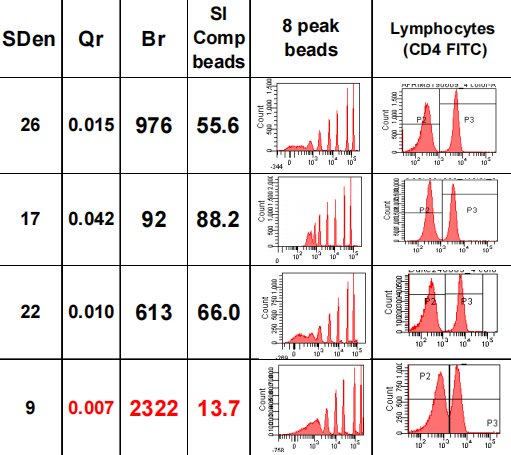
Qr分辨率的下降、CV值的上升,会降低低频细胞分群水平
△点击放大图片
我们购买的CS&T微球包含了dim, medium, and bright 的三种荧光强度的微球,在初始设置过程中,使dim微球的信号比电子噪声的Robust standard deviation(rSD)高10倍,从而确定电压。随后,bright微球的信号用于设定目标值,在日常质量控制(QC)期间,通过修改探测器的电压来匹配目标值。
由于CS&T微球的荧光信号和样本细胞的自发荧光以及流式抗体的荧光素种类如果是不同的,直接利用CS&T的PMT电压,可能会不准确, 所以需要手动降低或增加各通道的电压。怎么才算调整好呢?下面的电压滴定的方法给了大家详细的解说。
二、电压滴定
1. 获得特定克隆的抗体(比如同一个物种的CD4)。
2. 获得细胞(通常为质控血,冷冻保存的PBMC或小鼠脾细胞)。
3. 以饱和的抗体浓度来制备每个荧光抗体的稀释液。
4. 将细胞分入96孔板中,500000个细胞/孔。
5. 400 g,5min离心,去上清。
6. 每孔加入100μl单一抗体稀释液,重新悬浮,然后常温避光20min。
7. 向所有孔中加入200μl染色缓冲液,400g,离心5min,总共洗两次。
8. 可选:向每个孔中添加100μl固定剂,重新使用,然后在避光孵育20min。
9. 向所有孔中加入200μl的染色缓冲液,400g,离心5min,去上清。
10. 200μl染色缓冲液重悬,4℃的避光储存,直到上机。
11. 按照要求启动流式细胞仪并进行日常质控。
12. 上样,单染管,调整电压,每次增加30V,从200V调到700V,记录每个荧光通道的电压,细胞数量为10000个(BV421 200V,BV421 230V,BV421 260V等)。
13. 忽略超出检测器线性或不再在刻度上的MFI已发生变化的样本,因为可能会报告错误值。
14. 对所有单色样本重复此步骤。
15. 以FCS3.0格式导出数据。
16. 根据给定的单色对照,圈出阳性峰和阴性峰的门。
17. 可选:应用给定文件的各个FCS文件,将单一染色的对照品放入单个FCS文件中,或生成组织图叠加。
18. 对所有单色样本重复此步骤。
19. 计阴阳峰两者的中值荧光强度(MFI),以及阴性峰的rSD。
20. 使用以下公式计算每个样品的染色指数(SI):SI =MFI(pos)-MFI(neg) /(2 X rSD)。
21. 以SI为Y轴,电压为X轴,绘制曲线。
22. SI达到平台期时,就是我们要选择的最合适的电压。
23. 确定最佳基线PMT电压后,记录参考微球的数据(如Spherotech Ultra Rainbow珠子),便于之后的维护。
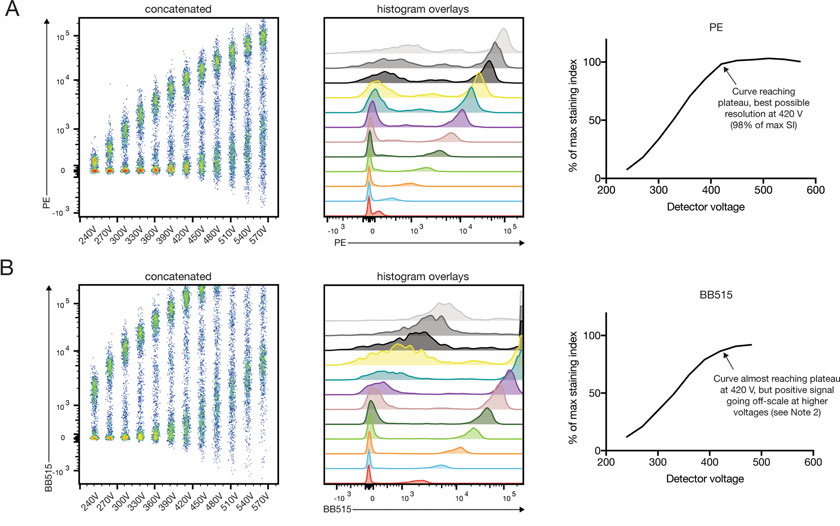
△点击放大图片
合适的电压的设置有利于待测标志物的分群
三、设置和维护MFI值:
1. 具体操作是,1-23操作后,在设置的基线PMT电压下,上样参考微球,保证有足够的阳性信号,记录数据,收集数量为20000个。
2. 为所有荧光通道创建直方图,并确定MFI。
3. 导出所有样本的MFI,并计算平均MFI和SD。
4. 在日常仪器特定启动和QC程序之后,以及每次实验之前,获取参考微球,并调整每个探测器的PMT电压,以将信号设置为匹配目标MFI±5%。(或±基于可接受的可变性,可关闭可选标准偏差计算)。
不管是基于CS&T质控的电压调整,还是自己电压滴定,都是为了我们检测样本时,仪器的精准性和标准化。所以做流式实验的同学,不仅要样本制备好,仪器参数也要设置好哦。
参考文献
[1] J. Philip McCoy. Immunophenotyping Methods and Protocols:5-10
[2] Moncunill G, Han H, Doban˜o C et al (2014) OMIP-024: pan-leukocyte immunophenotypic characterization of PBMC subsets in human samples. Cytometry A 85:995–998.
[3] Perfetto SP, Ambrozak D, Nguyen R et al(2012) Quality assurance for polychromatic flow cytometry using a suite of calibration beads. Nat Protoc 7:2067–2079 .
[4] Meinelt E, Reunanen M, Edinger M et al Standardizing application setup across multiple flow cytometers using BD FACSDiva Version 6 Software: technical bulletin .