一、流式为什么要染死活染料?
样品中死细胞的存在会极大地影响流式检测效果,从而最终影响数据质量及真实性。
这主要是因为:
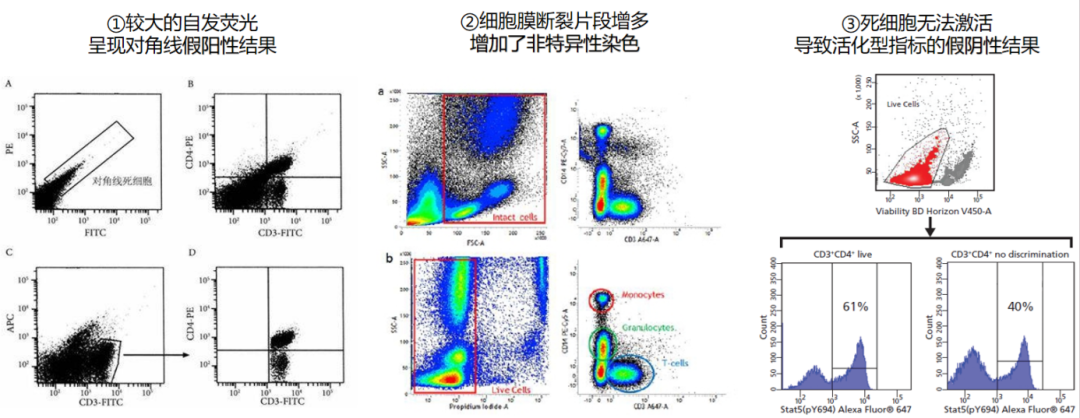
①死细胞具有更大的自发荧光,且这种自发荧光信号几乎在所有荧光通道均可检出;
②会增加非特异性的抗体结合,导致假阳性并增加背景信号从而降低阳性信号的动态范围,这可能会使弱阳性样本和稀有群体的鉴定变得困难;
③死细胞还无法刺激表达活化功能相关的标志物,从而导致一些比真实阳性率偏低的假阴性结果产生。
我们常规操作中的,离心、洗涤等步骤就会产生少量死细胞,如果样本本身就是一些细胞活性较差的来源,如非免疫类的组织制备的细胞悬液,病人或长时间放置的血液样本,做细胞培养或模型诱导的体外培养的细胞样本,那细胞活性就更差了,因此推荐大家做流式实验的时候,尽量都不要省去死活染料的搭配。
△点击放大图片
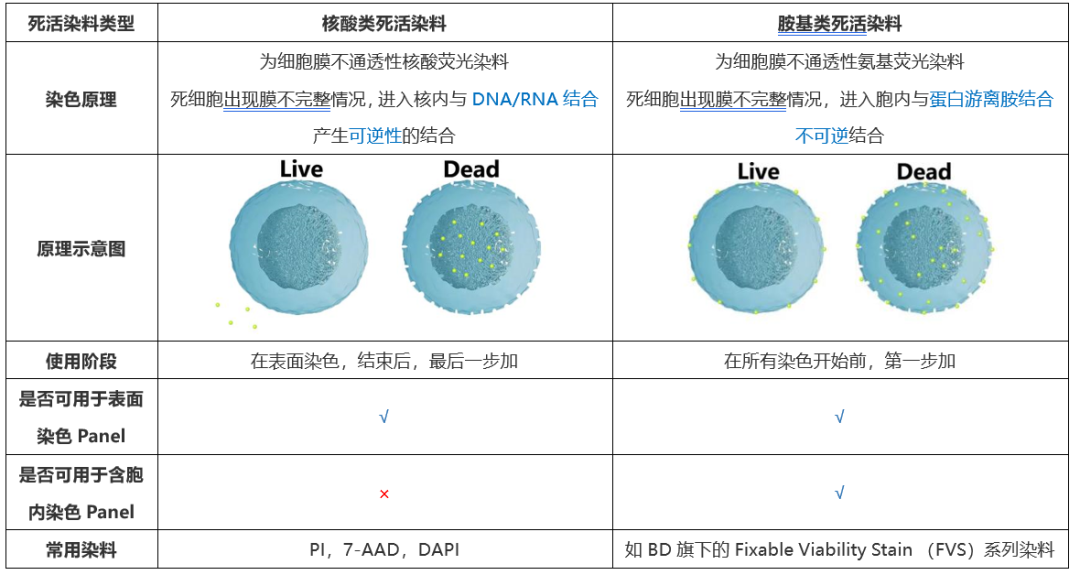
二、死活染料试剂种类及检测原理:
△点击放大图片
三、荧光搭配的选择:
死活染料之间的互相之间的区别,除结合原理外,主要就是检测对应的荧光通道不一致,各位老师们可以根据自己仪器的实际情况,选择不冲突的荧光,进行多色搭配即可,详见下表:
| 染料 | 不固定细胞 | 固定细胞 | 检测通道 | 激光器 | 货号 | |
| 核酸类染料 | PI | V | X | PE/PE-CF594 | Blue/YG | 556463 |
| 核酸类染料 | 7-AAD | V | X | PerCP/PerCP-Cy5.5 | Blue/YG | 559925 |
| 核酸类染料 | DAPI | V | X | BV421/BUV | UV/Violet | 564907 |
| 核酸类染料 | Via-Probe Green | V | X | FITC/AF488 | Blue | 565799 |
| 胺基类染料 | DRAQ7™ | V | X | APC/AF647 | Red | 564904 |
| 胺基类染料 | Via-Probe Red | V | X | APC/AF647 | Red | 565803 |
| 胺基类染料 | FVS450 | V | V | BV421/Pacific Blue | Violet | 562247 |
| 胺基类染料 | FVS510 | V | V | BV510/Amycan | Violet | 564406 |
| 胺基类染料 | FVS575V | V | V | BV605/Qdot605 | Violet | 565694 |
| 胺基类染料 | FVS520 | V | V | FITC/AF488 | Blue | 564407 |
| 胺基类染料 | FVS570 | V | V | PE | Blue/YG | 564995 |
| 胺基类染料 | FVS620 | V | V | PE-CF594 | Blue/YG | 564996 |
| 胺基类染料 | FVS660 | V | V | APC/AF647 | Red | 564405 |
| 胺基类染料 | FVS700 | V | V | AF700 | Red | 564997 |
| 胺基类染料 | FVS780 | V | V | APC-H7 | Red | 565388 |
PS:死活染料激发光谱和发射光谱跨度较宽,在仪器可用通道较少时,可以选用一些相邻荧发射光通道或其他激光通道激发下也可检测,使用前可详细阅读产品说明书,或在BD官方的光谱查看器,查看荧光对应的光谱信息:
https://www.bdbiosciences.com/zh-cn/resources/bd-spectrum-viewer
四、染色流程:
①核酸类死活染料:
a.按常规流式染色流程,完成表面染色后;
b.在1×10^6细胞 的100 µl细胞悬液中,加入适量核酸类死活染料,轻摇混匀;
(7-AAD(Cat. 556463): 5 µl, 50 µg/ml;PI(Cat. 556463): 10 µl, 50 µg /ml;DAPI(Cat. 564907): 0.5~2 µl, 1 mg/ml;其他染料也请按照说明书推荐用量并结合预实验摸索最佳染料用量)
c.避光室温孵育5 min;
d.1 h内进行流式上机检测。
②胺基类死活染料:
a.使用前,先将染料粉末,请根据说明书中的“Preparation”部分所写的体系,使用细胞培养级别的DMSO,对粉末在室温条件下,进行充分涡旋溶解;
b.使用不含叠氮化钠和不含蛋白质/血清的 Dulbecco 磷酸盐缓冲液(1X DPBS),清洗细胞一次;
c.在无叠氮化钠和无蛋白质/血清的1X DPBS中以 1-10x10^6 个细胞/ml重悬细胞;
d.每 1 ml 细胞悬液 (1:1000) 加入 1 μl 溶解后的FVS死活染料,涡旋混匀;
(注意:我们建议滴定染料以获得最佳性能,因为不同的细胞类型和不同的应用可能会导致染色的可变性程度很大。)
e.推荐避光室温下孵育 10~15 min(可选:37°C 孵育 5~7 min或 2-8°C 孵育 30~60 min);
f.用 2 ml BD 的Stain Buffer(Cat. 554656)或替代物(如含1-2%血清的PBS等)洗涤离心收集细胞两次;
g.用Stain Buffer或替代物重悬细胞;
h.根据下游应用的需要,按常规流式染色流程对细胞进行FCR阻断、表面染色、固定破膜及胞内染色等。
五、实验注意事项:
1. FVS胺基类死活染料,收到时为粉末状,于-80℃长期保存;工作液需用DMSO充分涡旋溶解,分装成小份,保存于-20℃,避免反复冻融(溶解前建议先将试剂管,放于离心离心机离心,以确保试剂聚集在管底);溶解后理论保存期限为90天。
2.FVS胺基类死活染料,染色前细胞染色缓冲液中不能含有血清,避免中和掉死活染料导致假阴性;染色后的洗涤液中需包含有血清,中和掉未结合的死活染料。
3.核酸类死活染料4℃保存,不能冻存。
4.核酸类死活染料染色后,避免洗涤,剧烈涡旋或过度用力吹打, 避免核酸类死活染料染料的脱落,导致假阳性。
5.核酸类死活染料染色后,需及时上机(1h内),避免染料的毒副作用导致额外的死细胞产生。
六、常见问题:
Q1:染了死活染料可以就不管样本制备好坏了么?
A1:这个不是的呢。死活染料只能帮助大家,在收样后,通过分析层面排出死细胞的干扰,并不能直接去除死细胞。
活细胞数量过少还是很可能会导致部分目的细胞收集数量过少,导致数据不可信。另若样本整体活性不佳,有可能导致细胞整体处于死活染料对应的荧光强度,位于活细胞群和死细胞群中间的活性不是很好的细胞过度区域。而由于活性很好的细胞群过少,容易将这群状态已经不是很好的群体,误认为活细胞群,进而影响真实结果的统计。
样本制备得到的单细胞悬液中的活细胞水平,是做好流式结果的最重要因素。
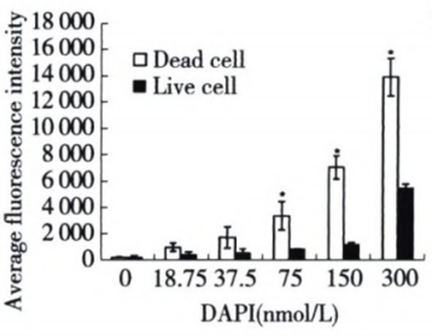
Q2:DAPI到底能否做死活染料?
A2:虽然Dapi有一定的膜穿透能力,但是是可以用于做死活染料的,有很多文献有相关结果可以证明,只是活细胞也会像FVS染料一样有部分着色,呈弱阳性信号。因此针对不同的细胞类型和细胞数量,可以适当进行DAPI染料的染色浓度摸索,以达到更好的分群效果。
△点击放大图片
Q3:FVS胺基类死活染料,能用多少次?100次的么?
A3:BD的FVS系列死活染料,虽溶解后的染色体系都是1:1000使用,但是不同荧光通道的FVS染料,溶解后的终体积不同,导致染色次数不一样,请大家使用前,仔细阅读说明书,不要根据经验操作。如BV605荧光通道的Fixable Viability Stain 575V(Cat. 565694),是用340 μl DMSO溶解,即至少可用340次;而AF700荧光通道的Fixable Viability Stain 700(Cat. 564997),是用310 μl DMSO溶解,即至少可用310次。
Q4:FVS胺基类死活染料超过90天还能用么?
A4:保质期就是厂家推荐的最佳产品使用限期,跟食品和抗体一样,不是不能用,只是效价等有可能会改变,以及不再享受质保而已。很多老师在过期后,预实验摸索体系,还能跟之前实验达到一样的染色效果,就可以继续使用的。